Suivez-nous sur les réseaux sociaux !
Sommaire du chapitre :
Publications
Chapitre 2 – Facteurs de risque cardiovasculaire
Auteurs : L. Amar, M. Azizi , F. Boccara, A. Cohen, A. Lorthioir, J.-J. Mercadier, A.-I. Tropéano, E. Vidal-Petiot
2.1 Hypertension artérielle
L. Amar, M. Azizi , A. Lorthioir, J.-J. Mercadier , A.-I. Tropéano et E. Vidal-Petiot
Introduction et définition
L’hypertension artérielle (HTA) est définie comme le niveau de pression artérielle (PA) à partir duquel les bénéfices de la réduction sont indiscutables en tenant compte des inconvénients liés au traitement. En Europe, selon les recommandations publiées en 2018, l’HTA est définie par une pression artérielle systolique (PAS) ≥ 140 mmHg et/ou une pression artérielle diastolique (PAD) ≥ 90 mmHg. Il est à noter que les recommandations américaines récentes ont modifié le seuil de définition de l’HTA à PAS ≥ 130 mmHg et/ou une PAD ≥ 80 mmHg. L’HTA, facteur de risque cardiovasculaire majeur, est une pathologie fréquente qui nécessite une prise en charge optimisée pour obtenir un contrôle tensionnel chez la majorité des patients.
Physiologie : la pression artérielle systémique et sa régulation
Pression artérielle, son rôle dans la circulation
Puisque le sang circule du cœur gauche vers l’oreillette droite, c’est qu’il existe une différence de pression, ΔP, entre la sortie du ventricule gauche (VG) et l’oreillette droite. La pression artérielle systémique, le plus souvent désignée pression artérielle (PA, systémique étant sous-entendu), est la pression qui règne dans le secteur artériel de la circulation systémique, donc dans les vaisseaux qui conduisent le sang du cœur aux organes.
La finalité du système cardiovasculaire étant d’apporter à tous les tissus et organes l’oxygène et les nutriments nécessaires à leur bon fonctionnement en toutes circonstances, c’est-à-dire au repos comme lors de l’effort, le débit cardiaque doit pouvoir s’adapter à la variabilité des besoins. Mais la bonne perfusion des tissus et des organes nécessite également une PA suffisante qui doit ainsi rester « contrôlée ». C’est pourquoi le débit cardiaque s’adapte aux besoins tandis que la PA systémique est régulée pour ne pas s’éloigner de la valeur permettant une bonne perfusion tissulaire appelée valeur cible.
La PA est quasiment constante depuis la sortie du VG, à l’origine de l’aorte, jusqu’aux vaisseaux qui sont immédiatement en amont des organes. Elle chute lorsque le sang rencontre une résistance à son écoulement, au niveau des artérioles de résistance. Elle oscille entre une valeur haute, appelée PA systolique (PAS, environ 120 mmHg) et une valeur basse appelée PA diastolique (PAD, environ 80 mmHg). Cette variation provient de la pulsatilité du débit cardiaque (voir chapitre 1, Cœur). En effet, l’éjection du volume d’éjection systolique (VES) par le VG est le principal déterminant de la PA systolique et, pendant la diastole, le niveau de PA redescend jusqu’à sa valeur minimale, la PA diastolique. La valeur moyenne de la pression artérielle (PAM) peut être approchée grâce à la formule de Burton : PAM = PAD + (PAS-PAD)/3.
Pendant l’éjection ventriculaire, les grosses artères se distendent, d’autant plus qu’elles sont plus compliantes (moins rigides, voir chapitre 1, La circulation systémique), ce qui est le cas chez le sujet jeune. Cette déformation des grosses artères en systole est appelée effet windkessel (chambre à air en Allemand). Le volume de sang ainsi stocké pendant la systole est restitué pendant la diastole. Ce phénomène qui se transmet de proche en proche le long de l’arbre vasculaire sous forme d’une onde artérielle permet d’amortir la pulsatilité de l’éjection du VES et de transformer le débit intermittent généré par le VG en débit pratiquement continu au niveau capillaire. Ainsi la PA, très pulsatile dans les gros vaisseaux, s’amortit pour être pratiquement dépourvue de pulsatilité dans les capillaires.
Déterminants des pressions artérielles
Chacune des pressions artérielles systémiques (PAS, PAD et PAM) répond à des déterminants précis, qu’il convient de distinguer des mécanismes de régulation de la pression artérielle.
Déterminants de la PAS
Le VES, la vitesse d’éjection, la compliance artérielle et bien entendu la PA moyenne sont les quatre déterminants de la PAS. Plus le VES est grand et plus son éjection est rapide, plus la PAS est élevée. La compliance artérielle est également un déterminant important de la valeur de la PAS. Un même volume de sang éjecté dans des vaisseaux peu compliants génère une PAS plus élevée que dans des vaisseaux compliants qui, en se déformant, amortissent l’augmentation de pression. C’est ce que l’on observe au cours du vieillissement quand l’aorte et les gros vaisseaux deviennent plus rigides, expliquant ainsi la fréquente élévation de la PAS chez les personnes âgées. Ainsi, pour une valeur de PAM donnée d’un individu en conditions stables, la valeur de la PAS reflète avant tout les propriétés de l’arbre artériel (augmentation de la PAS avec la rigidité vasculaire). Les variations rapides de PAS reflètent, quant à elles, les variations du VES et de la vitesse d’éjection.
Déterminants de la PAD
La durée de la diastole, la compliance artérielle, les résistances périphériques et la PAM sont les quatre déterminants de la PAD. La décroissance de la PA pendant la diastole étant exponentielle, pour un niveau donné de PAM, la PAD est d’autant plus basse que la durée de la diastole est longue. Pendant l’éjection ventriculaire, l’aorte et les grosses artères ont stocké, grâce à leur compliance, un important volume de sang qui est restitué pendant la diastole. On comprend ainsi que plus les gros vaisseaux sont compliants, plus le volume de sang restitué en diastole est important, et plus la valeur de PAD est élevée. Enfin, la décroissance de la PA pendant la diastole est d’autant plus lente que des résistances périphériques élevées résistent à l’écoulement : la PAD est donc plus élevée lorsque les résistances périphériques sont élevées et inversement.
Déterminants de la PAM
Comme indiqué plus haut, la PA, pulsatile le long de l’arbre artériel, est transformée en signal continu ou quasi-continu à l’entrée des organes, avec une valeur égale à la PAM. Pour une valeur de PAM donnée et à l’état stable, les chiffres de PAS et PAD donnent surtout des informations sur les propriétés des artères du patient comme indiqué ci-dessus. C’est donc la valeur de PAM qui est la plus importante car c’est elle qui détermine la pression de perfusion des organes – à l’exception du cœur (voir chapitre 3, Physiologie de la circulation coronaire).
En ramenant, par simplification, les résistances vasculaires systémiques, R, à celle d’un vaisseau unique de longueur L et de rayon r dans lequel passerait l’intégralité du débit cardiaque Qc, les équations dérivées de la loi de Poiseuille et de la loi de Darcy (voir chapitre 1, La circulation systémique) permettent d’écrire l’équation suivante :
ΔP=Qc.R ou R=8.μ.L/π.r4
La pression d’entrée est la PAM et la pression de sortie est la pression dans l’oreillette droite, qui est quasiment nulle et peut être négligée ce qui permet de remplacer ΔP par PAM. Les résistances à l’écoulement étant proportionnelles à l’inverse du rayon des vaisseaux élevé à la puissance 4, on voit que, si le rayon moyen de ces vaisseaux était divisé par deux, toutes choses étant égales par ailleurs, la PAM serait multipliée par 16 ce qui montre l’importance de la vasomotricité comme moyen de modifier la PAM. L’équation peut encore être affinée, puisque le débit cardiaque est égal au volume d’éjection systolique (VES) multiplié par la fréquence cardiaque (FC). Elle devient ainsi :
PAM=FC x VES x 8.μ.L/π.r4
Cette équation permet de visualiser les divers déterminants de la PAM, facteurs qui déterminent à chaque instant son niveau, et les mécanismes qui permettent de la réguler en jouant sur ces différents déterminants (en pratique : FC, VES et r, et au moins au plan théorique μ, la viscosité du sang), pour la maintenir autour de sa valeur-cible.
Le débit du cœur droit étant égal à celui du cœur gauche et le VES dépendant de la précharge du ventricule (voir chapitre 1, « Physiologie, Coeur » loi de Frank-Starling), à FC constante, le débit du ventricule gauche augmente lorsque le retour veineux (retour du sang depuis les veines vers l’oreillette droite) augmente. On voit ici apparaître le rôle essentiel joué par le volume sanguin dans la PAM, à la fois en tant que (i) contenu variable jouant un rôle pressif par rapport à un contenant relativement fixe (les vaisseaux) et (ii) volume déterminant la précharge des ventricules, donc le VES et, à fréquence constante, le débit cardiaque. Au total la valeur de PAM dépend donc des propriétés du contenant (vaisseaux) et du contenu (volémie) du système circulatoire.
Régulation de la pression artérielle
Régulation à court terme : le baroréflexe artériel
La PAM, qui assure la perfusion des organes, est la grandeur régulée du système cardiovasculaire. Plusieurs systèmes complémentaires, mis en jeu avec des constantes de temps différentes, y contribuent.
Comme pour toute variable physiologique régulée, il existe un « senseur », c’est-à-dire un capteur du niveau de la variable (l’équivalent d’un thermostat pour la régulation de la température), un centre intégrateur et un ou des système(s) effecteur(s). Le baroréflexe artériel est l’exemple même de la boucle de régulation par rétrocontrôle.
Schématiquement, les variations de PA sont détectées par les barorécepteurs, qui transmettent par des nerfs afférents le signal aux centres intégrateurs situés dans le bulbe rachidien (fig. 2.1). À partir de ces centres, les voies efférentes, ou effectrices, du système nerveux autonome (SNA) à destinée cardiaque et vasculaire vont permettre de corriger la variation initiale. Si celle-ci était une baisse de PA, l’action effectrice est une diminution du tonus parasympathique et une augmentation du tonus sympathique, responsable d’une vasoconstriction concernant en particulier les petites artères de résistance. La vasoconstriction touche également le système veineux, ce qui permet une augmentation du retour veineux qui participe à l’augmentation du débit cardiaque. Vasoconstriction et augmentation du débit cardiaque permettent le retour de la PA à sa valeur cible.
________________________________________________________________________________
Figure 2.1. Représentation schématique du baroréflexe artériel et cardiaque.
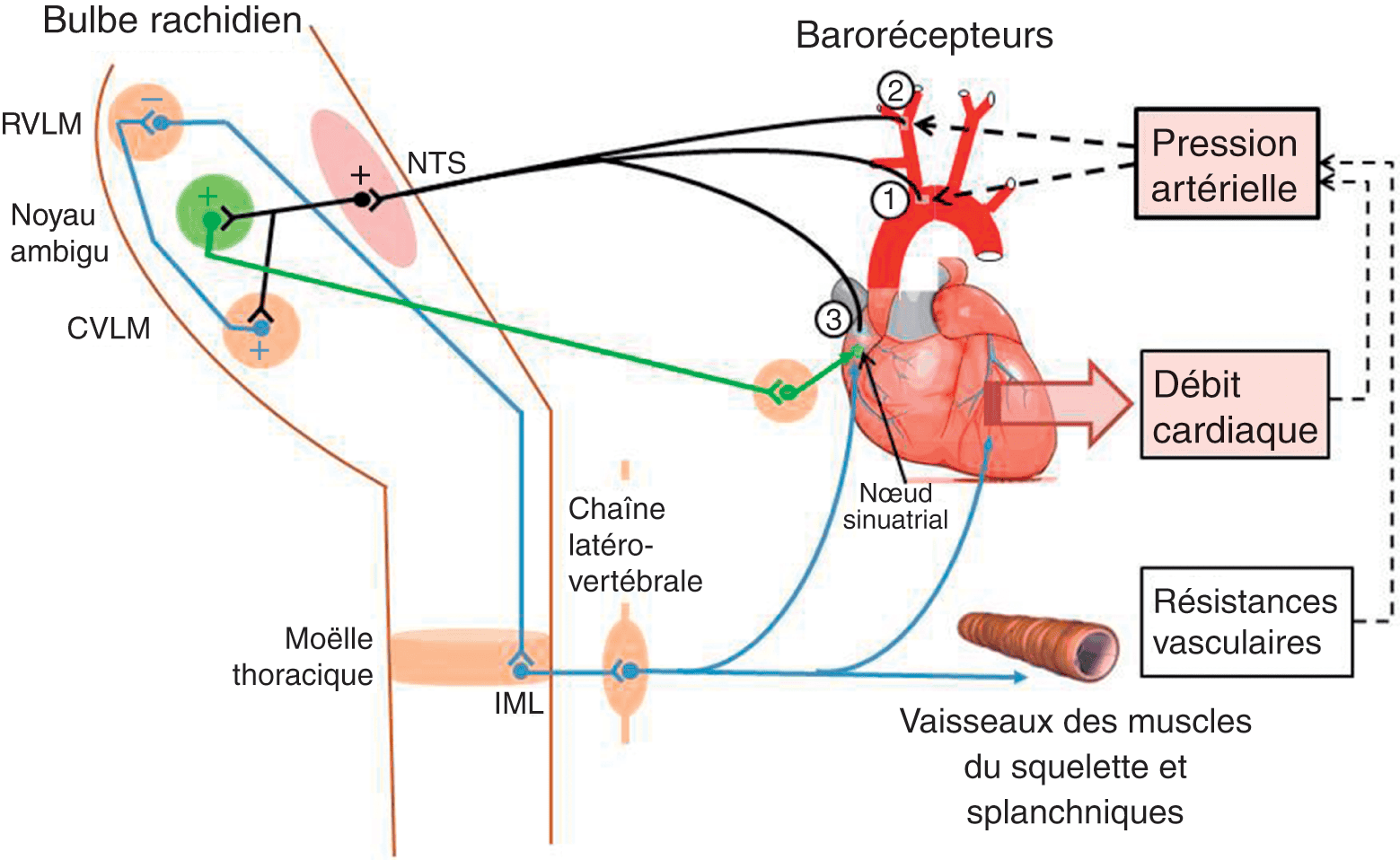
Le noyau ambigu envoie, par l’intermédiaire du nerf vague ou Xe paire crânienne, des neurones dits préganglionnaires vers des ganglions situés à proximité du cœur. Le neurone postganglionnaire innerve les cellules du nœud sinuatrial dont il module l’activité automatique par libération d’acétylcholine (système parasympathique, en vert). La RVLM envoie des neurones qui font relais avec les neurones préganglionnaires au niveau de la colonne intermédiolatérale (IML) de la moelle thoracique. Ces derniers font relais avec les neurones postganglionnaires au niveau de la chaîne latéro- (ou para-) vertébrale. Ces derniers innervent le nœud sinuatrial dont ils modulent l’activité automatique, tout le myocarde atrial et ventriculaire dont ils modulent la contractilité (via les récepteurs β1 adrénergiques) et les vaisseaux (artères et veines) de la grande circulation dont ils modulent le degré de constriction (via les récepteurs α1 adrénergiques), le tout via la libération de noradrénaline (système sympathique, en bleu). Voir détails du fonctionnement de la boucle dans le texte.
Barorécepteurs : 1, de la crosse de l’aorte, 2, de la bifurcation carotidienne et 3, du secteur à basse pression. NTS : noyau du tractus solitaire ; CVLM : région caudale du bulbe ventrolatéral ; RVLM : région rostrale du bulbe ventrolatéral.
________________________________________________________________________________
L’augmentation du tonus sympathique à destinée vasculaire s’accompagne d’une diminution du tonus parasympathique et d’une augmentation du tonus sympathique à destinée cardiaque, d’où une augmentation de la FC (effet chronotrope positif) et du VES (effet inotrope positif) qui participent, avec l’augmentation du retour veineux, à l’augmentation du débit cardiaque
Les barorécepteurs sont logiquement placés dans la paroi des artères afin de pouvoir capter les variations de PA. Plus précisément, ils sont localisés dans la crosse de l’aorte (premier vaisseau qui sort du cœur) et à l’origine des carotides internes (artères à destinée du cerveau), sur des parties un peu élargies de l’artère appelées sinus carotidiens.
Il existe aussi des barorécepteurs dans le système à basse pression de la circulation, situés au niveau de la paroi des oreillettes et des gros troncs veineux, qui sont sensibles à des variations de la volémie (ils sont pour cela fréquemment appelés volorécepteurs) et qui complètent la boucle du baroréflexe.
Les barorécepteurs sont des terminaisons de nerfs, sous forme de petites ramifications, qui parcourent la paroi de l’artère, directement exposées à la pression qui y règne. Ce sont des tensorécepteurs sensibles à l’étirement qui se prolongent par des fibres nerveuses qui se regroupent dans un nerf : nerf de Cyon (rameau du nerf vague ou Xe paire crânienne) pour ceux issus de la crosse de l’aorte et nerf de Hering (rameau du nerf glosso-pharyngien, IXe paire crânienne) pour ceux issus des sinus carotidiens.
Par ces nerfs, le signal de variation de la PAM est converti en potentiels d’action transmis au noyau du tractus solitaire (NTS) situé dans le bulbe (fig. 2.1). Des interneurones excitateurs partent du NTS vers le noyau ambigu (NA) et vers le noyau dorsal du vague, ainsi que vers la région caudale du bulbe ventrolatéral (CVLM). Du NA partent les neurones préganglionnaires du système parasympathique se projetant vers le cœur par l’intermédiaire du nerf vague (Xe paire crânienne). Du CVLM partent des interneurones inhibiteurs vers la région rostrale du bulbe ventrolatéral (RVLM). Ce dernier, principal centre régulateur de l’activité sympathique, envoie des fibres excitatrices vers les neurones préganglionnaires sympathiques qui naissent de la moelle épinière, au niveau de la colonne intermédiolatérale (IML).
Ainsi, lors d’une augmentation de la PAM, la stimulation du NTS par les barorécepteurs est augmentée, ce qui a pour effet de stimuler le NA et de renforcer le tonus parasympathique sur le cœur, avec pour conséquence une bradycardie. Parallèlement, l’activité du RVLM est inhibée avec pour conséquence une diminution du tonus sympathique cardiaque (bradycardie et effet inotrope négatif) et vasculaire (vasodilatation). Bradycardie et effet inotrope négatif diminuent le débit cardiaque tandis que la vasodilatation diminue les résistances vasculaires et le retour veineux, l’ensemble ramenant la PAM à sa valeur cible. Les phénomènes inverses se produisent en cas de baisse de la PAM comme, par exemple, lors du passage en orthostatisme. Le baroréflexe assure la régulation rapide de la PA, il est mis en jeu dans les secondes qui suivent une perturbation.
Régulation à moyen et long terme
Le baroréflexe ne permet pas la régulation à long terme de la PA. La démonstration de l’absence de rôle du baroréflexe dans la régulation à long terme de la PA a notamment été apportée par des modèles animaux comme le chien. La PAM du chien normal est étroitement régulée autour d’environ 100 mmHg. Les mesures qui s’éloignent de cette valeur sont rares malgré les changements de position et l’activité de l’animal. Si l’on coupe chirurgicalement les afférences des barorécepteurs issues de la crosse de l’aorte et des sinus carotidiens (on parle de « dénervation sino-aortique » ou d’ouverture de la boucle baroréflexe), la PA est initialement très élevée, comme on peut l’attendre puisque le NTS n’est plus stimulé. Cependant, si l’on mesure la PA de l’animal après 7 jours, on constate que cette dernière est nettement plus variable mais que, malgré cette grande variabilité, le niveau moyen de pression artérielle est quasiment le même qu’avant l’intervention, soit environ 100 mmHg. Si le baroréflexe régulait la PAM à long terme, alors le fait de couper les afférences entraînerait, comme la destruction du NTS, une hypertension artérielle majeure et prolongée. On déduit de cette expérience que le baroréflexe joue un rôle majeur et essentiel dans la régulation rapide, à court terme, de la PA, mais il n’a pas ou peu de rôle dans la régulation de la PA à plus long terme. Chez les patients hypertendus, on parle de « reset » du baroréflexe : la boucle baroréflexe contrôle toujours les variations rapides de la PA, comme chez un sujet normotendu, mais autour d’une valeur moyenne plus élevée.
Système rénine-angiotensine-aldostérone
Le système rénine-angiotensine-aldostérone (SRAA) est un des principaux systèmes qui assurent la régulation de la PA dans les minutes, heures et jours qui suivent la perturbation initiale. Ce système agit par plusieurs mécanismes complémentaires qui ont des cinétiques d’action différentes. C’est un système hormonal qui joue un rôle très important dans le système cardiovasculaire en général et dans la régulation de la PA et de la volémie en particulier (fig. 2.2).
________________________________________________________________________________
Figure 2.2. Représentation schématique du système rénine-angiotensine-aldostérone.
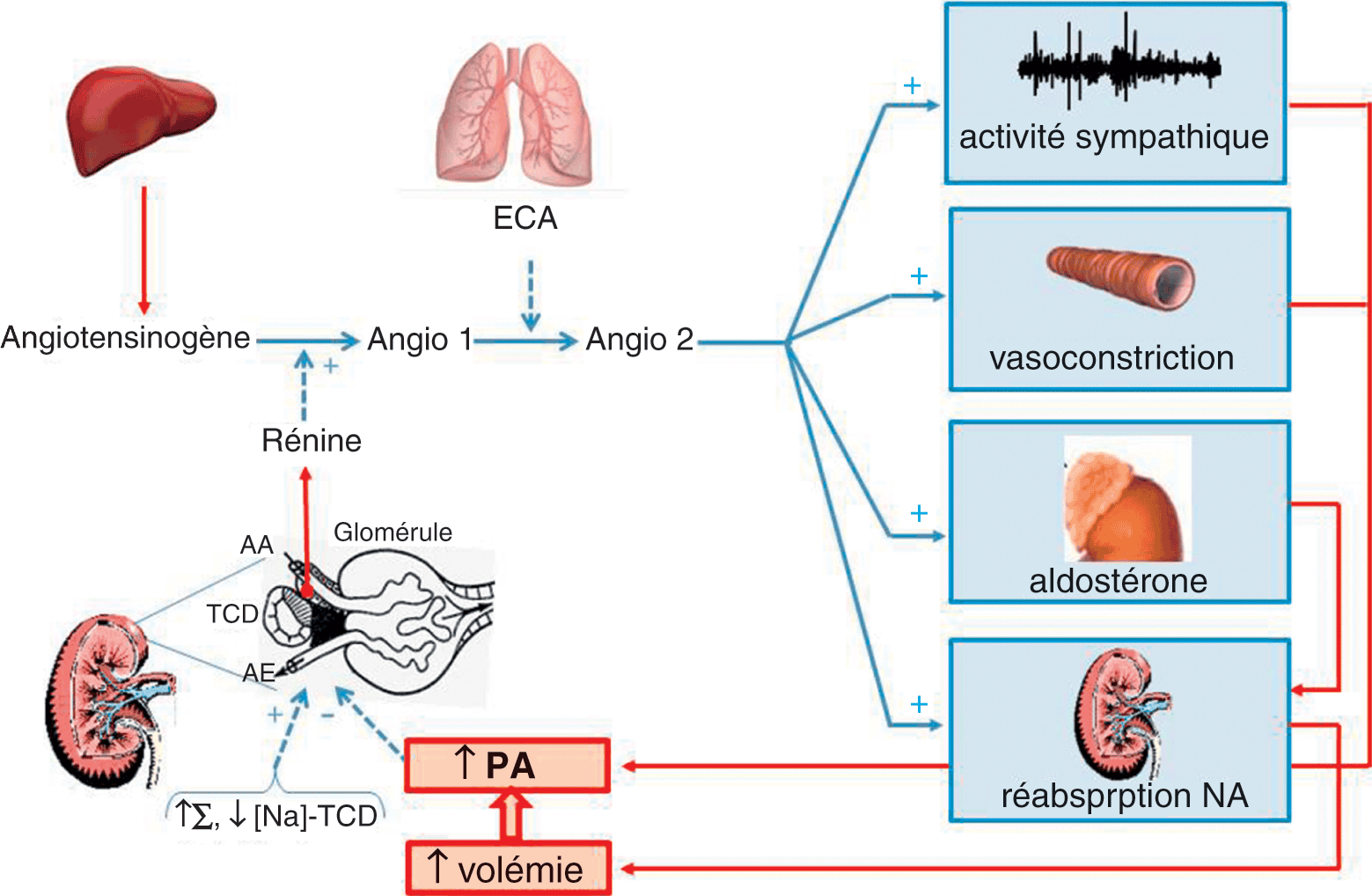
La rénine est produite par des cellules dérivées des cellules musculaires lisses de la paroi de l’artériole afférente (AA) des glomérules rénaux lorsque la pression de perfusion de cette artère diminue. La production de rénine est amplifiée par une augmentation du tonus sympathique (Σ) ainsi que par la baisse de la concentration de sodium dans le tube contourné distal (TCD). ECA : enzyme de conversion de l’angiotensine 1.
________________________________________________________________________________
Dans ce système, les variations de PA sont captées au niveau de l’artériole afférente du glomérule rénal. Les cellules sécrétrices de rénine, dérivées des cellules musculaires lisses de la paroi de l’artériole afférente, synthétisent d’autant plus de rénine que la pression de perfusion de l’artériole afférente est basse. La synthèse de rénine est par ailleurs amplifiée par l’activation sympathique, puisque les cellules productrices de rénine ont à leur surface des récepteurs β1-adrénergiques. Elle est également amplifiée par la diminution de la concentration de sodium au niveau du tube contourné distal (on parle de rétrocontrôle tubulo-glomérulaire).
La rénine est une enzyme qui rencontre dans la circulation l’angiotensinogène d’origine hépatique qu’elle transforme en angiotensine 1, dépourvue d’effet tensionnel significatif. L’angiotensine 1 est transformée en angiotensine 2 sous l’effet de l’enzyme de conversion de l’angiotensine (ECA) principalement située à la surface des cellules endothéliales de la circulation pulmonaire. Les effets de l’angiotensine 2 sont liés essentiellement à sa fixation à ses récepteurs de type 1 (AT1R). Elle augmente la PA par plusieurs mécanismes :
- une vasoconstriction périphérique, efficace en une vingtaine de minutes suivant la baisse de la PA, complémentaire et plus prolongée que celle assurée par le système sympathique ;
- une augmentation de la réabsorption d’eau et de sel par le néphron (et donc augmentation de la volémie) ;
- une augmentation du tonus sympathique par une action sur les centres régulateurs de l’activité sympathique au niveau du système nerveux central ;
- une stimulation de la synthèse d’aldostérone par les surrénales. L’aldostérone agit au niveau du tubule rénal distal pour augmenter la réabsorption de sodium. L’augmentation de la volémie qui résulte de l’augmentation de la réabsorption du sodium augmente la précharge des ventricules et donc le débit cardiaque et de ce fait la PA. Les mécanismes de régulation de la PA qui passent par des modifications de volémie, à la différence de ceux qui passent par des modifications des résistances vasculaires, prennent plusieurs heures à jours pour être actifs mais sont très efficaces.
Le SRAA est le principal système qui permet de maintenir l’homéostasie du sodium malgré les grandes variations auxquelles est soumis l’organisme, notamment dans les apports quotidiens en sel.
Les effets de l’angiotensine 2 dépassent la seule régulation de la PA et concernent de nombreuses fonctions du système cardiovasculaire. Un excès d’angiotensine 2 est délétère car il favorise non seulement le développement d’une hypertension artérielle mais aussi les processus d’hypertrophie et de fibrose cardiaque et vasculaire.
Notons que dans les vingt dernières années, de nombreux nouveaux composants du système rénine angiotensine ont été découverts : le SRA tissulaire avec un fonctionnement autonome, indépendant du système circulant, le récepteur (pro)rénine en tant que cible biologique directe potentielle pour la rénine et la prorénine, l’angiotensine (1–7), le second récepteur de l’angiotensine 2 (AT2R)… Cette régulation est donc beaucoup plus complexe que ce qui a ACE2 et SARS-CoV-2 été décrit précédemment.
ACE2 et SARS-CoV-2
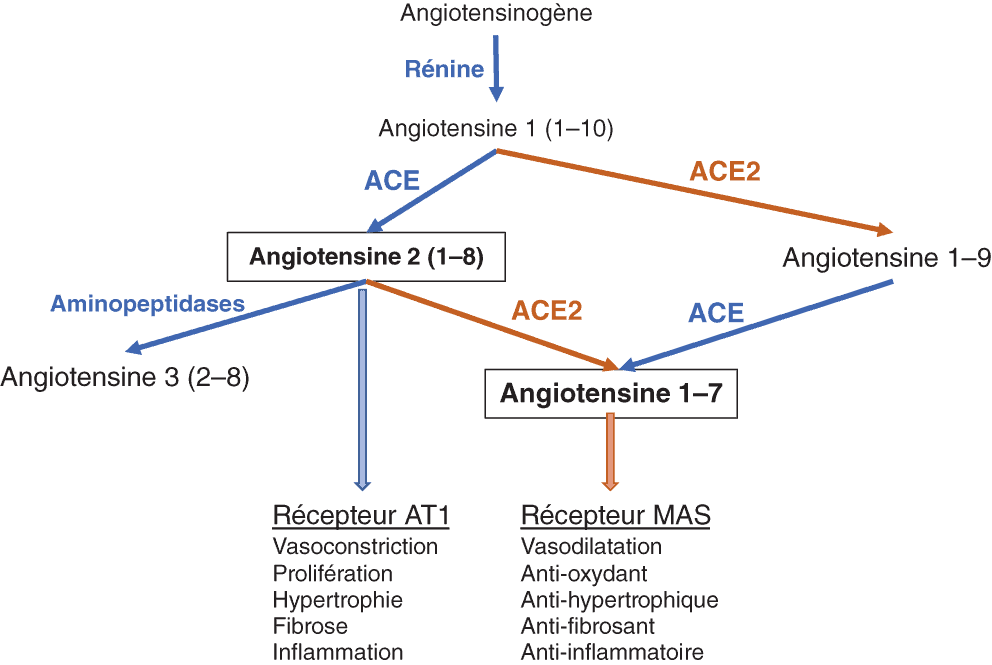
La maladie à coronavirus apparue en 2019 (COVID-19) et son vecteur, le SARS-CoV-2 (Severe Acute Respiratory Syndrome-CoV-2) ont, de façon inattendue, focalisé l’attention sur un aspect volontiers négligé de la complexité du système rénine-angiotensine-aldostérone (SRA). Il s’agit des effets antagonistes de l’angiotensine 2 (Ang 1-8) et de l’angiotensine 1-7 (Ang 1-7) issue, entre autres, de l’angiotensine 1-8 sous l’effet d’une autre carboxypeptidase : l’enzyme de conversion de l’angiotensine de type 2 (ACE2). Or l’ACE2 est le récepteur membranaire de SARS-CoV-2, présent notamment sur les cellules épithéliales des alvéoles pulmonaires et les cellules endothéliales de la circulation. Il existe, de fait, un équilibre entre les effets de l’angiotensine 2 sur son récepteur AT1 et ceux de l’angiotensine 1-7 sur le récepteur MAS (Mas 1 proto-oncogene receptor), l’ACE2 jouant en outre un rôle de « clairance » de l’angiotensine 2. Nonobstant les éventuelles perturbations de cet équilibre induites chez les patients souffrant de COVID-19 traités par des antagonistes du SRA, l’on a craint que l’infection par SARS-CoV-2, en « consommant » l’ACE2, ne rompe cet équilibre au profit des effets potentiellement délétères de l’angiotensine 2 et au détriment des effets bénéfiques de l’angiotensine 1-7. Des essais thérapeutiques basés sur ces hypothèses et visant à augmenter l’activité ACE2 ont été lancés au cours de l’année 2020 (fig. 2.3).
________________________________________________________________________________
Figure 2.3. Génération des angiotensines 2 (1-8) et 1-7 et effets via la stimulation de leur principal récepteur.
________________________________________________________________________________
Peptides natriurétiques
Les peptides natriurétiques constituent un système « miroir » du SRAA. Ils représentent le principal système diminuant la volémie. L’équilibre entre les systèmes antagonistes, que sont le SRAA et celui des peptides natriurétiques, permet une régulation très fine du volume extracellulaire et donc de la PA. Deux peptides natriurétiques interviennent dans cette régulation : le peptide natriurétique atrial, « atrial natriuretic peptide » (ANP) et le « brain natriuretic peptide » ou peptide natriurétique de type B (BNP). (fig. 2.4)
________________________________________________________________________________
Figure 2.4. Représentation schématique du système des peptides natriurétiques.
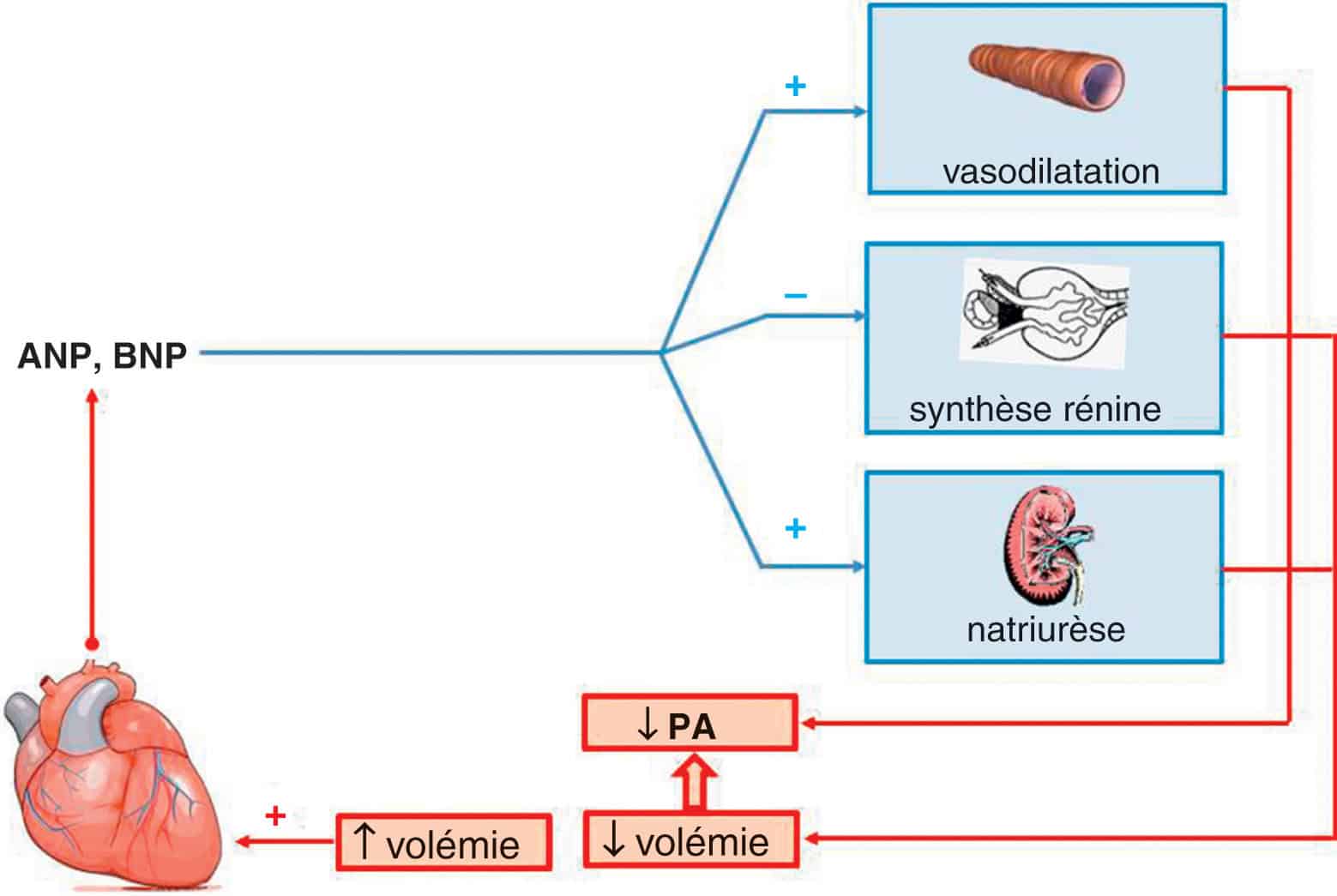
En situation physiologique, les peptides natriurétiques sont sécrétés uniquement par les oreillettes en réponse à leur étirement consécutif à une augmentation de la volémie. ANP : peptide natriurétique de type A ; BNP : peptide natriurétique de type B.
________________________________________________________________________________
En conditions physiologiques, l’ANP et, dans une moindre mesure, le BNP, sont sécrétés par les myocytes atriaux en réponse à l’étirement des oreillettes. Il s’agit d’un mécanisme de réponse rapide considéré comme un moyen de réguler la volémie et donc les pressions de remplissage cardiaques.
De manière schématique, l’ensemble des effets des peptides natriurétiques contribuent à diminuer la volémie et les résistances périphériques, donc la PA, et s’opposent globalement aux effets du SRAA. Dans le rein, les peptides natriurétiques ont une action diurétique et natriurétique. En outre, l’ANP inhibe la sécrétion de rénine par les cellules juxta-glomérulaires.
Au niveau vasculaire, l’ANP inhibe la vasoconstriction induite par l’activation du système sympathique ou par l’angiotensine 2, mais c’est aussi un vasodilatateur direct : il entraîne une diminution des résistances périphériques artérielles et veineuses, d’où une diminution de la PA et du retour veineux.
En miroir des peptides du SRAA, l’ANP a enfin des propriétés antifibrosantes, anti-inflammatoires, antiprolifératives et anti-hypertrophiques : au-delà de son rôle hémodynamique, il joue donc un rôle dans le remodelage cardiovasculaire. Le BNP a des effets très similaires à ceux de l’ANP.
Hormone antidiurétique
L’hormone antidiurétique (ADH), encore appelée vasopressine, est synthétisée par l’hypothalamus et libérée dans la posthypophyse en réponse à une augmentation de l’osmolarité plasmatique. Elle agit au niveau du canal collecteur du tubule rénal, en se liant à son récepteur V2, et favorise la réabsorption d’eau par le rein. Elle joue ainsi un rôle fondamental dans le bilan de l’eau et la régulation de l’osmolarité. Cependant, une variation d’osmolarité n’est pas le seul stimulus de la sécrétion de vasopressine. Une hypovolémie marquée, supérieure à 10 %, est également un puissant stimulus de la sécrétion d’ADH. L’eau ainsi réabsorbée se répartit pour un tiers dans le secteur extracellulaire, permettant de limiter la déshydratation extracellulaire. En outre, l’ADH a un effet vasopresseur – vasoconstricteur – par ses récepteurs vasculaires V1, d’où son autre nom : la vasopressine. Cet effet vasculaire permet également de lutter contre l’hypotension en cas de perte importante de liquide aux dépens du secteur extracellulaire.
Régulation à long terme de la PA
La PA est égale, rappelons-le, au débit cardiaque multiplié par les résistances périphériques, les deux étant sous l’influence du système nerveux autonome régulé par les centres du bulbe rachidien. Pourtant, l’organe qui joue le rôle prépondérant dans la régulation à long terme du niveau moyen de pression artérielle (PAM) n’est ni le cœur, ni les vaisseaux, ni le système nerveux autonome, mais le rein, comme Arthur Guyton en avait émis l’hypothèse dans les années 1950 à partir d’une modélisation mathématique complexe prenant en compte les divers déterminants de la PA et de sa régulation.
Il existe en effet au cœur du système cardiovasculaire une variable physiologique qui influence tous les déterminants de la PA : la volémie. De fait, la volémie dépend de la quantité totale de sodium dans le compartiment extracellulaire. En effet, la concentration de sodium (natrémie) étant fixe, la quantité de sodium détermine directement le volume d’eau qui l’accompagne, constitué du volume dans le compartiment vasculaire (volémie) et du volume interstitiel. L’organe qui assure l’homéostasie de la quantité totale de sodium (malgré des apports alimentaires très variables), et donc de la volémie, est le rein. C’est par le biais de la régulation rénale de la volémie que l’organisme fixe, à long terme, le niveau moyen de la PA. Nous avons vu ci-dessus que le SRAA et les peptides natriurétiques agissent en partie en modifiant la natriurèse et donc la volémie. Il existe un système plus puissant encore qui, pour toute perturbation de la PA, peut la corriger au mm de Hg près s’il est intact : c’est la relation qui existe entre la natriurèse et la PA moyenne que nous appellerons par simplification « relation pression-natriurèse ». L’implication de cette relation est très importante car elle signifie qu’en cas d’hypertension artérielle durable, le rein est soit coupable soit complice…
La relation pression-natriurèse et ses implications
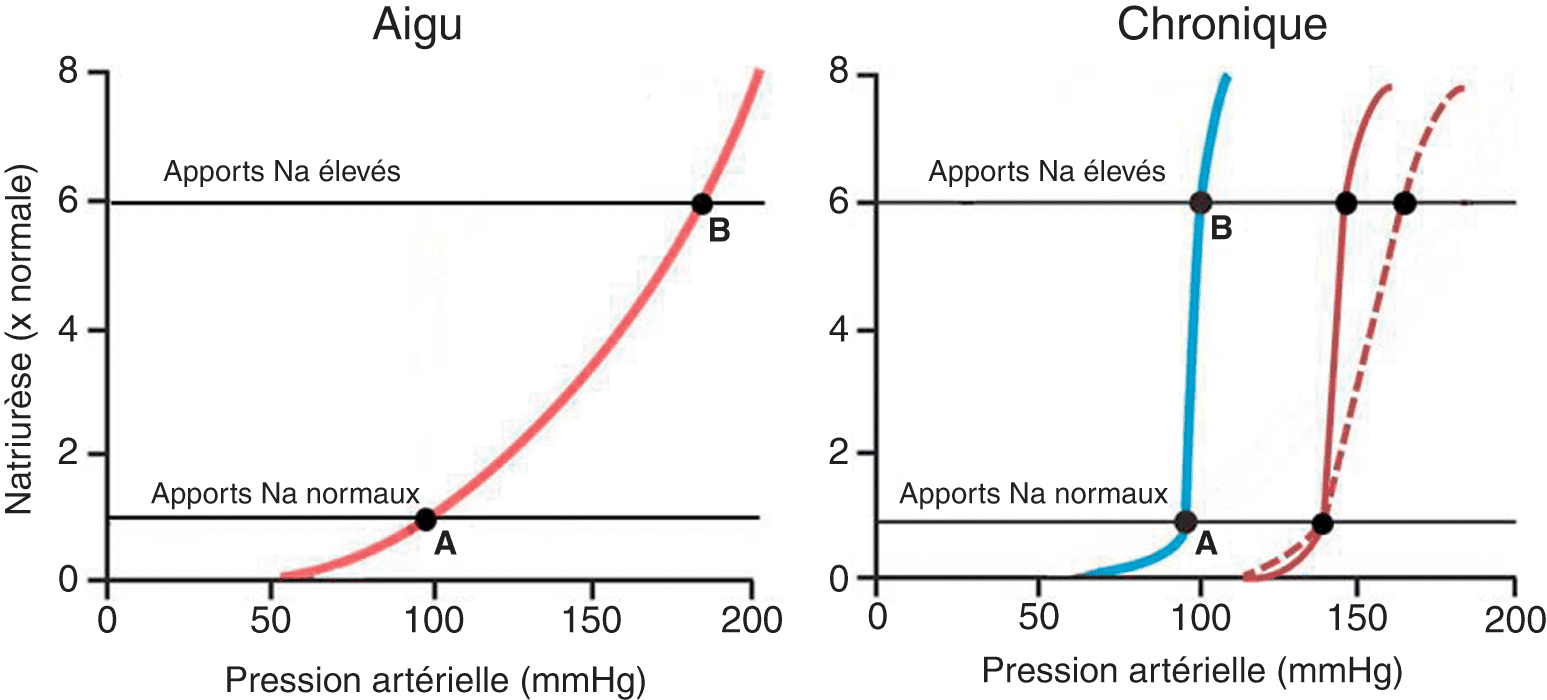
Dans la relation pression-natriurèse (fig. 2.5, schéma de gauche), la courbe rouge décrit le comportement intrinsèque, en aigu, d’un rein isolé et perfusé ex vivo, donc indépendant des systèmes de régulation nerveux et hormonaux (SRAA notamment). Cette courbe décrit les sorties d’eau et de sel en fonction de la PA, en considérant que les apports de sel sont fixés arbitrairement à 1 (droite horizontale noire « apports Na normaux »). Le point A (intersection entre les apports de sel et la courbe pression-natriurèse) est le « point d’équilibre » de la PA. Si la PA augmente au-delà du point A, la natriurèse, en suivant la courbe rouge, augmente et dépasse les entrées. Il en résulte une diminution de la volémie, du retour veineux, donc du débit cardiaque et ainsi de la PA. Ce phénomène persiste tant que la PA n’est pas revenue exactement à son niveau initial : on dit que le gain du système (capacité de corriger une variation initiale de la variable régulée) est infini. Le phénomène inverse se produit en cas de baisse de la PA : la natriurèse diminue, devenant inférieure aux entrées jusqu’à ce que la PA revienne à son niveau initial. La relation pression-natriurèse illustre comment le rein, en modifiant le bilan « entrées-sorties » peut corriger une variation de PA et ainsi réguler cette dernière de manière, certes très lente, mais en revanche extrêmement fine.
________________________________________________________________________________
Figure 2.5. Représentation schématique de la relation pression-natriurèse.
Voir détails dans le texte.
Source : d’après Guyton and Hall Textbook of Medical Physiology. Saunders ; 2000.
________________________________________________________________________________
Par ailleurs, ce schéma montre que si les entrées de sel augmentent (droite noire horizontale « apports Na élevés »), le point d’équilibre se déplace vers la droite le long de la courbe rouge, de A à B, faisant ainsi augmenter la PA. Ainsi, si la courbe pression-natriurèse n’est pas verticale, la valeur à laquelle la PA est régulée dépend des apports sodés.
Le schéma de droite illustre le comportement d’un rein en situation chronique, « aidé » par les différents systèmes neurohormonaux qui le régulent et l’aident à adapter son comportement aux variations de pression et de volémie, donc tel qu’il fonctionne réellement in vivo chez un individu sain. On constate que la courbe pression-natriurèse est verticalisée, ce qui signifie que le point d’équilibre change peu en termes de PA malgré des variations très importantes des entrées de sodium. Cette courbe explique pourquoi un sujet sain peut faire varier considérablement ses apports sodés sans que cela ne perturbe sa PA. En effet, si les entrées de sodium augmentent (droite noire horizontale « apports Na élevés »), le point d’équilibre se déplace de A à B mais la PA correspondante est très peu modifiée.
Les sujets hypertendus ont une ou des anomalies qui entraînent un décalage vers la droite de la courbe pression-natriurèse (courbe marron, trait plein). Leur point d’équilibre s’observe à une PA plus élevée. De plus, si la courbe de pression-natriurèse, outre son décalage vers la droite, perd sa verticalité (courbe marron pointillée), la valeur à laquelle la PA est régulée dépend des apports sodés. Ceci permet de distinguer schématiquement deux types d’HTA : l’HTA insensible au sel et l’HTA sensible au sel. Les patients ayant une HTA sensible au sel voient leur PA augmenter d’autant plus que leurs apports sodés sont élevés (courbe pointillée), ce qui n’est pas le cas des patients ayant une HTA insensible au sel (courbe pleine).
Synthèse : complémentarité des systèmes
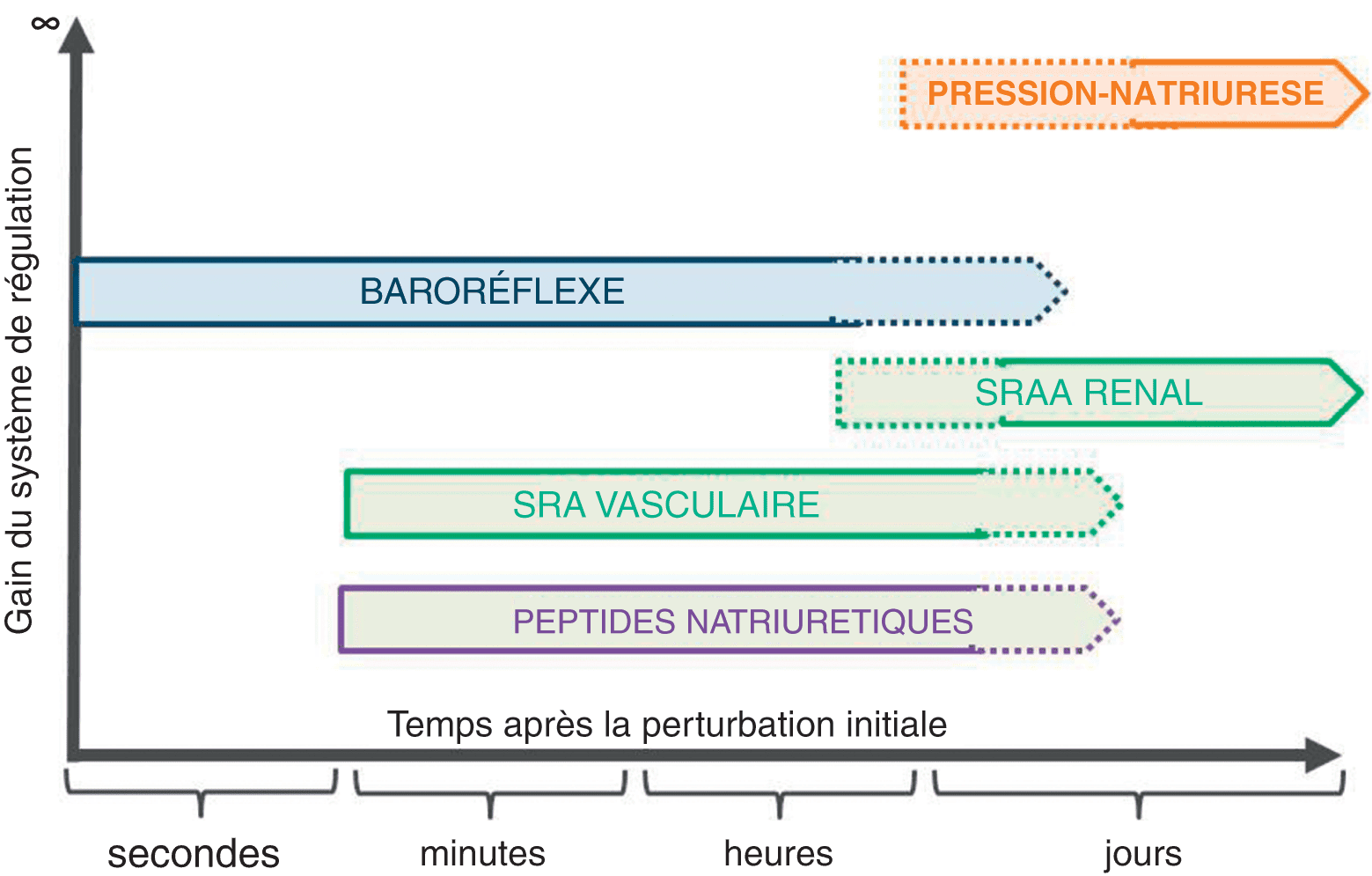
Les différents systèmes de régulation de la PA ont une complémentarité par leurs mécanismes d’action qui sont différents, tout en interagissant les uns avec les autres. En outre, ils ont une complémentarité via leurs cinétiques de mise en jeu. Sur la figure 2.6, en noir, le baroréflexe est le plus rapide à intervenir après une perturbation. En rouge, le phénomène de pression-natriurèse est le plus lent à se mettre en place. En ordonnée est représenté le gain, capacité du système à corriger plus ou moins complètement une perturbation initiale de la variable régulée. Dans la régulation de la PA, le seul système qui a un gain infini est celui représenté par la relation pression-natriurèse. Il faut noter enfin que ce chapitre n’a pas détaillé de façon exhaustive tous les mécanismes intervenant dans le contrôle de la PA, ceci étant au-delà des dimensions et de l’objectif du chapitre.
________________________________________________________________________________
Figure 2.6. Complémentarité temporelle des principaux systèmes de régulation de la pression artérielle.
________________________________________________________________________________
Physiopathologie
La physiopathologie de l’HTA est à la fois simple, complexe et polyfactorielle. Elle est simple dans les rares cas d’HTA secondaire (voir plus loin) pour lesquels il est en principe aisé d’établir le lien physiopathologique entre le problème pathologique causal (phéochromocytome, adénome de Conn, sténose d’une artère rénale, etc.) et le mécanisme pathologique conduisant à l’HTA. Elle est plus complexe dans le cas de l’HTA essentielle pour lequel elle résulte de la combinaison – et même l’interaction – à des degrés divers, de facteurs génétiques qui modulent le fonctionnement d’un ou plusieurs des systèmes de régulation décrits ci-dessus et de facteurs environnementaux – ou modifiables – tels que la consommation de sel et d’alcool, le poids, l’activité physique, etc.
Génétique et hypertension artérielle
La génétique de l’HTA regroupe la composante génétique des HTA essentielles et les formes familiales monogéniques. Ces dernières sont des formes rares d’HTA (syndrome de Liddle, syndrome de Gordon, excès apparent de minéralocorticoïdes).
Concernant l’HTA essentielle, les différentes études pangénomiques comparant des patients hypertendus à des sujets normotendus ont mis en évidence plus de 260 locus potentiellement impliqués. L’existence d’un polymorphisme d’un de ces gènes n’a que très peu de liens avec le niveau tensionnel mais des études récentes montrent que l’utilisation de scores polygéniques permet d’objectiver une différence de 10 mmHg entre les sujets porteurs ou non de certains de ces polymorphismes.
Consommation sodée et hypertension artérielle
L’augmentation de la consommation de sel induit une diminution des concentrations plasmatiques des hormones anti-natriurétiques (angiotensine II et aldostérone) et augmente celle des hormones natriurétiques, ce qui induit une augmentation de la natriurèse et permet aux reins de maintenir la balance sodée avec de faibles variations tensionnelles (cf. supra : relation pression-natriurèse). Cependant, chez certains patients, une altération de ces mécanismes de régulation, comme une augmentation du tonus sympathique, atténue l’efficacité de la relation pression-natriurèse, responsable d’un décalage de la relation vers la droite, ce qui implique une augmentation de la PA pour maintenir la balance sodée.
Dysfonction endothéliale
Les cellules endothéliales servent de revêtement au cœur et aux vaisseaux (voir chapitre 1, Histologie). Elles sécrètent des substances qui interviennent sur les cellules musculaires lisses vasculaires et induisent une vasodilatation, comme le monoxyde d’azote (NO) ou la prostacycline (PGI2), ou une vasoconstriction, comme l’endothéline 1 ou le thromboxane A2. Les cellules endothéliales interviennent également dans l’angiogenèse, l’agrégation plaquettaire et la coagulation. Une altération des capacités de vasorelaxation endothélium-dépendante peut participer à la physiopathologie de certaines formes d’HTA, notamment dans un contexte d’inflammation, de stress oxydatif, d’obésité, ou de diabète.
Épidémiologie
Prévalence
En utilisant la mesure de PA en cabinet, la prévalence de l’HTA en 2015 était de 1,13 milliard de personnes dans le monde et 150 millions en Europe. La prévalence de l’HTA est de 30 à 45 % de la population adulte. Elle augmente avec l’âge jusqu’à atteindre une prévalence > 60 % au-delà de 60 ans. En raison de la sédentarité et de la majoration de la prévalence de l’obésité, on considère que la prévalence de l’HTA va continuer à croître dans les années à venir.
En France, la prévalence a été évaluée en 2015 par l’étude épidémiologique Esteban. Il a ainsi été montré que la prévalence dans une population adulte âgée de 18 à 74 ans est de 30,6 % avec une prévalence plus élevée chez les hommes (36,5 % versus 26,2 % chez les femmes).
Pression artérielle et risque vasculaire
La PA est un facteur de risque (FDR) cardiovasculaire (CV) et rénal : plus haute est la PA, surtout la systolique, plus grand est le risque d’accident vasculaire cérébral (AVC), d’insuffisance cardiaque (IC), d’infarctus du myocarde (IDM) et d’insuffisance rénale (IR).
La mortalité cardiovasculaire est doublée chez les patients hypertendus car elle est responsable d’une incidence plus élevée d’AVC (× 7), d’insuffisance cardiaque (× 4), de coronaropathie (× 3) (tableau 2.1).
Tableau 2.1. Grades d’hypertension en fonction de la mesure clinique de pression artérielle (PA).
| Catégorie | PA systolique
mmHg |
PA diastolique
mmHg |
|
| Optimal | < 120 | et | < 80 |
| Normal | 120-129 | et/ou | 80-84 |
| Normal Haut | 130-139 | et/ou | 85-89 |
| Grade 1 | 140-159 | et/ou | 90-99 |
| Grade 2 | 160-179 | et/ou | 100-109 |
| Grade 3 | ≥ 180 | et/ou | ≥ 110 |
| HTA systolique isolée | ≥ 140 | et | < 90 |
La catégorie se définit sur une mesure clinique et par le chiffre le plus élevé de PA systolique ou diastolique.
Diagnostic
Mesure de la pression artérielle
Méthode auscultatoire
Par commodité, la PA est le plus souvent mesurée au niveau de l’artère humérale mais, comme indiqué plus haut, elle est à peu près identique dans l’ensemble de l’arbre artériel depuis l’aorte initiale jusqu’aux artérioles de résistance. La méthode permettant de mesurer la PA en pratique clinique a été inventée par Korotkoff en 1905. Un brassard gonflable placé au niveau du bras exerce sur l’artère humérale une contre-pression que l’on mesure, tout en auscultant (écoutant) l’artère humérale. Il faut donc, pour mesurer la PA par cette méthode, un sphygmomanomètre (sphygmo = pouls ; mano = pression) et un stéthoscope (fig. 2.7).
________________________________________________________________________________
Figure 2.7. Mesure auscultatoire de la pression artérielle selon Korotkoff.
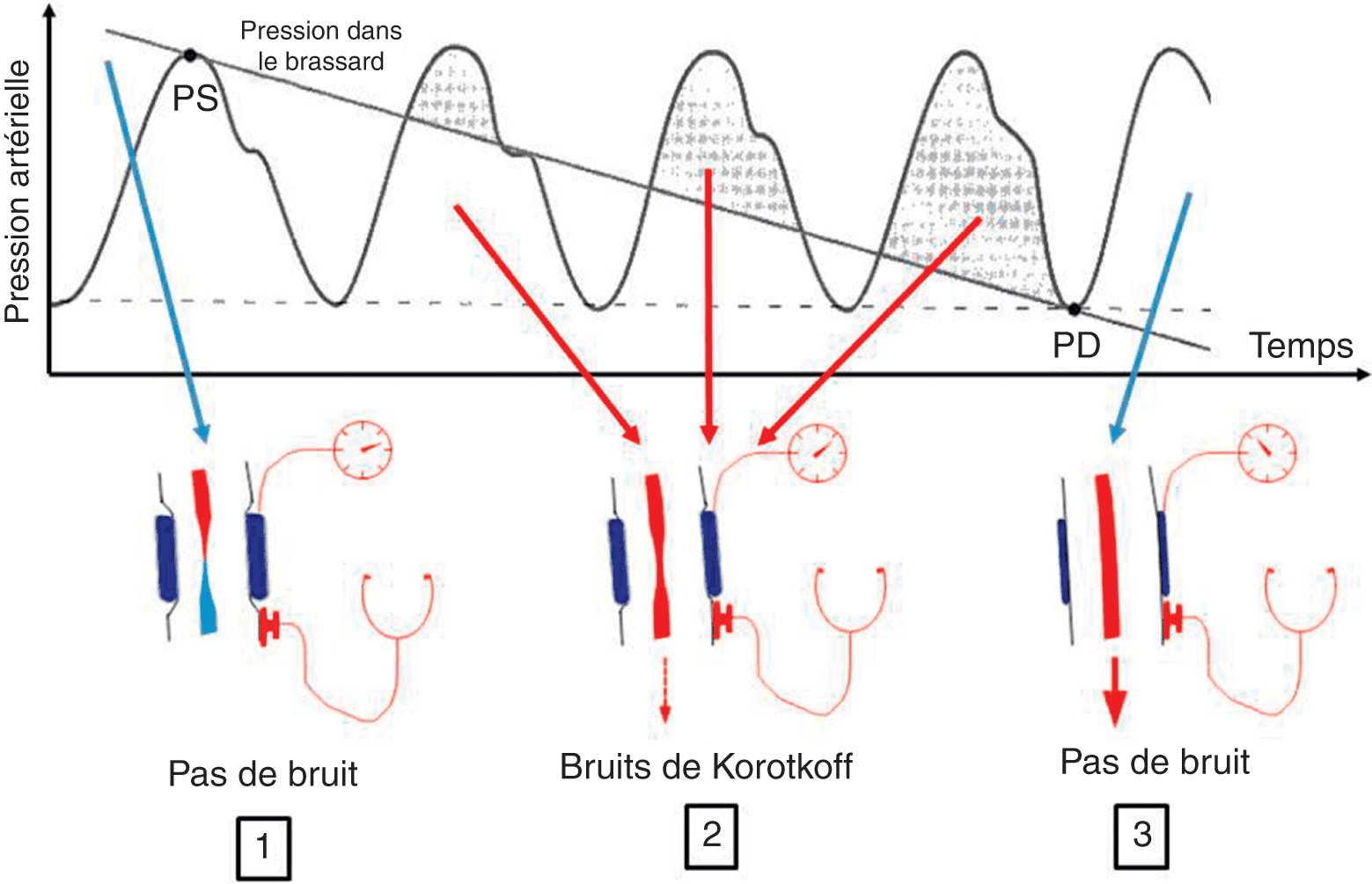
En 1, le gonflage du brassard à une pression supérieure à la pression systolique (PS) écrase complètement l’artère humérale. Le sang ne passe pas, il n’y a pas de bruit. En 2, le gonflage écrase partiellement l’artère. Il en résulte un écoulement turbulent responsable des bruits de Korotkoff. En 3, l’artère n’est plus écrasée, l’écoulement est laminaire, donc silencieux. Ainsi, lors du dégonflage progressif du brassard, l’apparition des bruits indique la PS et la disparition des bruits la PD.
________________________________________________________________________________
Avec la poire de gonflage, on gonfle le brassard jusqu’à une valeur supérieure à la PA systolique : le sang ne circule plus et l’on n’entend donc aucun bruit sur le trajet de l’artère. Grâce à la valve de la poire, on laisse ensuite la pression du brassard diminuer lentement jusqu’à entendre des bruits liés à l’écoulement turbulent – et non pas laminaire – du sang qui recommence à circuler : la pression pour laquelle les bruits apparaissent correspond à la PA systolique (PAS). On continue de dégonfler le brassard, l’écoulement du sang se fait mais il est gêné par la contre-pression du brassard qui écrase l’artère : l’écoulement est turbulent, ce qui continue de générer des bruits. Lorsque la pression du brassard descend en dessous de la PA diastolique, il n’y a plus aucune gêne à l’écoulement du sang dans l’artère qui devient laminaire, ce qui explique que les bruits disparaissent. La pression pour laquelle les bruits disparaissent est la PA diastolique (PAD).
Méthode oscillométrique
La technique oscillométrique mesure les oscillations de pression qui se produisent lorsque le brassard est gonflé entre la PAD et la PAS. L’amplitude maximale des oscillations correspond à la PAM. Ainsi, cette méthode permet-elle la mesure directe de la PAM, tandis que la PAS et la PAD sont calculées à l’aide d’un algorithme propre à chaque appareil. Les appareils automatiques doivent donc être validés en comparaison à la méthode auscultatoire pour vérifier la fiabilité des valeurs de PAS et PAD avant d’être mis sur le marché. De plus en plus, les appareils manuels reposant sur la méthode auscultatoire sont remplacés par des appareils automatiques reposant sur la méthode oscillométrique. Les appareils d’automesure individuels pour mesurer la PA au domicile reposent également sur la méthode oscillométrique.
Pression artérielle « sanglante »
La PA peut être mesurée de manière extrêmement précise et en continu par un cathéter introduit dans une artère – souvent l’artère radiale – et relié à un capteur de pression. Comme cette méthode est invasive, elle est réservée à des situations où un monitorage précis et continu de la PA est nécessaire comme en per-opératoire ou en soins intensifs. La courbe de PA oscille entre les valeurs systolique et diastolique. L’intégrale de la PA en fonction du temps (aire sous la courbe) donne la valeur exacte de la PA moyenne.
Mesure clinique en consultation
La mesure usuelle de la PA est la mesure clinique en consultation. Elle utilise un manomètre ou un appareil semi-automatique validé avec un brassard adapté à la taille du bras, après cinq minutes de repos en position couchée ou assise, à distance d’un effort, d’un repas ou de la prise de café ou de tabac. La poche gonflable du brassard doit circonscrire les deux tiers de la circonférence du bras. Quand le brassard est trop petit ou le bras trop gros, la mesure de la PA est surestimée. On recommande un brassard standard de 23 cm (longueur de la poche gonflable), ou de 33-36 cm pour les gros bras (périmètre > 33 cm).
La mesure de la pression artérielle commence par une mesure aux deux bras. Si la différence de PAS entre les deux bras est supérieure à 15 mmHg, cela est associé à un surrisque vasculaire. De plus, la mesure doit alors toujours être effectuée du côté du bras dont la PA est la plus élevée.
Le patient est installé en position assise dans un environnement calme pendant au moins cinq minutes. Au moins deux mesures de PA doivent être réalisées entre une et deux minutes d’intervalle. Si ces deux mesures diffèrent de plus de 10 mmHg, il est alors conseillé de faire une troisième mesure.
Le dépistage de l’HTA repose sur la mesure de la PA à toute consultation. Si la PA est ≥ 140/90 mmHg, il faut répéter les mesures cliniques ou utiliser une alternative à la mesure clinique. Le diagnostic d’HTA repose sur des mesures multiples car une mesure unique expose à une réaction d’alarme qui élève la PA (effet blouse blanche). En cas d’arythmie, les valeurs obtenues par mesure automatisée doivent être sujettes à caution ; il est recommandé de répéter les mesures.
L’HTA est définie par une PAS ≥ 140 mmHg et/ou une PAD ≥ 90 mmHg, mesurées au cabinet médical et confirmées par au moins deux mesures par consultation, au cours de trois consultations successives, sur une période de trois à six mois (plus rapidement en cas de PA ≥ 180/110 mmHg). L’HTA systolique isolée, fréquente après 60 ans, est définie par une PAS ≥ 140 mmHg avec une PAD < 90 mmHg en mesure clinique.
Lors de la mesure initiale et au cours du suivi, il faut rechercher une hypotension orthostatique après une et trois minutes au moins en position debout.
Alternatives à la mesure en consultation
Mesure de la PA sans présence médicale ( unattended) dans le cabinet médical
Cette mesure correspond à la moyenne de plusieurs mesures de PA réalisées chez un patient assis dans le cabinet médical, sans présence médicale ni paramédicale avec un appareil automatique. Ces mesures de PA permettent d’éliminer les HTA de consultation et sont considérées comme étant équivalentes, voire plus basses, aux mesures obtenues par la mesure ambulatoire de pression artérielle (MAPA) ou l’automesure tensionnelle (AMT).
Automesure tensionnelle
L’automesure tensionnelle consiste en la réalisation de mesures de la PA à domicile par le patient pendant au minimum trois jours, idéalement six à sept jours, mesures réalisées le matin et le soir, avec deux à trois mesures de pression artérielle par prise. Les mesures de PA faites à domicile par les patients sont généralement inférieures aux valeurs mesurées en consultation. Ainsi, le seuil diagnostique en automesure est une PAS ≥ 135 mmHg et/ou une PAD ≥ 85 mmHg. Il a été montré, dans des études prospectives, que l’AMT est un meilleur prédicteur de la morbimortalité cardiovasculaire que la PA de consultation.
Mesure ambulatoire de la pression artérielle
La mesure ambulatoire de la PA (MAPA) permet d’enregistrer des mesures de PA toutes les 15 à 30 minutes habituellement sur une durée de 24 heures et d’établir la moyenne de ces mesures. La MAPA est considérée comme valide quand au moins 70 % des mesures ont été réalisées. Le seuil pour le diagnostic d’HTA est alors de 135/85 mmHg pour la moyenne diurne, 120/70 pour la moyenne nocturne et 130/80 sur l’ensemble des 24 heures. De même que l’AMT, la MAPA a montré être un meilleur indice du pronostic cardiovasculaire que la PA de consultation. La MAPA enregistre la pression artérielle sur 24 heures et permet de vérifier la baisse physiologique de la pression artérielle de plus de 10 % sur la période nocturne (phénomène « dipper »), l’absence de cette baisse étant associée à un surrisque cardiovasculaire.
Prise en charge diagnostique
La Société française d’HTA préconise actuellement une mesure de la PA en dehors du cabinet médical, au domicile du patient afin de confirmer le diagnostic d’HTA, par AMT ou MAPA. Il est recommandé de confirmer le diagnostic d’HTA avant de débuter un traitement antihypertenseur médicamenteux, sauf en cas d’urgence hypertensive.
L’utilisation de la MAPA et de l’AMT permet d’avoir une évaluation plus juste de la mesure de PA et de s’affranchir des difficultés diagnostiques liées aux HTA de consultation (encore appelées HTA blouse blanche) et aux HTA masquées.
L’HTA isolée de consultation ou HTA blouse blanche est définie par une PA clinique ≥ 140/90 mmHg alors que la moyenne diurne de MAPA ou d’AMT est < 130-135/85 mmHg. Son risque CV est voisin de celui de la normotension. Sa détection nécessite, néanmoins, un suivi au long cours pour dépister l’évolution vers une HTA permanente. Elle est présente dans 30 à 40 % des cas.
L’HTA masquée correspond au profil inverse. Alors que la mesure clinique de la PA est normale, l’AMT ou la MAPA mettent en évidence des moyennes de PA de patients hypertendus. Sa prévalence est de 15 %. L’HTA masquée induit un risque cardiovasculaire similaire voire plus important que l’HTA permanente.
Complications
L’HTA peut se compliquer d’atteintes viscérales.
Les complications cardiaques sont l’hypertrophie ventriculaire gauche, la cardiopathie hypertensive, les épisodes d’insuffisance cardiaque, les coronaropathies et la prévalence accrue de fibrillation atriale.
Les complications rénales sont la néphro-angiosclérose et l’insuffisance rénale chronique.
Les complications cérébrales sont la leucopathie vasculaire, les accidents vasculaires cérébraux ischémiques et hémorragiques.
De façon générale, l’HTA entraîne un épaississement et un durcissement des artères qui favorisent le développement de l’athérosclérose.
Bilan et stratégies diagnostiques
Examen clinique
L’interrogatoire, l’examen clinique et le bilan initial ont pour objectif de préciser les autres facteurs de risque cardiovasculaire, les signes orientant vers une HTA secondaire à une pathologie (telle qu’une sténose de l’artère rénale, un adénome de Conn, un phéochromocytome, etc.) et l’atteinte des organes cibles afin d’orienter le traitement médicamenteux.
Interrogatoire
L’interrogatoire s’attardera sur les facteurs de risque cardiovasculaire :
- les antécédents personnels d’HTA et de maladies cardiovasculaires ;
- les antécédents personnels de dyslipidémie ;
- les antécédents personnels de diabète ;
- les antécédents familiaux d’événement cardiovasculaire (avant 55 ans chez les hommes et 65 ans chez les femmes) ;
- le tabagisme actif ou sevré ;
- les habitudes alimentaires ;
- une prise de poids, une obésité ;
- la sédentarité ;
- des ronflements excessifs évoquant un syndrome d’apnées du sommeil.
Ensuite, on recherche les éléments pouvant évoquer une HTA secondaire :
- l’âge de diagnostic de l’HTA ;
- les antécédents familiaux de maladie rénale et de polykystose rénale ;
- les antécédents personnels de maladie rénale, d’hématurie, de pyélonéphrite ;
- les antécédents personnels d’HTA gravidique, de prééclampsie ;
- la prise de contraception orale œstroprogestative, de réglisse, d’alcool, de drogues (cocaïne, amphétamines), de ciclosporine ; d’inhibiteurs de tyrosine kinase, etc. ;
- des céphalées, des sueurs, des palpitations, ainsi que d’une altération de l’état général évoquant un phéochromocytome ;
- un antécédent d’hypokaliémie spontanée ou provoquée, intermittente ou permanente ;
- des épisodes de faiblesse musculaire, de tétanie évoquant une hypokaliémie ;
- des signes cliniques évoquant une dysthyroïdie.
Le retentissement viscéral de l’HTA doit aussi être recherché :
- retentissement cérébral et ophtalmologique : céphalées, vertiges, baisse de l’acuité visuelle, troubles cognitifs ;
- retentissement cardiaque : douleur thoracique, dyspnée, syncope, œdème des membres inférieurs ;
- retentissement rénal : polyurie, hématurie ;
- retentissement vasculaire : claudication intermittente des membres inférieurs, douleurs nocturnes ;
- antécédent de syndrome d’apnées du sommeil.
Enfin, l’interrogatoire insiste sur les traitements médicaux pris, les intolérances médicamenteuses et l’observance thérapeutique.
Examen physique
Examen général
Le clinicien, après avoir pris la PA aux deux bras, recherche une hypotension artérielle orthostatique. Le patient est pesé et mesuré pour calcul de son indice de poids corporel avec mesure du périmètre abdominal.
L’auscultation cardiaque recherche une arythmie, la fibrillation atriale étant souvent associée à l’HTA. La palpation des axes artériels est complétée par l’auscultation des artères fémorales, carotidiennes et rénales afin de dépister un souffle vasculaire.
Comme l’interrogatoire, l’examen clinique recherche des signes de retentissement de l’HTA et de l’HTA secondaire.
Signes cliniques suggérant une HTA secondaire
- Un faciès cushingoïde, des signes cliniques évocateurs d’acromégalie.
- La palpation des fosses lombaires montrant des reins de taille anormale (polykystose rénale).
- Une asymétrie tensionnelle avec mesure de la PA aux quatre membres (coarctation de l’aorte, sténose de l’artère subclavière).
- Un souffle para-aortique.
Signes cliniques secondaires à un retentissement clinique
- Cérébral : déficit sensitivomoteur.
- Ophtalmologique : rétinopathie au fond d’œil.
- Cardiaque : signes d’insuffisance cardiaque, râles crépitants, œdèmes des membres inférieurs, galop, fibrillation atriale.
- Vasculaire : diminution ou abolition d’un pouls, extrémités froides, troubles trophiques, souffle vasculaire. La mesure des index de pression systolique cheville-bras doit être réalisée chez les patients de plus de 65 ans ou chez les patients de moins de 65 ans à haut risque cardiovasculaire. L’index de pression systolique cheville/bras abaissé (< 0,90) ou > 1,40 est un marqueur facile à obtenir d’une maladie athéromateuse et d’un risque cardiovasculaire accru.
Examens complémentaires
ECG systématique
Un ECG 12 dérivations est effectué à la recherche d’une hypertrophie ventriculaire gauche avec calcul de l’indice de Sokolow (SV1 + RV5 > 35 mm) et de l’indice de Cornell (SV3 + RaVL > 28 mm chez l’homme et > 20 mm chez la femme). Il pourra aussi dépister l’ischémie myocardique et les troubles du rythme supraventriculaire, tels que la fibrillation atriale.
Échographie cardiaque transthoracique
L’échographie cardiaque n’est pas réalisée à titre systématique chez tous les patients hypertendus et sera réalisée en fonction du contexte. Elle s’applique à rechercher une hypertrophie ventriculaire gauche, une cardiopathie hypertensive, des séquelles d’infarctus myocardique et évalue les pressions de remplissage du VG. La FEVG (fraction d’éjection ventriculaire gauche) est précisée. L’hypertrophie ventriculaire gauche est définie par une masse ventriculaire gauche indexée supérieure à 95 g/m2 chez la femme et supérieure à 115 g/m2 chez l’homme. L’examen des valves et de l’hémodynamique cardiaque complètent tout examen échographique
Examens biologiques
Les examens de routine à effectuer devant tout patient hypertendu sont :
- NFS-plaquettes ;
- glycémie à jeun, uricémie ;
- explorations des anomalies lipidiques : cholestérol total, HDL-cholestérol, LDL-cholestérol, triglycérides ;
- créatininémie calcul du débit de filtration glomérulaire ;
- ionogramme sanguin avec natrémie et kaliémie ;
- analyse urinaire : micro-albuminurie des 24 heures, recherche d’hématurie.
Recherche d’une rétinopathie hypertensive
La rétinopathie hypertensive est divisée en trois stades selon la classification de Kirkendall :
- stade I : rétrécissement artériel sévère et disséminé ;
- stade II : stade I associé à des hémorragies rétiniennes, d’exsudats secs et de nodules cotonneux ;
- stade III : stade II associé à un œdème papillaire.
La détection d’hémorragies rétiniennes, d’œdème papillaire, de nodules cotonneux est corrélée à la mortalité. En revanche, le rétrécissement artériel peut être retrouvé chez des patients normotendus et a une valeur prédictive moins importante. Il est préconisé de faire un fond d’œil chez les patients présentant une HTA de grade 2 ou 3. Le fond d’œil n’a pas d’indication systématique à ce jour chez les patients hypertendus.
Autres examens complémentaires
Ceux-ci sont demandés selon l’orientation effectuée lors de l’examen clinique :
- écho-Doppler artériel des membres inférieurs, des troncs supra-aortiques, abdominal. Il est à noter qu’il est recommandé de faire un Doppler abdominal à la recherche d’un anévrisme de l’aorte abdominale chez les hommes de plus de 65 ans ;
- mesure de la vitesse de l’onde de pouls. Elle reflète la rigidité aortique. Plusieurs études ont suggéré un bénéfice dans l’évaluation du profil de risque vasculaire du patient mais son utilisation systématique n’est pas recommandée actuellement.
HTA secondaires
Les HTA secondaires ont une cause connue mais pas nécessairement curable. Leur prévalence varie entre 5 et 15 % de la population hypertendue. La recherche d’HTA secondaire ne peut être réalisée chez tous les patients hypertendus en raison d’une une balance coût/efficacité défavorable. Elle est donc réservée aux patients avec une suspicion sur le bilan usuel de l’HTA ou avec une HTA non contrôlée.
Ainsi, on considère que la recherche d’HTA secondaire doit être réalisée chez :
- les patients de moins de 40 ans avec une HTA de grade 2 ;
- les patients avec une HTA diagnostiquée dans l’enfance ;
- les patients avec une HTA résistante ;
- les patients avec une HTA de grade 3 ;
- les patients avec une orientation clinique ou biologique vers une cause d’HTA secondaire :
- les patients avec une hypokaliémie spontanée ou provoquée, intermittente ou permanente,
- les patients avec des signes catécholaminergiques évocateurs de paragangliome fonctionnel,
- les patients avec une insuffisance rénale.
Les principales causes à évoquer sont :
- les néphropathies qui doivent être recherchées en fonction du contexte, de la fonction rénale, de l’analyse du sédiment urinaire et de la protéinurie ;
- l’hyperaldostéronisme primaire ;
- les sténoses des artères rénales ;
- les autres causes plus rares doivent être évoquées en fonction du contexte et de l’examen clinique : les phéochromocytomes, les hypercortisolismes, la coarctation de l’aorte, etc.
Les principales causes d’HTA secondaire sont indiquées dans le tableau 2.2.
Tableau 2.2. Tableau récapitulatif des HTA secondaires.
| Prévalence | Symptômes évocateurs | Examen de dépistage | |
| Insuffisance rénale chronique | 2–10 % | Diabète, protéinurie, anémie, masse rénale dans un contexte de polykystose | Créatininémie, mesure du DFG., recherche d’hématurie, mesure de la micro-albuminurie (rapport albuminurie sur créatininurie sur échantillon urinaire) |
| Hyperaldostéronisme primaire | 5–15 % | Asymptomatique, crampes, hypokaliémie | Dosages de rénine et d’aldostérone en condition standardisée |
| Sténose artérielle rénale | 1–10 % | Patient polyvasculaire ou femme jeune (DFM)
Souffle |
Doppler artériel rénal ou angio-TDM (ou angio-IRM en cas de contre-indication) si suspicion de sténose athéromateuse
Angioscanner des artères rénales si suspicion de DFM |
| Phéochromocytome | < 1 % | Céphalées, sueurs, palpitation, altération de l’état général, diabète, labilité tensionnelle, hypotension orthostatique | Dosage de la métanéphrine et normétanéphrine urinaire sur 24 heures ou plasmatiques/ |
| Coarctation de l’aorte | < 1 % | Diagnostic de l’HTA dans l’enfance, asymétrie tensionnelle | Échographie cardiaque |
Hyperaldostéronisme primaire (HAP)
L’hyperaldostéronisme primaire se définit par une autonomisation de la production d’aldostérone par les surrénales à l’origine d’une HTA pouvant être associée à une hypokaliémie. La fréquence est de l’ordre de 6 % parmi les sujets hypertendus.
Les critères diagnostiques et la prise en charge ont été précisés par des recommandations françaises et internationales. L’absence d’hypokaliémie n’élimine pas ce diagnostic étant donné que 70 % des patients avec hyperaldostéronisme primaire n’ont pas d’hypokaliémie.
Le dépistage consiste en l’évaluation du rapport aldostérone sur rénine plasmatique. Les dosages d’aldostérone et de rénine doivent être réalisés le matin, en position assise, en condition de normovolémie (natriurèse > 100-150 mM/jour) et normokaliémie après arrêt des molécules interférant avec les dosages (bloqueurs du système rénine-angiotensine, diurétiques, bêtabloquants, inhibiteurs calciques dihydropyridines pendant 15 jours et antagonistes de l’aldostérone pendant six semaines). En cas d’HTA sévère, un traitement par inhibiteur calcique non dihydropyridine et alphabloquants peut être introduit.
La confirmation repose sur l’absence de freination de la sécrétion d’aldostérone lors d’un test dynamique (charge sodée intraveineuse, test au captopril, test à la fludrocortisone) et/ou sur l’élévation des valeurs plasmatiques d’aldostérone.
L’atteinte surrénale peut être unilatérale (adénome produisant de l’aldostérone, hyperplasie unilatérale de la surrénale, rarement corticosurrénalome) ou bilatérale (hyperplasie bilatérale des surrénales)
Le scanner surrénal et le dosage étagé de l’aldostérone dans les veines surrénales ont pour objectif de distinguer les étiologies uni- et bilatérales, ce qui conditionne le traitement ultérieur. Le scanner seul ne permet pas de diagnostiquer ou d’éliminer un hyperaldostéronisme primaire. Parmi les patients avec un hyperaldostéronisme primaire et des surrénales normales au scanner, une forme latéralisée, et pouvant donc être opérée, est diagnostiquée dans plus de 30 % des cas.
Lorsque l’atteinte est unilatérale (sécrétion d’aldostérone latéralisée) le traitement repose sur une surrénalectomie par laparoscopie. L’intervention permet de corriger l’hyperaldostéronisme dans tous les cas, mais ne guérit l’HTA que dans 50 % des cas (dans les autres cas, les chiffres de PA et le score de traitement diminuent).
Lorsque l’atteinte est bilatérale (hyperplasie bilatérale des surrénales) ou que le patient n’est pas candidat à la chirurgie (âge, comorbidités, refus du patient, etc.), le traitement repose sur les anti-aldostérones (spironolactone, éplérénone sur avis argumenté).
En raison des difficultés diagnostiques, le dépistage est classiquement réalisé dans un laboratoire de ville mais les tests de confirmation et la suite de la prise en charge sont faits dans des centres experts. Il est important de retenir que l’absence d’anomalie lors du scanner surrénal n’élimine ni l’HAP ni une forme chirurgicalement curable.
Sténoses des artères rénales
Une sténose artérielle rénale (SAR) peut entraîner une HTA si elle réduit le diamètre luminal d’au moins 60 %. La SAR est à l’origine de moins de 5 % des HTA. Elle est d’origine athéromateuse dans 80–90 % des cas, et d’origine fibrodysplasique dans 10–20 % des cas. Les autres étiologies sont rares : artérite de Takayasu, artérite radique, dissection, neurofibromatose de type 1, sténose d’artère de greffon rénal.
Présentation
Dans les formes athéromateuses, les patients ont le plus souvent des facteurs de risque CV ou une atteinte CV symptomatique ou non, une HTA systolique et une insuffisance rénale (IR). La prévalence d’une SAR athéromateuse est très élevée chez les patients qui ont une athérosclérose extrarénale, symptomatique ou non. L’objectif de leur prise en charge est la prévention CV globale, un meilleur contrôle de la PA (la guérison de l’HTA est hors de portée) et la stabilisation de la fonction rénale.
La dysplasie fibromusculaire (DFM) atteint surtout des femmes jeunes ayant peu ou pas de facteurs de risque (à l’exception d’un tabagisme fréquent). Dans ces cas, l’IR est rare et les objectifs de la prise en charge sont la guérison de l’HTA, souvent possible, et la détection et la surveillance d’éventuelles lésions extrarénales (fig. 2.8).
________________________________________________________________________________
Figure 2.8. Exemples de sténoses des artères rénales.
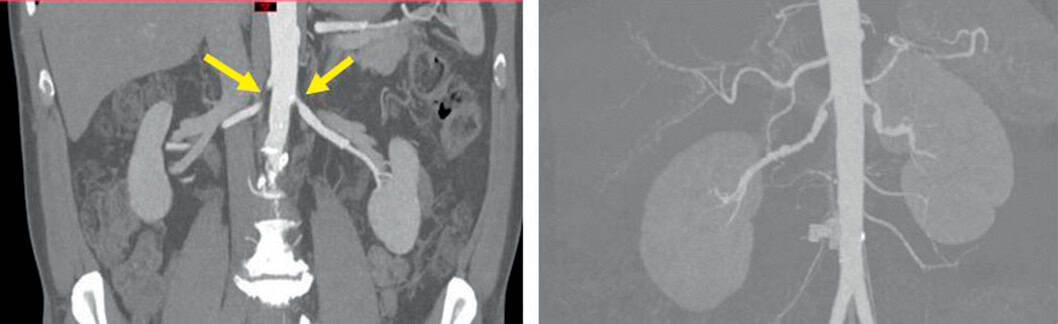
À gauche : sténose athéromateuse post-ostiale bilatérale des artères rénales. À droite : sténoses étagées des artères rénales dans un contexte de dysplasie fibromusculaire multifocale bilatérale.
________________________________________________________________________________
Diagnostic
Le dépistage porte sur les patients ayant un risque élevé de SAR. Comme en cas de signe d’appel, la SAR sera diagnostiquée par :
- écho-Doppler des artères rénales : mise en évidence de la sténose, de son retentissement hémodynamique parenchymateux et mesure de la hauteur des reins. Il est peu standardisé, utilisant quatre index (vitesse maxima, temps d’accélération, index d’accélération, rapport réno-aortique) dont les seuils varient d’une équipe à l’autre ;
- angioscanner si le DFG est supérieur à 30 ml/mn ou en prenant des mesures de protection contre la néphrotoxicité de l’iode s’il est inférieur : mise en évidence de la sténose, visualisation des autres axes vasculaires, orientation vers l’étiologie (athérosclérose, dysplasie fibromusculaire) (fig. 2.8) ;
- angio-IRM : moins performante que le scanner pour la caractérisation des SAR ;
- artériographie rénale : examen de référence. Actuellement, elle est réservée à la prise en charge thérapeutique.
L’imagerie en coupes distingue facilement une DFM multifocale (lésions tronculaires en perles enfilées) d’une SAR athéromateuse (sténose proximale et présence de plaques aortiques). La DFM focale se distingue des SAR athéromateuse par l’âge très jeune, le site tronculaire et l’absence de plaque aortique.
Traitement
Patients ayant une SAR athéromateuse
Les objectifs du traitement sont ici de réduire la PA, stabiliser le DFG et prévenir les évènements CV. Les antihypertenseurs y compris les inhibiteurs du système rénine angiotensine tels que les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes des récepteurs de l’angiotensine II, les statines et les antiagrégants sont alors nécessaires.
Les différents essais comparant le traitement médicamenteux seul au traitement médicamenteux avec angioplastie n’ont pas montré de différence intergroupe ni pour la PA, ni pour l’évolution du DFG, ni pour l’incidence des événements CV.
Cette conclusion s’applique à des patients ayant une situation relativement stable et ne peut être extrapolée aux patients qui étaient généralement exclus des essais : ceux qui avaient une IR aiguë (notamment sous IEC ou ARAII), un œdème aigu pulmonaire (OAP), une HTA maligne ou résistante. Dans cette minorité de patients, il n’y a pas d’étude. Il existe un certain consensus pour proposer une angioplastie à ces patients.
Chez les patients revascularisés, la PA et le DFG doivent être mesurées tous les trois mois, et la taille des reins après six mois puis chaque année.
Patients ayant une SAR non athéromateuse
Les indications de l’angioplastie transluminale (ATL) sont beaucoup plus libérales dans les SAR non athéroscléreuses : une maladie parenchymateuse d’aval ou une maladie aortique d’amont y sont rares.
- Dans la DFM multifocale, le problème dominant est celui de la quantification des sténoses : il est difficile de définir un diamètre de référence (à partir duquel quantifier le pourcentage de sténose) et d’estimer le frein hémodynamique résultant de sténoses modérées mais multiples. En conséquence, il n’est pas rare qu’on dilate une sténose typique mais peu serrée. Ceci peut expliquer que la guérison complète des cas d’HTA avec SAR dysplasique n’est obtenue que dans un tiers des cas.
- Dans la DFM focale, la sténose est facile à quantifier et généralement sévère, associée à un plus petit rein d’aval. L’indication de revasculariser est facile à poser. Le problème peut venir d’une ATL difficile, la résistance de la paroi artérielle requérant de fortes pressions d’inflation. Il ne faut pas hésiter dans ce cas à recourir à une revascularisation chirurgicale.
Chez les patients qui n’ont pas été revascularisés (la majorité des SAR athéromateuses et la minorité des DFM), on propose aussi la surveillance de la PA, du DFG et de la hauteur des reins à l’échographie car la SAR peut progresser avec le temps. Les contrôles d’imagerie sont généralement programmés au sixième mois après le diagnostic de SAR car on ne connaît pas le potentiel de progression de la maladie responsable, puis une fois par an si la situation est stable.
Phéochromocytome ou paragangliome
Les paragangliomes sont des tumeurs se développant aux dépens des ganglions sympathiques et parasympathiques. Lorsqu’ils se développent dans la médullosurrénale, on les appelle phéochromocytome (fig. 2.9). Dans ce chapitre, nous ne traiterons que les paragangliomes fonctionnels (sécrétant des catécholamines) pouvant entraîner une HTA. La fréquence de ces tumeurs serait de l’ordre de 1°/°°.
________________________________________________________________________________
Figure 2.9. Phéochromocytome droit révélé par une HTA sévère chez un homme de 44 ans.
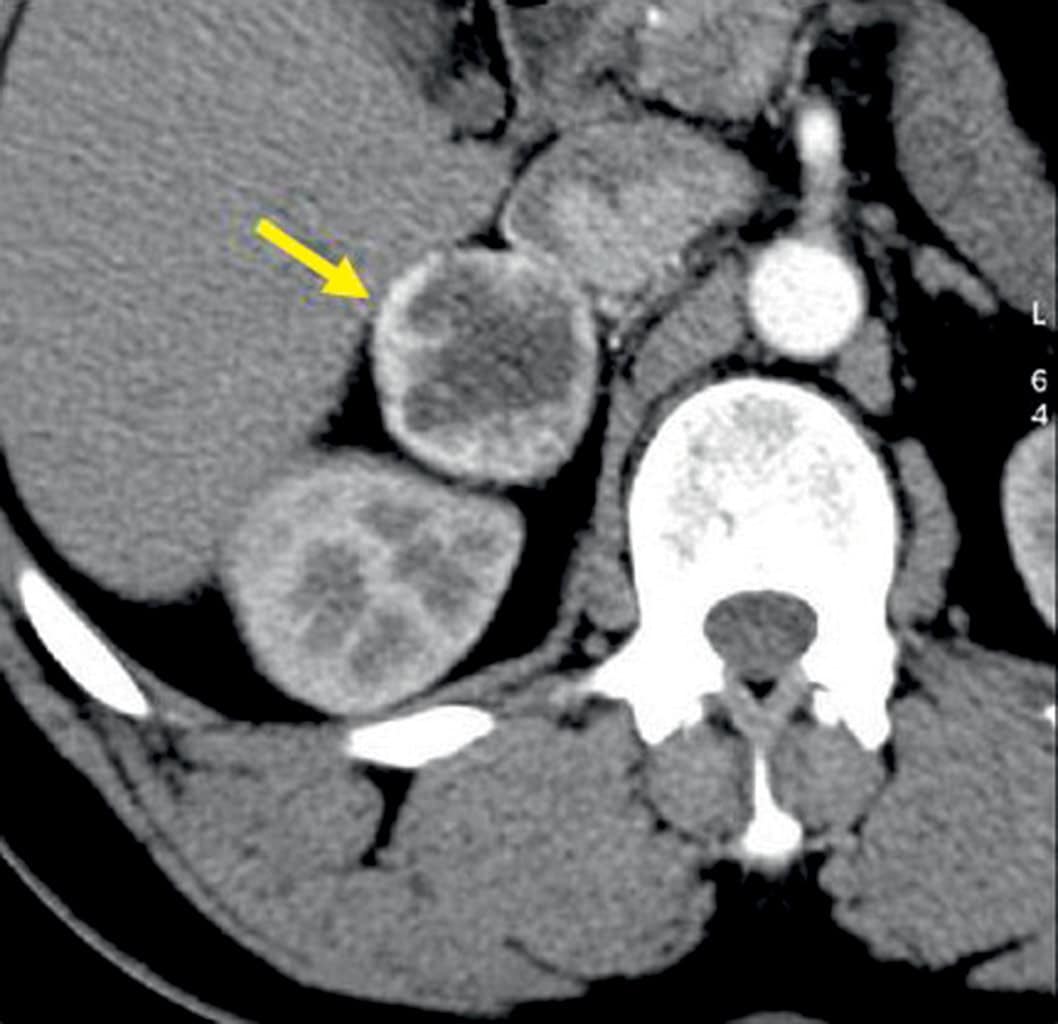
Coupe de scanner abdominal injecté. La masse, nécrotique (niveau liquide visible), se situe dans la loge surrénalienne, en regard du pôle supérieur du rein.
________________________________________________________________________________
Les paragangliomes sont héréditaires dans 40 % des cas et malins dans 10 à 15 % des cas. Le phéochromocytome ou paragangliome peut s’inscrire dans le cadre d’une maladie syndromique (neurofibromatose de type 1, maladie de von Hippel Lindau, néoplasie endocrinienne multiple de type 2, paragangliome familial).
Le diagnostic est évoqué en cas d’HTA permanente ou labile voire paroxystique avec céphalées, sueurs, palpitations (troubles du rythme), malaises voire hypotension ou diabète.
Le diagnostic repose sur le dosage de méta- et normétanéphrines urinaires des 24 heures ou plasmatiques libres.
Si les dosages sont élevés, le scanner abdominal visualise la plupart du temps la ou les tumeur(s) et les éventuelles métastases.
En fonction du contexte clinique (localisation du paragangliome, forme génétique), le bilan est complété par une scintigraphie à la MIBG et par une tomographie par émission de positons (TEP) avec différents traceurs.
Le traitement repose sur l’exérèse chirurgicale du paragangliome au vu du risque de malignité et de complications aiguës (cardiopathies adrénergiques). Un traitement par alphabloquants est mis en place en préopératoire.
Le risque de récidive et la nécessité d’une surveillance annuelle au long cours doivent être expliqués au patient : cette surveillance est clinique (symptômes, PA) et biologique (glycémie et méta et normétanéphrine urinaires). Une imagerie ne sera réalisée qu’en cas d’anomalie biologique.
Coarctation de l’aorte
C’est une sténose aortique constitutionnelle de l’enfant et l’adulte jeune, le plus souvent située sur l’aorte thoracique.
Le tableau clinique associe : un souffle mésosystolique ou parfois continu, parasternal gauche et dans le dos, une abolition des pouls fémoraux, une asymétrie tensionnelle entre les membres supérieurs et les membres inférieurs. Les pouls fémoraux et sous-jacents sont, en général, abolis.
Il peut également y avoir une asymétrie de PA brachiale selon le siège de la coarctation (par rapport à la sous clavière gauche).
Le traitement est chirurgical ou endovasculaire (dilatation avec pose d’une endoprothèse).
HTA d’origine rénale
L’insuffisance rénale chronique est l’une des principales causes d’HTA secondaire. Les mécanismes physiopathologiques impliqués sont multiples ce qui rend souvent difficile le traitement de cette HTA.
À fonction rénale identique, la fréquence et la sévérité de l’HTA varient selon le type de néphropathie. Dans certaines néphropathies, l’HTA sera plus précoce et plus sévère car la maladie rénale atteindra directement des éléments de régulation de la PA (régulation de la balance hydrosodée, ischémie rénale, atteinte vasculaire associée) tandis que dans d’autres l’HTA ne sera consécutive qu’à la réduction néphronique, sans critère de spécificité. De plus, de façon assez constante, l’HTA est plus sévère et plus fréquente avec le déclin de la fonction rénale. Au stade de l’insuffisance rénale terminale, la prévalence de l’HTA est très élevée (80 %).
Syndrome de Cushing
Le syndrome de Cushing domine le tableau. Il est composé d’une érythrose faciale, d’une bosse de bison, d’un comblement des creux sus-claviculaires, d’une répartition faciotronculaire des graisses, d’une amyotrophie des bras et des membres inférieurs, d’une fragilité cutanée, de vergetures et de dysménorrhées.
Il est dû à la production excessive de glucocorticoïdes par les glandes surrénales (ou une glande surrénale).
Le diagnostic biologique repose sur l’élévation du cortisol à minuit, l’élévation de la cortisolurie des 24 heures et sur l’absence de freination minute après 1 mg de Dexaméthasone.
Cet hypercortisolisme peut être de cause hypophysaire ou surrénale.
Causes urologiques
Les cicatrices d’une néphropathie de reflux entraînent une HTA dans 10 à 20 % des cas et exposent à une insuffisance rénale. Une HTA peut compliquer une hypoplasie rénale congénitale, une hydronéphrose, les séquelles d’hématomes ou d’infections (tuberculose), certains cancers du rein.
HTA monogéniques
Outre les formes familiales de paragangliome/phéochromocytome et d’hyperaldostéronisme primaire et des maladies familiales avec sténoses artérielles rénales, il existe deux syndromes familiaux avec rénine et aldostérone basses, le syndrome de Liddle (HTA hypokaliémique) et le syndrome de Gordon (HTA hyperkaliémique). Le diagnostic est évoqué devant des HTA diagnostiquée dans l’enfance associée à une HTA familiale et à une hypokaliémie pour le syndrome de Liddle, à une hyperkaliémie pour le syndrome de Gordon.
HTA iatrogènes
La deuxième cause d’HTA résistante (voir plus loin) est la prise de substances ou de médicaments augmentant la PA ou interférant avec le métabolisme des antihypertenseurs. Le métabolisme de la plupart des antihypertenseurs incluant les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes du récepteur de l’angiotensine II (ARAII), les antagonistes calciques (ACC) et les bêtabloquants impliquent le cytochrome P450 CYP3A4. Les diurétiques dont l’élimination est principalement rénale ne sont pas concernés. La coadministration de substances interagissant avec la fonction du cytochrome P450 comme les macrolides, les antifongiques azolés, ou le jus de pamplemousse, modifie la pharmacocinétique de certains antihypertenseurs.
Si l’interrogatoire ou la connaissance du dossier du patient identifient facilement la prise d’immunosuppresseurs, d’œstrogènes de synthèse, ou d’antiangiogéniques, la prise d’anti-inflammatoires non stéroïdiens, de décongestionnants nasaux, de dérivés de la réglisse ou d’alcool peut-être plus difficile à dépister et quantifier. La consommation de sel, difficile à évaluer par l’interrogatoire, doit faire l’objet d’une mesure de la natriurèse des 24 heures ou sur échantillon rapporté à la créatininurie. L’effet des apports excessifs en sel est plus marqué chez les patients âgés, d’origine africaine ou ayant une insuffisance rénale.
Les toxiques les plus fréquents sont l’alcool, les corticoïdes, les anti-inflammatoires non stéroïdiens (AINS), et les contraceptifs œstroprogestatifs.
- Une consommation quotidienne de boissons alcooliques en quantité importante peut induire une élévation de PA dose-dépendante ou une résistance au traitement. L’alcool agit par un effet presseur direct, par la prise de poids (un gramme apporte 8 kilocalories) et parce que son abus est associé à une mauvaise observance. Il augmente le risque d’AVC.
- Les corticoïdes peuvent provoquer une HTA hypokaliémique et la mesure de la PA fait partie du suivi de patients traités par ces agents. Les AINS (d’usage fréquent, certains disponibles sans ordonnance) élèvent la PA par divers mécanismes, en particulier une rétention sodée. Leur action est plus marquée chez les sujets âgés ou insuffisants rénaux. En moyenne, les AINS élèvent la PA systolique de 5 mmHg avec une large dispersion autour de cette moyenne. Ils augmentent le risque de complications CV de l’HTA.
- Les œstrogènes de synthèse utilisés en contraception stimulent la production hépatique d’angiotensinogène. Leur effet tensionnel est variable, dose-dépendant, plus marqué en cas de surpoids ou d’antécédent familial d’HTA. Le traitement substitutif de la ménopause n’entraîne pas d’HTA.
Sont plus rarement en cause les sympathomimétiques sous forme de décongestionnants, d’anorexigènes ou de cocaïne ; la réglisse qui inhibe l’enzyme qui convertit le cortisol en cortisone, le cortisol pouvant alors induire une HTA avec kaliémie, rénine et aldostérone basses ; les stéroïdes anabolisants, les dérivés de l’ergot de seigle, les inhibiteurs de la monoamine oxydase, les inhibiteurs de la recapture de la noradrénaline, le plomb, le mercure.
Beaucoup de ces médicaments ou toxiques peuvent être supprimés, remplacés ou réduits dans leur posologie. En revanche, certains médicaments qui sont des agents presseurs ont une importance vitale et ne peuvent être interrompus. C’est le cas des immunosuppresseurs associés ou non aux corticostéroïdes, de l’érythropoïétine et des médicaments antiangiogéniques.
Syndrome d’apnée du sommeil d’origine obstructive (SAOS)
Le lien de causalité entre l’HTA et le SAOS est contesté. Il y a une association fréquente entre les deux pathologies liées fort probablement au terrain qui est similaire. Concernant l’étiologie, certains considèrent le SAOS comme une étiologie d’HTA, d’autres non. L’absence de diminution de la PA après mise en place d’une ventilation à pression positive est un argument contre un lien de causalité.
HTA résistante
L’HTA résistante (HTAR) est caractérisée par l’absence de contrôle de la PA malgré un traitement incluant trois antihypertenseurs de trois classes différentes dont l’un est un diurétique. Elle doit être confirmée par MAPA ou AMT. Le diagnostic de résistance au traitement sous-entend la bonne observance du traitement, l’absence de prise de médicaments ou toxiques augmentant la PA ou inhibant l’action des antihypertenseurs et l’absence d’HTA secondaire. La prise en charge de l’HTAR est une démarche longue et difficile ; elle gagne à être systématisée pour ne pas méconnaître l’une des nombreuses causes favorisant la résistance au traitement.
La mauvaise observance est une des principales causes d’HTAR. Des études récentes utilisant un dosage systématique des médicaments antihypertenseurs ont montré que la moitié des hypertendus apparemment résistants ne prenait pas au moins l’un des antihypertenseurs prescrits. Cependant, le dosage des médicaments antihypertenseurs n’est pas de pratique courante. Aucun questionnaire d’étude de l’observance n’a été validé par comparaison aux dosages des médicaments.
Les antihypertenseurs doivent être prescrits aux doses optimales recommandées par les autorisations de mise sur le marché et selon les résumés des caractéristiques du produit. En revanche, il est le plus souvent inutile d’augmenter les doses au-delà de celles recommandées en raison du peu de bénéfice tensionnel supplémentaire (courbe dose/réponse plate) et de l’augmentation des effets secondaires, en particulier pour les diurétiques et les bêtabloquants. L’association de plusieurs classes d’antihypertenseurs dans des combinaisons fixes favorise l’observance et doit être privilégiée.
Renforcement du traitement diurétique. Le traitement diurétique est indispensable à la prise en charge médicamenteuse de l’HTAR. Plusieurs essais contrôlés randomisés ont confirmé l’intérêt de l’adjonction de spironolactone à la trithérapie initiale. En effet, ils ont montré une efficacité supérieure aux antihypertenseurs centraux, aux alphabloquants et aux bêtabloquants. L’ajout successif de petites doses de diurétiques appartenant à des classes différentes permet également d’améliorer le contrôle tensionnel. Des traitements non médicamenteux sont également en cours d’évaluation pour le traitement de l’HTA résistante : la dénervation rénale et la stimulation du barorécepteur carotidien.
Urgence hypertensive et HTA sévère
HTA sévère
L’HTA sévère ou de grade 3 est définie par une PA systolique ≥ 180 mmHg et/ou diastolique ≥ 110 mmHg en l’absence de complication viscérale.
Urgence hypertensive
Une urgence hypertensive est définie par la combinaison d’une PA élevée et d’une atteinte viscérale aiguë menaçant le pronostic vital. La présence d’une atteinte viscérale prime sur le niveau de PA : certaines recommandations ne mentionnent pas de seuil tensionnel, d’autres proposent un seuil de 180/120 mmHg. Ce seuil n’est pas adapté à certaines urgences comme l’éclampsie qui peuvent apparaître à niveau de PA < 180/120 mmHg.
Les principales formes d’urgence hypertensive sont en ordre décroissant l’AVC ischémique, l’IDM et l’OAP avec poussée hypertensive, les hémorragies intracrâniennes, l’HTA maligne et l’encéphalopathie hypertensive dont l’éclampsie, et la dissection aortique.
En cas d’urgence vraie, le premier geste est l’hospitalisation du patient pour assurer une surveillance continue de la PA, de l’état neurologique, cardiaque et rénal et pour administrer le traitement spécifique de la souffrance viscérale. La disponibilité d’un scanner ou d’une IRM est essentielle en cas de déficit neurologique. En cas de suspicion d’IDM ou de dissection, le transfert se fait vers un hôpital ayant un service de soins intensifs cardiaques et/ou de chirurgie cardiovasculaire.
La prise en charge dépend de la présentation : urgence neurologique ou cardiovasculaire, HTA maligne ou urgence obstétricale.
Pour les AVC, les dissections aortiques, les OAP, les IDM, la prééclampsie, la prise en charge est débutée en fonction de l’étiologie dans une structure spécialisée médico-chirurgicale. Nous détaillerons la prise en charge de l’HTA maligne et de l’encéphalopathie hypertensive dont le diagnostic est plus difficile en l’absence de signes cliniques francs.
HTA maligne et encéphalopathie hypertensive
Une HTA de grade 3 et une période récente de céphalées avec soif, amaigrissement et baisse de l’acuité visuelle suggèrent une HTA maligne. À l’extrême, le patient peut se présenter avec un coma et des convulsions sans signe déficitaire localisé (encéphalopathie hypertensive). Beaucoup d’HTA malignes sont secondaires, notamment à des causes rénales ou rénovasculaires, justifiant dans un second temps la recherche et le traitement de l’affection sous-jacente.
Dans une HTA de grade 3 symptomatique, le diagnostic d’HTA maligne doit être confirmé par le fond d’œil montrant des hémorragies ou exsudats rétiniens avec ou sans œdème papillaire. L’objectif tensionnel est d’abaisser progressivement la PA à la normale (< 140/90 mmHg) en quelques heures après réhydratation par sérum physiologique.
Bases physiopathologiques des traitements
Le traitement de l’HTA comprend les mesures hygiénodiététiques ainsi que le traitement médicamenteux.
Mesures hygiénodiététiques
Une consommation limitée en sel (inférieure à 5 g par jour) est conseillée sachant que l’apport sodé moyen en France est de 9 à 12 g par jour. Une méta-analyse montre qu’une diminution de 4,4 g de sel par jour entraîne une réduction des PAS/PAD de -5,4/-2,8 mmHg chez les patients hypertendus.
La consommation d’alcool ne doit pas dépasser 14 unités par semaine chez les hommes et 8 chez la femme (une unité équivaut à 125 ml de vin ou 250 ml de bière).
Le médecin doit conseiller aux patients hypertendus un régime alimentaire de type méditerranéen, riche en fruits et légumes, pauvre en acides gras saturés. Si le patient est obèse ou en surcharge pondérale, il est nécessaire de l’encourager à une perte de poids ou à consulter une diététicienne.
Une activité physique régulière, de 30 minutes d’exercice modéré, 5 à 7 fois par semaine par semaine, fait également partie des règles d’hygiène ainsi que le sevrage tabagique.
Traitement médicamenteux
Le traitement pharmacologique repose sur cinq classes principales :
- les diurétiques thiazidiques ;
- les inhibiteurs de l’enzyme de conversion et les antagonistes des récepteurs de l’angiotensine II ;
- les inhibiteurs calciques ;
- les diurétiques épargneurs de potassium ;
- les bêtabloquants.
Diurétiques thiazidiques
Les diurétiques thiazidiques empêchent la réabsorption du sodium au niveau du tube contourné distal. Ils inhibent le cotransport du NaCl au niveau du tube contourné distal. Leur effet global est une diurèse chloro-sodée avec diminution de l’excrétion du calcium. Le bilan sodé est négatif et la PA est diminuée par diminution de la volémie et du débit cardiaque.
Prescription
Les molécules les plus utilisées en France sont l’hydrochlorothiazide et l’indapamide.
Effets secondaires
Les diurétiques peuvent entraîner une insuffisance rénale fonctionnelle, une hypovolémie, une hypokaliémie, une hyponatrémie, une hypercalcémie et une dysfonction érectile.
Inhibiteurs calciques
Les inhibiteurs calciques sont les antagonistes des canaux calciques voltage-dépendants de type L. Le blocage des canaux calciques entraîne :
- une baisse de la PA secondaire à la baisse des résistances vasculaires par l’intermédiaire de la relaxation des cellules musculaires lisses ;
- de possibles effets chronotropes et inotrope négatifs selon les molécules utilisées (vérapamil surtout, diltiazem) justifiant une prudence dans leur utilisation comme indiqué ci-dessous.
Prescription
On classe les inhibiteurs calciques en fonction de leur structure chimique. Les dihydropyridines ont une action essentiellement vasculaire ; le vérapamil a une action cardiaque préférentielle avec un effet bradycardisant ; le diltiazem a une action mixte.
Effets secondaires
Les inhibiteurs calciques, surtout les dihydropyridines, peuvent entraîner des œdèmes des membres inférieurs, et pour le vérapamil et le diltiazem des bradycardies sinusales, des blocs sinuatriaux, voire des BAV.
Contre-indication
Le vérapamil et le diltiazem sont contre-indiqués en cas d’insuffisance cardiaque et en association aux bêtabloquants.
Inhibiteurs de l’enzyme de conversion et antagonistes du récepteur de l’angiotensine II
Inhibiteurs de l’enzyme de conversion (IEC)
Les IEC sont des inhibiteurs compétitifs de l’enzyme de conversion. Cette enzyme a pour rôle de dégrader l’angiotensine I en angiotensine II. Par conséquent, les IEC ont une action inhibant la synthèse de l’angiotensine II et la dégradation de la bradykinine.
Pour rappel, l’angiotensine II est vasoconstrictrice et favorise la synthèse d’aldostérone.
La bradykinine a une action au contraire vasodilatatrice par la stimulation de la production de NO et de prostacyclines.
Les IEC favorisent donc la diminution de la pression artérielle par la diminution des résistances vasculaires artériolaires et artérielles périphériques.
Au niveau rénal, les IEC peuvent diminuer le débit de filtration glomérulaire en vasodilatant l’artériole glomérulaire efférente.
Prescription
Plusieurs molécules sont utilisées de façon courante. On peut citer l’énalapril, le ramipril, le perindopril.
Effets secondaires
L’angiœdème est rare mais peut avoir de graves conséquences. Les effets secondaires les plus fréquents sont la toux, l’hyperkaliémie et l’insuffisance rénale.
Antagonistes du récepteur de l’angiotensine II (ARA II)
Ce sont des antagonistes des récepteurs AT1 de l’angiotensine II. Ils sont antagonistes soit compétitifs soit non compétitifs. L’angiotensine II stimule les récepteurs AT1 et AT2.
Les ARA II ont des effets pharmacologiques similaires aux IEC. Cependant, ils n’inhibent pas la dégradation de la bradykinine.
Prescription
Les molécules les plus utilisées sont le candesartan, le valsartan, l’irbesartan et le telmisartan.
Effets secondaires
L’effet secondaire principal est l’hyperkaliémie et l’insuffisance rénale.
Bloqueurs du récepteur minéralocorticoïde
Les bloqueurs du récepteur minéralocorticoïde sont aussi appelés diurétiques épargneurs de potassium. L’aldactone est la molécule la plus utilisée en France. Ce sont des stéroïdes de synthèse qui se fixent sur le récepteur des minéralocorticoïdes (MR).
Ils diminuent la réabsorption du sodium et la sécrétion de potassium au niveau du tube contourné distal. Ces phénomènes sont stimulés par l’aldostérone.
Les effets secondaires sont la gynécomastie, la dysfonction érectile, les dysménorrhées et l’hyperkaliémie.
Bêtabloquants
Les bêtabloquants sont des inhibiteurs des récepteurs β-adrénergiques. Il existe deux types de récepteurs β-adrénergiques : les récepteurs β1 et les récepteurs β2. Les récepteurs β1 sont préférentiellement localisés au niveau cardiaque, les récepteurs β2 sont présents au niveau des vaisseaux et des bronches.
Ils sont utilisés dans l’HTA mais aussi dans l’insuffisance cardiaque, les cardiopathies ischémiques et dans la prévention des arythmies cardiaques.
Les bêtabloquants baissent la fréquence cardiaque (effet chronotrope négatif), la contractilité myocardique (effet inotrope négatif), le débit cardiaque, la pression artérielle systolique et diastolique. Ils ralentissent la vitesse de conduction atrioventriculaire (effet dromotrope négatif). Ils ont un effet bathmotrope négatif.
Ils réduisent ainsi le travail cardiaque et la consommation myocardique en oxygène.
Les bêtabloquants inhibent les effets de la stimulation sympathique cardiaque, ce qui limite l’augmentation de la fréquence cardiaque et de la pression artérielle au cours de l’effort physique secondaire à la stimulation sympathique physiologique.
Ils diminuent la production de rénine par l’appareil juxtaglomérulaire.
Le mécanisme des effets antihypertenseurs est dépendant du blocage des récepteurs β1-adrénergiques. Il est multiple et fait intervenir :
- la baisse du débit cardiaque ;
- la baisse de la contractilité myocardique qui, à son tour, a pour conséquence une diminution du volume d’éjection ;
- la baisse de la production de rénine.
Prescription
Ils sont prescrits per os. Parmi les bêtabloquants, on peut citer l’aténolol, le celiprolol, le bisoprolol.
Contre-indications
Les principales sont les bradycardies sévères, les blocs sinu-atriaux, l’asthme ou la BPCO sévère, les BAV non appareillés et les syndromes de Raynaud.
Effets secondaires
L’asthénie, la dysfonction érectile, les hypotensions artérielles peuvent être mentionnées.
Stratégie thérapeutique
Les objectifs tensionnels ont été réévalués lors des recommandations récentes sur la prise en charge de l’HTA. Ainsi en mesure clinique, l’objectif tensionnel est de 130/80 mmHg pour les patients âgés de moins de 65 ans (tableau 2.3).
Tableau 2.3. Objectifs tensionnels en mesure clinique suites aux recommandations publiées en 2018.
| PAS | PAD | |
| 18–65 ans | 120–129 mmHg | 70–79 mmHg |
| 65–79 ans | 130–139 mmHg si toléré | 70–79 mmHg |
| ≥ 80 ans | 130–139 mmHg si toléré | 70–79 mmHg |
| Maladie rénale chronique quel que soit l’âge du patient | 130–139 mmHg | 70–79 mmHg |
Dans ce contexte, il est licite de considérer que pour la majorité des patients une monothérapie sera insuffisante et qu’il est donc légitime de débuter d’emblée par une bithérapie.
Pendant longtemps, les recommandations laissaient le libre choix d’utiliser l’une des classes d’antihypertenseurs pour initier le traitement puis de l’adapter (augmentation de la dose, combinaison de traitements) à la réponse tensionnelle et à la tolérance clinicobiologique. Plus récemment, les combinaisons préférées en première intention sont une association d’un bloqueur du système rénine angiotensine avec un inhibiteur calcique ou un diurétique thiazidique. Les bêtabloquants peuvent faire partie du traitement initial lorsqu’il y a une indication spécifique à cette classe thérapeutique comme un trouble du rythme, une insuffisance cardiaque, un antécédent d’infarctus du myocarde (fig. 2.10).
________________________________________________________________________________
Figure 2.10. Prise en charge de l’HTA en population générale.
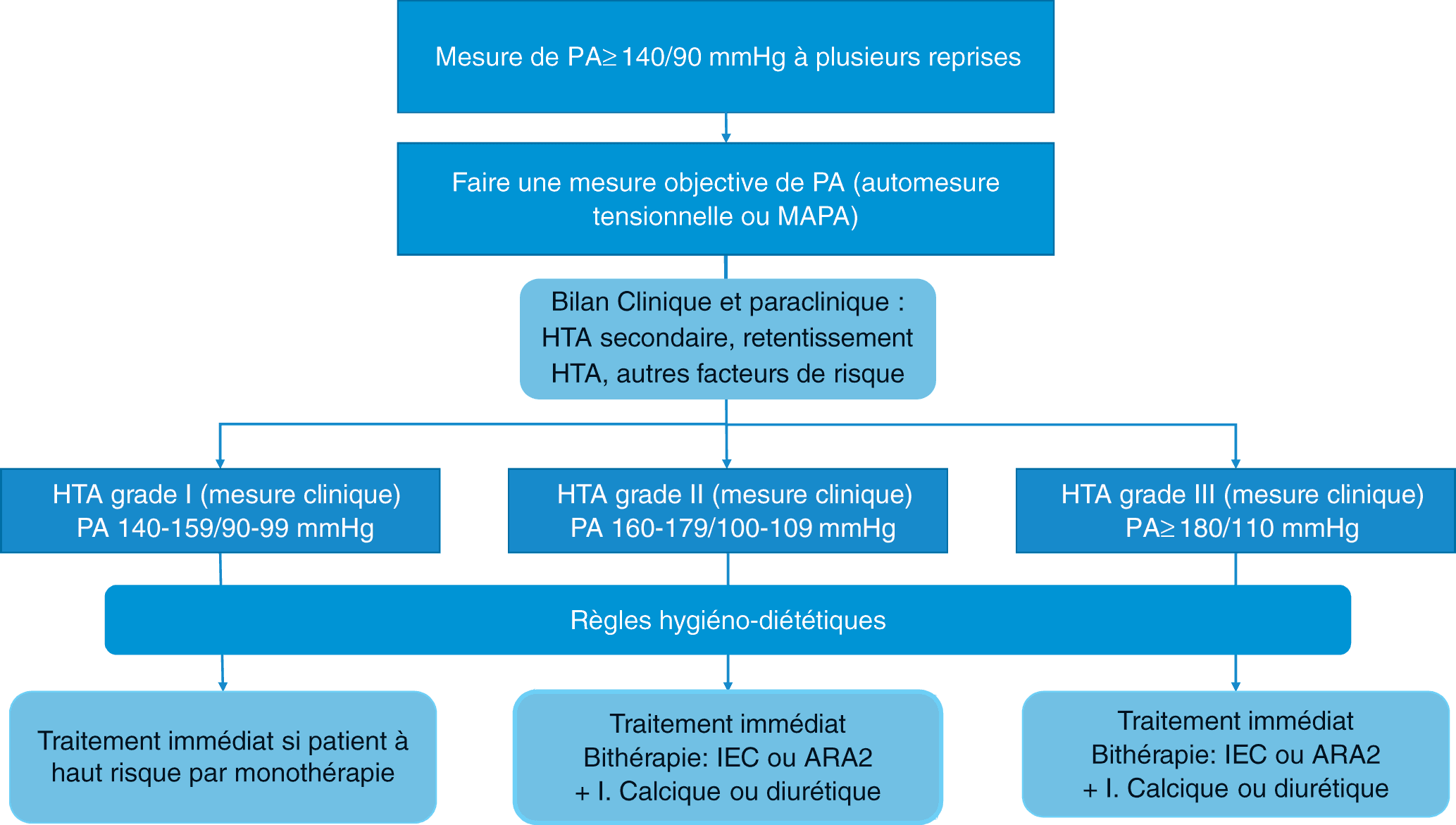
________________________________________________________________________________
Lorsque la pression artérielle n’est pas contrôlée par deux molécules, on ajoute une troisième molécule. Ainsi, la trithérapie usuelle comporte un bloqueur du système rénine angiotensine, un inhibiteur calcique et un diurétique thiazidique.
En cas de résistance à ce traitement, après le bilan nécessaire devant une HTA résistante, le traitement de quatrième ligne repose sur l’ajout d’un bloqueur du récepteur minéralocorticoïde (cf. « HTA résistante »).
Si la pression artérielle n’est toujours pas contrôlée, les traitements non médicamenteux comme la dénervation rénale ou la stimulation du barorécepteur carotidien sont en cours d’évaluation.
Prise en charge de l’urgence hypertensive
L’usage de nicardipine ou d’urapidil injectable est particulièrement adapté. Bien que les IEC par voie orale n’aient pas d’autorisation de mise sur le marché dans l’HTA maligne (et qu’il n’y ait pas, en France, d’IEC injectable), on peut aussi commencer par un apport sodé (les patients en HTA maligne arrivent le plus souvent en état de déplétion sodée) et un IEC à la condition d’une surveillance clinique (recherche d’une dyspnée) et biologique (contrôle de la créatinine) étroites. Typiquement, on prescrit un litre de sérum salé isotonique sur 24 heures (en présence de signes d’hémoconcentration et donc en l’absence de signes de surcharge) et l’on utilise du captopril pour sa courte durée d’action. La prescription est de 6,25 mg à la première prise et de 12,5 mg à la seconde prise, six heures plus tard, pour atteindre progressivement la pleine dose de 100 mg par jour. Cette option est efficace car une hypovolémie avec stimulation du SRA est habituelle dans l’HTA maligne. Elle est simple car elle s’intègre facilement dans le traitement oral ultérieur, où l’on utilise plutôt un IEC à longue durée d’action, actif en prise unique quotidienne, complété si nécessaire par un antagoniste calcique.
Conclusion
L’hypertension artérielle est une pathologie fréquente dont la prévalence va continuer à augmenter dans les années à venir. C’est un facteur de risque cardiovasculaire majeur et sa prise en charge est un enjeu de santé publique. Sa physiopathologie est plurifactorielle et le respect des mesures hygiénodiététiques est central dans la prévention comme dans le traitement de la maladie. Il est indispensable d’avoir une prise en charge standardisée et systématique, qui repose sur des mesures objectives de la pression artérielle, l’évocation et, si nécessaire, la recherche de causes secondaires, le bilan des autres facteurs de risque cardiovasculaires, et l’évaluation de l’atteinte des organes cibles. La prise en charge thérapeutique doit être guidée par les recommandations et il faut toujours penser à vérifier l’observance. Alors que le contrôle de l’HTA en France n’est que de 50 %, on estime que ce chiffre pourrait être drastiquement amélioré par une prise en charge diagnostique et thérapeutique appropriée puisque les centres experts qui suivent rigoureusement les recommandations énoncées dans ce chapitre évaluent la prévalence réelle de l’HTA résistante à seulement 10 % des patients hypertendus.
________________________________________________________________________________
Points importants
- Les quatre déterminants de la pression artérielle systolique sont le volume d’éjection systolique (VES), la vitesse d’éjection, la compliance artérielle et la pression artérielle moyenne.
- Les quatre déterminants de la pression artérielle diastolique sont la durée de la diastole, la compliance artérielle, les résistances vasculaires et la pression artérielle moyenne.
- La pression artérielle, pulsatile tout au long de l’arbre artériel, est transformée en signal continu ou quasi continu à l’entrée des organes, avec une valeur égale à la pression artérielle moyenne (PAM).
- La pression artérielle moyenne détermine la pression de perfusion des organes, à l’exception du cœur.
- La régulation à court terme de la pression artérielle fait intervenir le baroréflexe artériel, réalisant une boucle de régulation par rétrocontrôle.
- Les barorécepteurs sont placés dans la paroi des artères afin de capter les variations de pression artérielle.
- Les barorécepteurs sont des terminaisons de nerfs, sous forme de petites ramifications, qui parcourent la paroi de l’artère, et donc directement exposées à la pression qui y règne. Ce sont des tensorécepteurs sensibles à l’étirement.
- La régulation à moyen et long terme de la pression artérielle fait intervenir le système rénine-angiotensine-aldostérone, les peptides natriurétiques et l’hormone antidiurétique.
- Dans les conditions physiologiques, seules les oreillettes sécrètent les peptides natriurétiques via une voie dite régulée c’est-à-dire comportant des granules de stockage qui sont libérés lors de l’étirement de leur paroi.
- L’hormone antidiurétique ou ADH, ou vasopressine, est synthétisée par l’hypothalamus, libérée dans la posthypophyse en réponse à une augmentation de l’osmolarité plasmatique.
- La pression artérielle est égale au débit cardiaque multiplié par les résistances vasculaires, les deux étant sous l’influence du système nerveux autonome.
- La régulation à long terme de la pression artérielle est déterminée par la relation existant entre la natriurèse et la pression artérielle moyenne.
- La physiopathologie de l’hypertension artérielle est complexe et polyfactorielle, faisant intervenir la génétique, la consommation sodée et la dysfonction endothéliale.
- La prévalence de l’hypertension artérielle (HTA) est de 30 à 45 % de la population adulte.
- La prévalence de l’HTA augmente avec l’âge jusqu’à atteindre une prévalence > 60 % au-delà de 60 ans.
- La mesure de la pression artérielle repose sur une méthode auscultatoire, ou oscillométrique.
- La mesure de la pression artérielle sanglante est une méthode invasive et réservée à des situations d’instabilité hémodynamique, en soins intensifs.
- Le dépistage de l’HTA repose sur la mesure de la pression artérielle lors de la consultation (HTA si PA ≥ 140/90 mmHg).
- Les alternatives à la mesure en consultation de la pression artérielle sont l’automesure tensionnelle et la mesure ambulatoire de la pression artérielle.
- Le seuil diagnostique pour le diagnostic d’HTA en automesure est une PAS ≥ 135 mmHg et/ou PAD ≥ 85 mmHg.
- Le seuil diagnostique pour le diagnostic d’HTA en mesure ambulatoire est de 135/85 mmHg pour la moyenne diurne, 120/70 mmHg pour la moyenne nocturne et 130/80 mmHg sur l’ensemble du nycthémère.
- L’HTA est à risque de complication viscérale justifiant le bilan de l’atteinte des organes cibles.
- Le retentissement viscéral doit être recherché aux niveaux cérébral, ophtalmologique, cardiaque, rénal, vasculaire.
- L’examen clinique initial recherche systématiquement des signes évocateurs d’une HTA secondaire et également une hypotension artérielle orthostatique.
- Les examens complémentaires systématiques devant toute HTA comprennent un ECG, des examens biologiques (hémogramme, plaquettes, glycémie à jeun, uricémie, anomalies lipidiques, créatininémie avec calcul du DFG, ionogramme sanguin avec natrémie et kaliémie, micro-albuminurie des 24 heures et recherche d’hématurie).
- Une HTA secondaire doit être recherchée chez les patients de moins de 40 ans ayant une hypertension artérielle de grade 2, une HTA diagnostiquée dans l’enfance, une HTA résistante, une HTA de grade 3 et chez les patients dont l’examen clinique initial évoque une cause secondaire (hypokaliémie, insuffisance rénale…).
- Le dépistage de l’hyperaldostéronisme primaire repose sur l’évaluation du rapport aldostérone/rénine plasmatique.
- La sténose des artères rénales, cause d’HTA secondaire, est d’origine athéromateuse dans 80 à 90 % des cas, est d’origine fibrodysplasique dans 10 à 20 % des cas.
- Les causes rares d’hypertension artérielle secondaire, phéochromocytome ou paragangliome, coarctation de l’aorte, syndrome de Cushing, sont recherchées en fonction de l’orientation clinique et de l’évaluation biologique.
- Une HTA iatrogène doit être recherchée devant toute HTA résistante : consommation de boissons alcooliques, corticoïdes, œstrogènes de synthèse, anti-inflammatoires non stéroïdiens.
- L’HTA résistante est définie par l’absence de contrôle de la pression artérielle malgré un traitement incluant trois antihypertenseurs de trois classes différentes dont l’un est un diurétique.
- L’HTA résistante doit être confirmée par la mesure ambulatoire de la pression artérielle ou automesure tensionnelle et sous-entend la bonne observance du traitement ainsi que l’absence de prise de médicament ou de toxique augmentant la pression artérielle.
- L’HTA sévère ou de grade 3 est définie par une PA systolique ≥ 180 mmHg et/ou diastolique ≥ 110 mmHg, en l’absence de complications viscérales.
- L’HTA maligne est évoquée devant une HTA de grade 3 avec retentissement viscéral. Elle est confirmée par le fond d’œil (hémorragie ou exsudats rétiniens, avec ou sans œdème papillaire).
- Le traitement de l’hypertension artérielle comprend des mesures hygiénodiététiques ainsi qu’un traitement médicamenteux reposant sur cinq classes principales : diurétiques thiazidiques, inhibiteurs de l’enzyme de conversion ou antagonisme des récepteurs de l’angiotensine 2, inhibiteurs calciques, diurétiques épargneurs de potassium et bêtabloquants.
- Les objectifs tensionnels du traitement de l’HTA visent une pression artérielle < 130/80 mmHg pour les patients âgés de moins de 65 ans.
- La prise en charge de l’urgence hypertensive peut s’appuyer sur la nicardipine ou l’uradipil.
________________________________________________________________________________
2.2 Facteurs de risque cardiovasculaire (hors HTA)
Auteurs : F. Boccara et A. Cohen
Définitions
Un facteur de risque cardiovasculaire (FDRCV) est un élément biologique ou clinique dont la présence ou l’augmentation sont statistiquement reliées à l’apparition de symptômes ou de complications cardiovasculaires (associé à une augmentation de la morbi-mortalité cardiovasculaire). Il a une responsabilité causale démontrée dans l’apparition de la pathologie cardiovasculaire concernée. La baisse ou la suppression d’un FDRCV modifie de façon favorable l’apparition ou l’évolution de la maladie.
Un marqueur de risque cardiovasculaire est un élément biologique, morphologique, fonctionnel ou clinique également corrélé à l’aggravation de la maladie mais qui n’influence pas son évolution et qui n’a pas de relation causale établie avec l’apparition de la maladie. La baisse d’un marqueur de risque ne modifie pas l’évolution de la maladie.
La prévention cardiovasculaire est soit primaire (avant l’apparition d’une maladie) soit secondaire (après la découverte de la maladie) et consiste en la suppression ou le contrôle (diminution en général) d’un FDRCV pour diminuer le risque d’évènements cardiovasculaires. Elle peut être individuelle ou collective (programme de prévention).
Le risque cardiovasculaire est une probabilité d’apparition d’un évènement cardiovasculaire sur une période donnée. Il peut être absolu ou relatif. En pratique, il est divisé en quatre catégories allant de faible à très élevé. Il conditionne la prise en charge des facteurs de risque.
Plusieurs facteurs de risque ont été identifiés et sont responsables de l’augmentation d’incidence de l’athérosclérose. Ils n’ont, cependant, pas le même poids et ont leurs propres organes cibles. Les différentes combinaisons possibles de ces facteurs de risque montrent une augmentation exponentielle du risque d’athérosclérose et non pas une addition, ce qui justifie une individualisation du niveau de risque. Certains facteurs de risque comme l’âge, le sexe ou les facteurs génétiques ne sont pas modifiables ; d’autres facteurs de risque sont dits modifiables car ils sont accessibles à une intervention. Une quantification du risque global est possible pour prendre en compte le poids respectif des différents facteurs de risque à partir des données issues de grandes études épidémiologiques.
Facteurs de risque métabolique (modifiables)
L’étude Interheart, étude cas-témoins d’infarctus du myocarde (IDM), incluant toutes les régions du monde, confirme que neuf facteurs expliquent 90 % des cas d’IDM, ceci dans toutes les classes d’âge et dans les deux sexes, avec :
- six facteurs de risque que sont :
-
- le tabagisme,
- l’hypercholestérolémie,
- l’hypertension artérielle,
- le diabète,
- l’obésité abdominale,
- et des facteurs psychosociaux ;
- trois facteurs « protecteurs » que sont :
-
- la consommation de fruits et légumes,
- l’activité physique,
- et une consommation modérée d’alcool
Tabagisme
Le tabagisme reste un problème mondial majeur de santé publique, avec un nombre de décès annuels estimé à environ 5 millions, soit 13 500 décès par jour. Il est responsable de 1 décès sur 5 chez les hommes et de 1 décès sur 20 chez les femmes. En France, on lui attribue 73 000 décès par an (plus de 10 % de la totalité des décès), avec environ 2 000 décès par tabagisme passif. Un quart de ces décès sont des décès cardiovasculaires. C’est la première cause de décès évitable. Il s’agit d’un facteur de risque majeur d’athérosclérose mais aussi de thrombose. Le risque de coronaropathie est multiplié par cinq, d’accident vasculaire cérébral par trois et d’artériopathie des membres inférieurs par deux en cas de tabagisme actif et par deux de coronaropathie en cas de tabagisme passif. Les effets délétères du tabac sont liés à la quantité quotidienne de tabac consommée par jour, à l’âge de début et à la durée de l’exposition. D’où l’évaluation de l’exposition au tabac en nombre de paquets/années (nombre de paquets consommés par jour multiplié par le nombre d’années de consommation). Le risque augmente linéairement avec l’augmentation du nombre de paquets/années. Son effet est plus marqué chez les femmes, les hommes jeunes et les grands fumeurs. Il s’exprime en particulier sur les artères des membres inférieurs et au niveau des artères coronaires. Le risque de coronaropathie décroît deux ans après l’interruption du tabagisme ; il rejoint celui de la population générale au terme de 15 ans de sevrage. Environ 35 % des Français de 15 à 85 ans sont fumeurs.
Le tabagisme est à l’origine :
- d’un abaissement du taux de HDL-cholestérol, participant au développement des lésions athéroscléreuses ;
- d’un risque de thrombose lié à l’augmentation de l’agrégation plaquettaire, du taux de fibrinogène et de la viscosité sanguine (augmentation des éléments figurés du sang) ;
- d’une altération de la vasomotricité artérielle endothélium-dépendante expliquant la fréquence des manifestations de spasme coronaire ;
- d’une concentration importante de CO circulant, nuisant au transport normal de l’oxygène par l’hémoglobine.
La nicotine n’a pas de rôle spécifique dans les complications cardiovasculaires du tabagisme. Elle est essentiellement responsable de la dépendance. Ses effets hémodynamiques se limitent à des modifications mineures de la fréquence cardiaque et de la pression artérielle systolique par stimulation adrénergique. Présents pour les taux de nicotinémie induits par la combustion d’une cigarette, ces effets sont totalement absents pour les taux obtenus avec les substituts nicotiniques quelles que soient la dose et la voie d’administration.
Hypertension artérielle
L’hypertension artérielle se définit par une pression artérielle systolique (PAS) de consultation ≥ 140 mmHg et/ou une pression artérielle diastolique (PAD) ≥ 90 mmHg. D’après l’étude Esteban, la prévalence de l’HTA en France était en 2015 de 30,6 % dans une population âgée de 18 à 74 ans. Ce facteur de risque est traité en détail dans le chapitre 2.1.
Dyslipidémies
L’élévation du cholestérol total, du LDL-cholestérol (LDL-c) et la diminution du HDL-cholestérol (HDL-c) sont des facteurs de risque indépendants de maladie artérioscléreuse (risque de coronaropathie multiplié par 3). À l’inverse, l’élévation du HDL-cholestérol est protectrice. Ces désordres sont associés à une augmentation du risque de coronaropathie. La relation entre cholestérol total ou le LDL-cholestérol et le risque de coronaropathie est linéaire et sans effet de seuil. Les liens entre le cholestérol total et les AVC sont plus discutés mais ils sont décrits avec le HDL-cholestérol. En France, environ 25 % des sujets > 65 ans présentent des désordres lipidiques. Le LDL-c est calculé à partir de la formule de Friedewald grâce au cholestérol total, triglycérides et HDL-c (LDL-c = cholestérol total – HDL-c – triglycérides/5). Le seuil de LDL-c accepté est fonction du niveau de risque. Un LDL-c > 1,9 g/L est considéré comme pathologique même en l’absence de facteur de risque associé.
Pour la majorité des hypercholestérolémies, les facteurs en cause sont alimentaires et liés à des apports trop importants en acides gras saturés. Mais certaines hypercholestérolémies sont dépendantes de facteurs génétiques :
- hypercholestérolémie familiale hétérozygote (1 individu sur 300) : on doit y penser devant un LDLc > ou égale à 1,9g/L et un ATCD personnel ou familial de maladie coronaire précoce. Elle est aussi identifiable cliniquement par l’existence de dépôts de cholestérol au niveau du pourtour de l’iris (arc cornéen), sur les paupières (xanthélasma) ou les tendons (xanthome : extenseurs des membres supérieurs et tendon d’Achille). En l’absence de traitement institué précocement, les complications coronaires surviennent à partir de la quarantaine, voire plus tôt en cas d’association avec d’autres facteurs de risque ;
- hypercholestérolémie familiale homozygote (1 individu sur 1 000 000) : cette forme comporte, en plus, des dépôts cutanés importants dès le plus jeune âge et les complications coronaires peuvent survenir avant l’âge de 20 ans.
Diabète
Les diabètes de type 1 et 2 sont associés à une augmentation importante du risque cardiovasculaire. Pour le diabète de type I, le risque cardiovasculaire apparaît dès l’âge de 30 ans et est d’autant plus important que le contrôle glycémique est mauvais et qu’il y a une néphropathie diabétique associée (micro ou macro-albuminurie et/ou insuffisance rénale). La prévalence mondiale est estimée à environ 10 % ; en France, elle s’élève à 6 % au-delà de 65 ans. Le diabète de type 2 et l’intolérance au glucose sont associés à un risque cardiovasculaire majeur (risque multiplié par trois). L’effet est plus marqué chez les femmes. Le diabète de type 2 est fréquemment associé à d’autres facteurs de risque (HTA, dyslipidémie, obésité androïde). Le diabète est actuellement défini par une glycémie à jeun ≥ à 7 mmol/l (1,26 g/l) à deux reprises ou une glycémie postprandiale ou à tout moment de la journée unique > à 11 mmol/L (2 g/L).
Autres facteurs de risque vasculaire modifiables
Insuffisance rénale chronique
Elle est le plus souvent multifactorielle (diabète, HTA, etc.). Elle est associée à toutes les complications cardiovasculaires. Le niveau de risque est comparable au diabète. Dès qu’un patient est insuffisant rénal chronique stade 3 (débit de filtration glomérulaire (DFG) compris entre 30 et 59 ml/min/1,73 m2), il est considéré à haut risque et si le DFG est < à 30 ml/min/1,73 m2 à très haut risque cardiovasculaire.
Sédentarité
Le manque d’activité physique régulière est associé à une augmentation du risque de mortalité cardiovasculaire dans la plupart des études épidémiologiques. Elle est définie par une activité physique modérée < 5 fois 30 minutes par semaine ou 3 fois 20 minutes en cas d’activité intense. L’activité physique modifie certains facteurs de risque (maintien d’un poids normal, diminution de la consommation de tabac et modification du régime alimentaire). Par ailleurs, l’activité physique diminue le LDL-c, augmente le HDL-c, et diminue la pression artérielle.
Obésité
Elle est évaluée par l’indice de masse corporelle (IMC = poids/taille2). Les normales sont de 20 à 25 chez l’homme et de 19 à 24 chez la femme. On parle de surpoids lorsque l’IMC est > 27 et d’obésité > 30. L’obésité est dite morbide pour des IMC > 40. Par ailleurs, cette obésité peut être de type gynoïde ou androïde. C’est la répartition androïde des graisses, avec l’augmentation de la masse grasse intra-abdominale, qui augmente le plus le risque cardiovasculaire. Elle est estimée par la mesure de la circonférence abdominale au niveau de l’ombilic (< 102 cm chez l’homme et < 88 cm chez la femme.) L’obésité est très liée à l’HTA, au diabète, aux dyslipidémies ; elle participe à la définition du syndrome métabolique. Environ 20 millions de Français sont en surpoids, dont 6 millions sont obèses.
Syndrome métabolique
Il est défini par l’association d’au moins trois facteurs de risque : tour de taille > 102 cm chez l’homme et > 88 cm chez la femme ; triglycérides ≥ 150 mg/dL ; HDL-c < 40 mg/dL chez l’homme et < 50 mg/dL chez la femme ; TA ≥ 130 / ≥ 85 mmHg ; glycémie à jeun ≥ 100 mg/dL.
Régime alimentaire
Ce facteur de risque comportemental influe en particulier au niveau coronaire. L’effet athérogène du régime alimentaire repose sur la modification de plusieurs facteurs de risque tels que les lipides, la glycémie, l’HTA et est très intriqué avec des facteurs de risque comme l’obésité. C’est la consommation d’acides gras saturés qui est athérogène en augmentant le LDL-cholestérol. Le régime méditerranéen (pauvre en acides gras saturés et riche en acides gras insaturés) est associé au risque cardiovasculaire le plus bas et à l’espérance de vie la plus longue. La consommation de fruits et légumes, réduit le risque. On peut rattacher à ce risque l’excès de consommation de sel (consommation moyenne 9-10 g/j) source d’HTA. La consommation recommandée est < 5 g/j.
La mortalité cardiovasculaire est réduite chez les consommateurs modérés d’alcool, indépendamment du type d’alcool (10 à 30 g/j d’éthanol chez l’homme et 10 à 20 g/j chez la femme). Le lien entre la consommation d’alcool et la mortalité globale suit une courbe en U. Elle suggère que les non-consommateurs d’alcool ont une mortalité supérieure à celle des consommateurs modérés. Les consommations importantes sont classiquement associées à une mortalité importante. L’alcool augmenterait le HDL-c protecteur et serait antiagrégant. Certains alcools comme le vin contiendraient des tanins antioxydants et des polyphénols. En revanche, la consommation excessive d’alcool est susceptible d’augmenter la pression artérielle, le poids et les triglycérides et le risque de cancer des voies aérodigestives.
Facteurs psychosociaux
Ils sont représentés par :
- un niveau socio-économique bas ;
- l’absence de soutien social ;
- le stress au travail et en famille ;
- la dépression, l’anxiété.
Ces facteurs influent en particulier sur l’adhérence aux traitements et conseils d’hygiène de vie.
Facteurs de risque non modifiables
Âge et sexe
Le nombre absolu de décès cardiovasculaires est plus important chez les femmes (54 %) que chez les hommes mais, avant 65 ans, la mortalité cardiovasculaire des hommes est trois à quatre fois supérieure à celle des femmes. En pratique, les accidents cardiovasculaires surviennent en moyenne dix ans plus tôt chez l’homme que chez la femme.
Hérédité
L’évaluation d’hérédité repose sur la notion d’événements précoces chez les parents ou dans la fratrie. Ceux-ci peuvent être liés à la transmission génétique de facteurs de risque modifiables (hypercholestérolémie familiale, HTA, diabète, etc.). On parle d’hérédité coronaire précoce quand il existe une maladie coronaire ou une mort subite chez un homme de moins de 55 ans ou femme de moins de 65 ans du premier degré dans la fratrie.
Biomarqueurs du risque
Ils sont de trois ordres :
- cliniques : ces marqueurs témoignent d’un risque cardiovasculaire accru (antécédents familiaux, HDL-c bas, ACFA, syndrome d’apnée du sommeil, dépression et troubles psychiatriques majeurs, certains traitements du VIH) ;
- biologiques : plus de 100 marqueurs de risque ont été identifiés. Les plus utilisés sont :
- la protéine C réactive (CRP) : marqueur inflammatoire dosable par méthode ultra-sensible (CRPus) bien corrélé avec l’apparition de complications cardiovasculaires. Récemment un traitement par un anticorps monoclonal diminuant la quantité d’interluekine-1ß a montré une réduction des événements cardiovasculaire versus placebo (canakinumab, étude CANTOS). C’est la première étude montrant qu’une diminution de l’inflammation peut réduire le risque cardiovasculaire (et de cancer) au prix d’un sur-risque d’infection grave ;
- le fibrinogène : marqueur de l’inflammation également associé aux complications thrombotiques ;
- l’hyperhomocystéinémie : marqueur associé à un risque thrombotique accru (IDM et AVC) sans que son traitement par l’acide folique ait démontré un rôle protecteur.
- d’imagerie : ils sont le plus souvent le reflet d’un retentissement asymptomatique des facteurs de risque sur le système cardiovasculaire. Leur présence est statistiquement associée à l’apparition d’une maladie cardiovasculaire symptomatique ou d’un décès cardiovasculaire. Il en existe de très nombreux mais les cinq les mieux étudiés sont :
- la présence de calcifications importantes sur les artères coronaires évaluée par le score calcique coronaire (TDM thoracique non injecté) ;
- l’hypertrophie ventriculaire gauche (HVG) échographique dans l’HTA visualisée à l’échographie ;
- la présence de plaques carotides et l’épaississement de l’intima-media (IMT) et sur l’écho-Doppler artériel des gros vaisseaux ;
- la diminution de l’index de pression systolique (IPS) cheville/bras < 0,9 ;
- l’augmentation de la rigidité aortique mesurée par la vitesse de l’onde de pouls (VOP) carotido-fémorale.
Évaluation du risque cardiovasculaire
L’estimation du risque cardiovasculaire global de chaque patient doit être prise en compte en fonction de l’ensemble des FDRCV du patient.
Il existe plusieurs outils de prise en charge du risque CV global, aucun n’étant complet ni parfait, les deux plus importants étant :
- le modèle européen évalué par les échelles SCORE (fig. 2.11) de la Société européenne de cardiologie. Il résulte de l’agrégation des très nombreuses études effectuées en Europe. Il estime le risque de décès par IDM à 10 ans. Ce modèle européen ne tient pas compte du diabète ni des antécédents familiaux mais il tient compte des caractéristiques géographiques (gradient européen nord sud) et classe les pays en pays à bas risque cardiovasculaire (la France en fait partie) et pays à haut risque cardiovasculaire (nord de l’Europe). Il a été validé dans les populations européennes et est recommandé par toutes les sociétés savantes européennes y compris l’HAS ;
________________________________________________________________________________
Figure 2.11. Échelle européenne de risque coronaire intitulée SCORE évaluant le risque d’IDM fatal à 10 ans.
Ce score de risque cardiovasculaire inclus l’âge du sujet de 35 à 75 ans, le sexe, le tabagisme actif, le niveau de pression systolique et de cholestérol total en mmol/L.
C’est la catégorie de risque qui va conditionner toute la prise en charge future : nature des interventions (hygiéno-diététique+/- traitements), objectifs thérapeutiques, nature des traitements, rythme du suivi.
L’échelle SCORE ne doit pas être utilisée dans les populations suivantes :
- patients < 40 ans et > 70 ans : utilisation du risque relatif ;
- patients diabétiques : haut ou très haut risque ;
- patients insuffisants rénaux : haut ou très haut risque ;
- patients avec une hypercholestérolémie familiale : haut ou très haut risque.
Source : adaptée d’après les recommandations de 2019 de l’ESC © HeartScore® – European Society of Cardiology (ESC).
Elle peut être téléchargée dans sa version originale sur le site heartscore.org/fr_FR/access.
________________________________________________________________________________
- le modèle américain de Framingham repose sur une étude de cohorte réalisée aux États-Unis auprès de 5 345 hommes et femmes suivis 12 ans avec sept variables indépendantes : âge, sexe, PA systolique, HDL/CT total, diabète, HVG. Il estime l’impact des facteurs de risque sur les événements cardiovasculaires à 10 ans. Ce type de modèle est limité par le type de population, l’absence de considération de nombreux facteurs, et du fait que certains facteurs continus ne sont pris en compte que de façon qualitative (tabac, diabète, HVG). Il surestime le risque des populations européennes.
Score calcique coronaire
Les calcifications coronaires (CAC) peuvent être détectées et quantifiées par un scanner thoracique (multidétecteur) sans injection de produit de contraste. On utilise des coupes axiales de 3 mm d’épaisseur limitée à la région cardiaque synchronisé à l’ECG (le plus souvent au milieu de la diastole). La dose effective d’irradiation est faible de l’ordre de 1,5 mSV. On utilise la méthode d’Agaston-développé.
C’est un indicateur de la charge athéromateuse coronaire globale. Le score CAC est prédicteur des événements coronaires. Les sujets avec un score CAC entre 1 et 100 ont un risque d’événement coronaire multiplié par 3 à 4 par rapport à ceux avec CAC à 0. Le score CAC n’évalue pas l’ischémie myocardique. Les patients sont ainsi stratifiés en risque faible (CAC < 100), risque modéré (100–400) et risque élevé > 400.
Le score CAC améliore la précision diagnostique dans la prédiction et permet surtout de reclassifier les patients à risque intermédiaire ou élevé vers un risque faible (le plus souvent) ou un risque élevé ou très élevé.
Les patients diabétiques sont ceux qui bénéficient le plus de cet outil de reclassification. Les diabétiques ont tout d’abord une prévalence et une sévérité plus importante du score de risque par rapport au non-diabétique. La valeur pronostique du score CAC est plus élevée chez le diabétique par rapport à la population générale non diabétique. Un score CAC élevé est associé à une ischémie myocardique détecté par un test d’ischémie. La place du score CAC pour initier ou stopper un traitement par aspirine ou statine en prévention primaire est en cours d’évaluation. La société Européenne de Cardiologie en 2018 recommande l’aspirine chez les sujets avec un score CAC > 400 (recommandation IIB).
Actuellement plusieurs sociétés savantes recommandent d’utiliser le score CAC après avoir mesuré le score de risque cardiovasculaire (SCORE, Framingham) chez les sujets à risque faible ou intermédiaire pour reclasser les patients asymptomatiques permettant ainsi d’améliorer la prédiction du risque d’événement (recommandation IIB).
La Société Française de Cardiologie et la Société Francophone de Diabétologie ont récemment publié un document de consensus, proposant une stratification du risque cardiovasculaire du diabétique, fondée sur les éléments cliniques, l’existence d’autres facteurs de risque cardiovasculaire et d’atteinte d’organes cibles, et le recours au score CAC pour stratifier notamment les patients qualifiés à haut risque [1].
Prévention primaire
Son but est d’éviter l’apparition de la maladie, un grand nombre de patients doit être traité pour éviter un évènement cardiovasculaire.
Sevrage tabagique
Le tabagisme doit être évité ou totalement interrompu. Le sevrage est difficile à réaliser mais est significativement et rapidement efficace en termes de réduction de la morbidité et de la mortalité (environ de ‒50 %). Le test de Fagerström évalue la dépendance au tabac et peut orienter vers une consultation spécialisée, des thérapeutiques comportementales ou l’utilisation de traitements spécifiques d’aide au sevrage : substitution nicontinque (depuis 2018, certains de ces traitements [des gommes à mâcher et des patchs] ne sont plus pris en charge dans le forfait (150 euros annuels) car ils sont désormais remboursables à 65 %, comme n’importe quel médicament ; les complémentaires santé prennent en charge le ticket modérateur de ces médicaments), varénicline (Champix®, médicament indiqué dans l’aide au sevrage tabagique, est de nouveau remboursé depuis avril 2017 ; à la condition, cependant, qu’il soit prescrit « en seconde intention, après échec des stratégies comprenant des substituts nicotiniques chez les adultes ayant une forte dépendance au tabac ») ou bupropion (Zyban® médicament non remboursé).
L’exposition au tabagisme passif doit être également supprimée (entourage familial ou professionnel).
Le bénéfice associé à l’arrêt du tabac est une réduction du risque de ‒50 % environ.
Contrôle de l’hypertension artérielle (cf. chapitre 2.1)
Dyslipidémies
Il faut éliminer les causes secondaires de dyslipidémie avec hypercholestérolémie prépondérante (hypothyroïdie, cholestase), avec hypertriglycéridémie prépondérante (diabète de type 2, obésité, insuffisance rénale) et enfin les hyperlipidémies iatrogènes (corticoïdes, contraception œstroprogestative, diurétiques thiazidiques, rétinoïdes, immunosuppresseurs (cyclosporine, tacrolimus), certains antirétroviraux antiVIH, antipsychotiques de deuxième génération).
Il faut différencier les hypercholestérolémies familiales autosomiques dominantes des hypercholestérolémies polygéniques dont les traitements sont très différents.
Pour les hypercholestérolémies polygéniques :
- commencer par les mesures hygiénodiététiques :
-
- augmentation de la consommation de fruits et légumes, poissons,
- limiter l’apport en fromages, graisses animales,
- diminution de la consommation d’alcool,
- activité physique régulière (endurance),
- perte de poids ;
- en deuxième intention un traitement par statine est instauré en fonction du nombre de facteurs de risque et du niveau cible du LDL-C ou des triglycérides. La cible du LDL-c dépend du nombre de facteurs de risque ou de la présence d’antécédents cardiovasculaires (tableau 2.4).
Le bénéfice associé à un traitement par statine est une réduction relative du risque cardiovasculaire de ‒20 à ‒40 %.
Tableau 2.4. Recommandations Européennes de prise en charge de la dyslipidémie en fonction du niveau de risque.
Pour les hypercholestérolémies familiales :
- les mesures diététiques sont relativement inefficaces et l’initiation d’une statine puissante dès l’enfance (8 ans) est recommandée ;
- objectifs lipidiques en cas d’hypercholestérolémie familiale autosomique dominante, voir insert ci-contre.
________________________________________________________________________________
Hypercholestérolémie familiale autosomique dominante
Le LDL-c doit être :
- < 0,7 g/L si aucun autre FDR CV
- < 0,55 g/L si présence d’autres FDR ou maladie cardiovasculaire
________________________________________________________________________________
Diabète
Commencer par les mesures hygiénodiététiques pendant trois à six mois si HBA1c < 7 % :
- activité physique régulière (endurance) en vue de perte de poids (type 2) ;
- éducation thérapeutique ;
- prise en charge spécialisée multidisciplinaire.
En deuxième intention, un traitement est instauré en fonction du nombre de facteurs de risque et du niveau de l’HBA1c.
Le bénéfice de certains traitements antidiabétiques en particulier les nouveaux traitements (agoniste de la GLP-1 [disponibles en France] et antagonistes de la SGLT2 [un seul disponible en France]) sur la macro-angiopathie est une réduction relative du risque cardiovasculaire de −20 à −40 %, en particulier du risque d’insuffisance cardiaque.
Lutte contre la sédentarité = l’activité physique
L’activité physique régulière a une multitude de bénéfices démontrés d’un point de vue CV :
- effet antiagrégant plaquettaire ;
- effet anti-inflammatoire ;
- augmentation de la VO2 max et de la capacité fonctionnelle à l’effort ;
- action favorable sur la fonction endothéliale ;
- recul du seuil ischémique chez le coronarien ;
- effet anti-arythmique avec amélioration de la variabilité sinusale.
Elle a également une action favorable sur les FDRCV :
- augmentation du HDL-cholestérol ;
- baisse des triglycérides et du LDL-cholestérol ;
- lutte contre l’insulinorésistance ;
- aide au contrôle d’un surpoids ;
- aide au contrôle d’une HTA ;
- facilite le sevrage tabagique et son maintien.
Elle a également des effets antidépresseurs et améliore la libido.
Nutrition
Un régime alimentaire sain est un élément fondamental du contrôle des maladies cardiovasculaires.
Il repose sur :
- un apport en acides gras saturés < 10 % avec une substitution par des acides gras polyinsaturés ;
- un apport quotidien en sel < 5 grammes ;
- 30 à 45 g de fibres par jour ;
- 200 g de fruits /jour ;
- 200 g de légumes/jour ;
- du poisson deux fois/semaine ;
- la consommation d’alcool est limitée à 20 g/j pour les hommes et 10 grammes/jour pour les femmes ;
- un contrôle du poids en cas de surpoids ou obésité.
Prévention secondaire
Elle concerne les personnes symptomatiques ou ayant déjà souffert d’une complication cardiovasculaire (coronaires, AIT/AVC ou AOMI) ainsi que les patients chez qui une lésion athéromateuse est découverte (sténoses/occlusions carotidiennes, coronaires ou artérielles périphériques) par exemple au cours d’une échographie doppler vasculaire ou sur un scanner coronaire.
Son but est d’éviter la récidive ou l’apparition d’une nouvelle complication dans un autre territoire vasculaire.
Les principes sont les mêmes que pour la prévention primaire mais les objectifs de contrôle sont plus drastiques notamment pour le LDL-c < 0,55 g/L chez les patients coronariens (statine).
________________________________________________________________________________
Objectif lipidique en prévention secondaire et chez les sujets à très haut risque
- Prévention secondaire (ATCD IDM, SCA, sténose coronaire ou carotidienne ou AOMI).
- SCORE = 10 %.
- Diabète de type 1 ou 2 = 40 ans avec au moins un facteur de RCV ou atteinte d’organe cible.
- Patient ayant une insuffisance rénale chronique sévère DFG < à 30 ml/min/1,73 m2.
LDL-c < 0,55 g/L
________________________________________________________________________________
Points importants
- Un facteur de risque cardiovasculaire est un facteur biologique ou clinique dont la présence ou l’augmentation du taux est statistiquement liée à l’apparition de symptômes ou de complications cardiovasculaires, associés à une augmentation de la morbimortalité.
- Un marqueur de risque cardiovasculaire est un élément biologique, morphologique, fonctionnel ou clinique, corrélé à l’aggravation de la maladie mais qui n’influence pas son évolution et qui n’a pas de relation causale avec l’apparition de la maladie.
- En présence d’un tabagisme actif, le risque de maladie coronaire est multiplié par un facteur 5, le risque d’AVC d’un facteur 3 et le risque d’artériopathie des membres inférieurs d’un facteur 2.
- Le tabagisme est à l’origine d’un abaissement du taux de HDL cholestérol, d’un risque accru de thrombose lié à l’augmentation de l’agrégation plaquettaire, d’une altération de la vasomotricité artérielle endothélium dépendante et d’une concentration importante de CO circulant.
- L’élévation du cholestérol total, du LDL cholestérol et de la diminution du HDL cholestérol est un facteur de risque indépendant de la maladie athéroscléreuse.
- La prévalence de l’hypercholestérolémie familiale hétérozygote est de 1 sur 300.
- La prévalence de l’hypercholestérolémie familiale homozygote de 1 sur 1 million.
- Les diabètes de type 1 et 2 sont associés à une augmentation du risque cardiovasculaire.
- Les autres facteurs de risque modifiables sont l’insuffisance rénale chronique, la sédentarité, l’obésité, le syndrome métabolique, certains régimes alimentaires, des facteurs psychosociaux.
- Les biomarqueurs biologiques du risque cardiovasculaire sont la protéine C réactive, le fibrinogène, l’hyperhomocystéinémie.
- Les biomarqueurs morphologiques du risque cardiovasculaire sont la présence de calcifications vasculaires, l’hypertrophie ventriculaire gauche, la présence de plaques carotides, l’épaississement de l’intima média, la diminution de l’index de pression systolique et l’augmentation de la rigidité aortique.
- L’évaluation du risque cardiovasculaire repose en Europe sur l’échelle SCORE.
- La prévention primaire repose sur le sevrage tabagique, le contrôle de l’hypertension artérielle et des dyslipidémies, du diabète ainsi que sur la lutte contre la sédentarité, les corrections d’erreurs du régime alimentaire et la recommandation d’une activité physique régulière et soutenue.
________________________________________________________________________________
Exercices en ligne
Les exercices relatifs à ce chapitre sont disponibles en ligne à l’adresse suivante : http://www.em-consulte.com/e-complement/475848
Références
[1] Valensi P, Henry P, Boccara F, et al. Risk stratification and screening for coronary artery disease in asymptomatic patients with diabetes mellitus: Position paper of the French Society of Cardiology and the French-speaking Society of Diabetology. Arch Cardiovasc Dis. 2021;47:101185.
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

7.1 Pathologies de l'aorte et des artères cérébrales et périphériques Auteurs : V. Aboyans [...]

Auteurs : D. Legallois, P. Milliez Anatomie L'étude de l'électrophysiologie cardiaque nécessite de connaître [...]


