Suivez-nous sur les réseaux sociaux !
Publications
Chapitre 6 – Électrophysiologie
Auteurs : D. Legallois, P. Milliez
Anatomie
L’étude de l’électrophysiologie cardiaque nécessite de connaître deux types de structures anatomiques :
- les structures impliquées dans la génération puis la transmission de l’influx électrique à l’ensemble du myocarde : le système cardionecteur. À cette innervation intrinsèque s’ajoute une innervation extrinsèque, permettant au système nerveux autonome (sympathique et parasympathique) de moduler l’automaticité et les propriétés de conduction des voies cardionectrices ;
- les structures ne jouant pas un rôle propre dans la physiologie de la conduction ou du contrôle du rythme cardiaque mais qu’il est important de connaître car impliquées dans des processus physiopathologiques ou parce qu’il s’agit d’éventuelles cibles thérapeutiques.
Innervation intrinsèque du cœur
Le système cardionecteur a pour fonction de générer l’influx électrique et de le conduire rapidement à tout le myocarde afin d’assurer une synchronisation optimale non seulement entre les atriums et les ventricules, mais également entre les parois d’une même cavité.
Nœud sinusal, ou nœud sinuatrial
Cette structure a été découverte en 1907 par Keith et Flack. Le nœud sinusal est situé dans la paroi antérieure de l’atrium droit près de l’abouchement de la veine cave supérieure et de la base de l’auricule droite (fig. 6.1). On considère souvent qu’il a une forme de croissant, d’une longueur moyenne de 13,5 mm chez l’adulte. Ses contours sont irréguliers et il n’est pas visible à l’œil nu, son existence ne pouvant être mise en évidence que par étude électrophysiologique. Sa vascularisation se fait le plus souvent par l’artère du nœud sinusal, branche de l’artère coronaire droite.
________________________________________________________________________________
Figure 6.1. Le système cardionecteur.
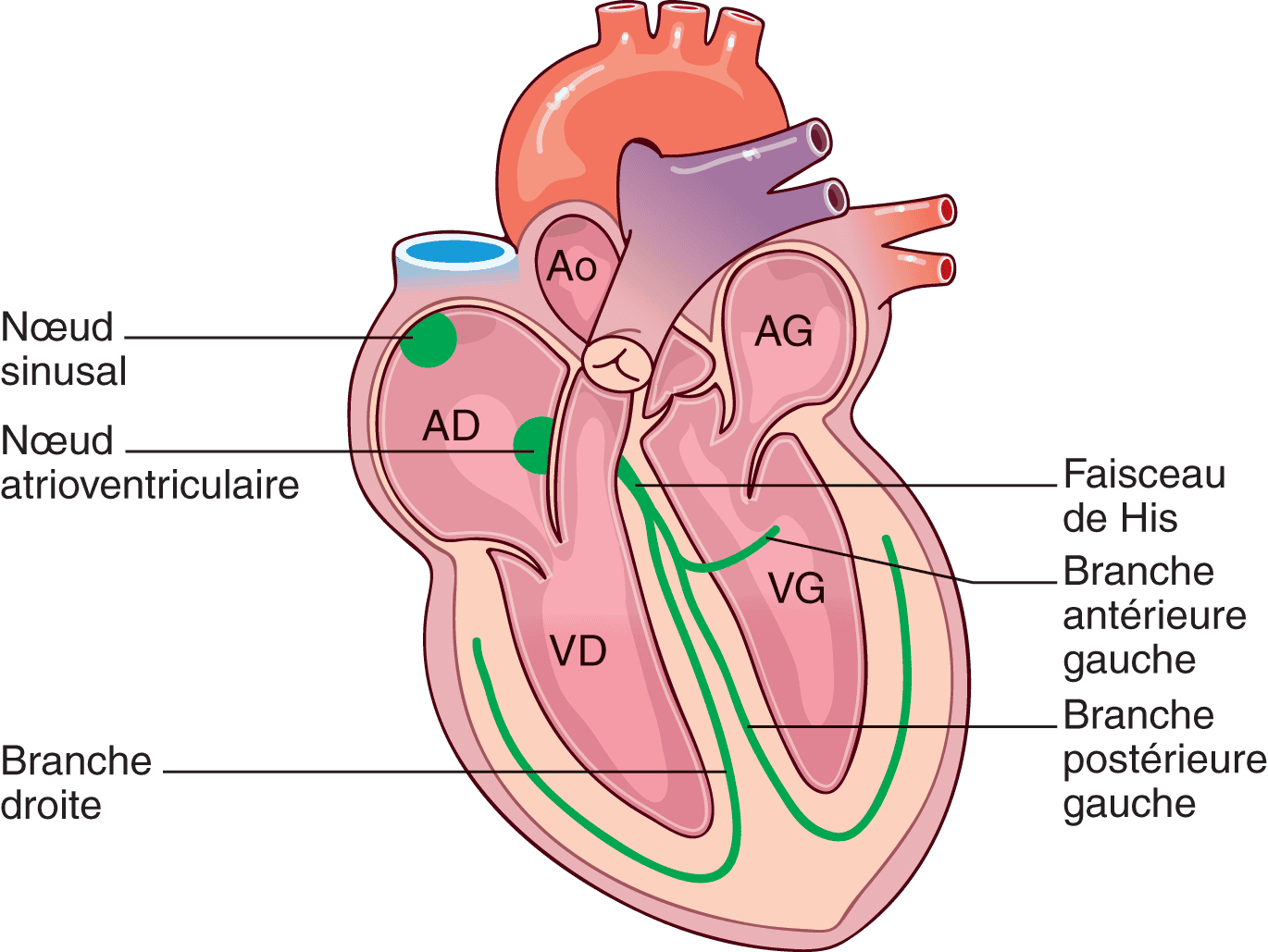
Le nœud sinusal est situé près de la veine cave supérieure, dans la paroi antérieure de l’atrium droit. Le nœud atrioventriculaire est situé au pied du septum interatrial, juste en arrière de la valve tricuspide. Le faisceau de His fait suite au nœud atrioventriculaire et chemine dans le septum interventriculaire où il donne les branches droite et gauche, la branche gauche se divisant elle-même en une branche antérieure et une branche postérieure.
________________________________________________________________________________
Nœud atrioventriculaire
Seul endroit où l’influx électrique est capable de passer entre les atriums et les ventricules dans les conditions physiologiques, le nœud atrioventriculaire est situé à la partie inférieure du septum interatrial, au sommet du triangle de Koch (fig. 6.2), limité par : en bas, l’ostium du sinus coronaire ; en avant, le feuillet septal de la valve tricuspide ; en arrière, la crête d’Eustachi – celle-ci part de la valvule de la veine cave inférieure et se dirige vers le septum interatrial.
________________________________________________________________________________
Figure 6.2. Rapports anatomiques du nœud atrioventriculaire.
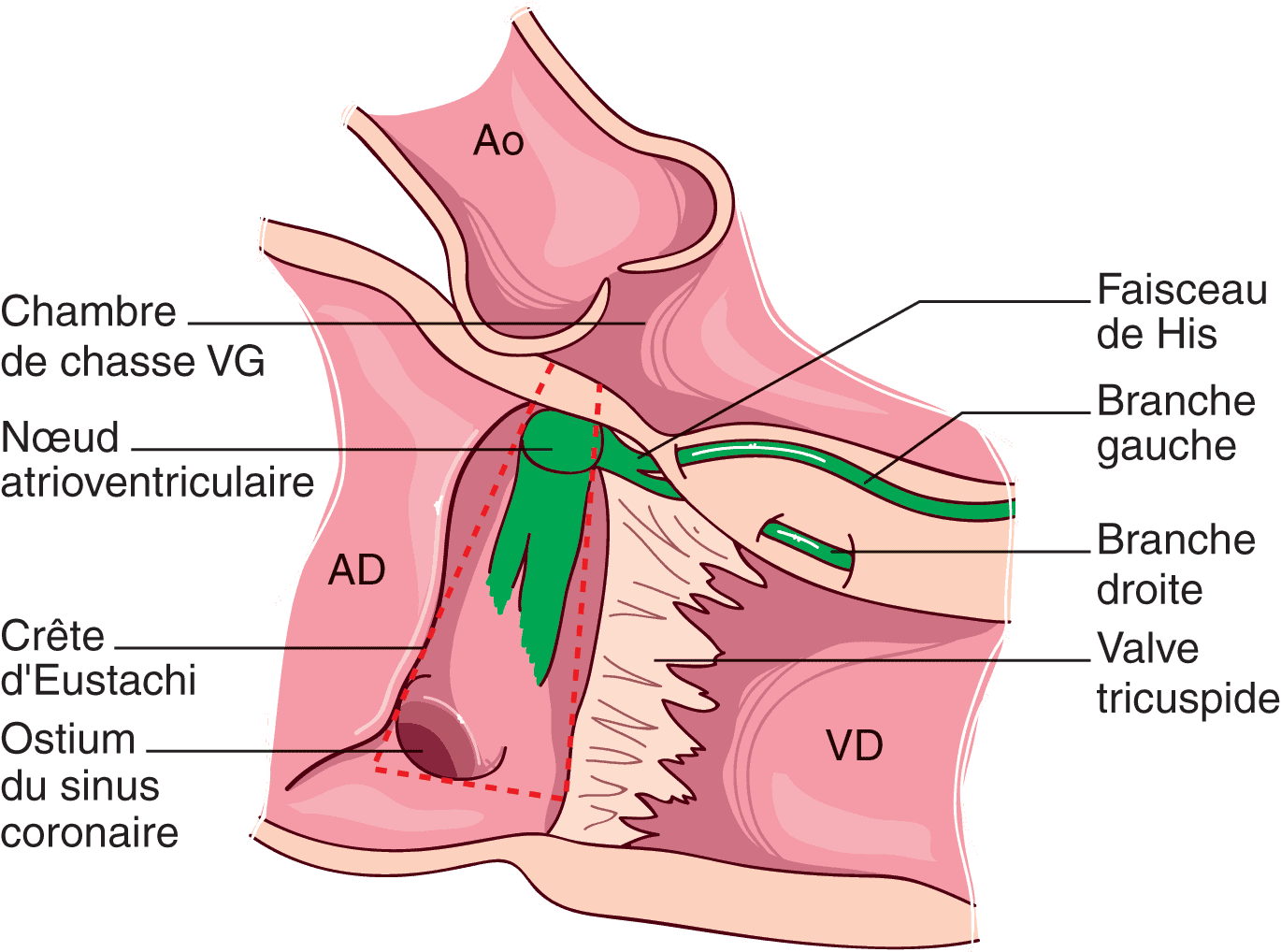
Situé à l’apex du triangle de Koch, représenté en pointillé rouge et délimité par la valve tricuspide, le sinus coronaire et la crête d’Eustachi. Remarquez les rapports du nœud atrioventriculaire avec la chambre de chasse du ventricule gauche et la valve aortique.
________________________________________________________________________________
Le nœud atrioventriculaire, ou de Aschoff-Tawara, est en rapport direct avec la chambre de chasse du ventricule gauche ; il se projette entre les valvules sigmoïdes antéro-droite et postérieure de la valve aortique.
La vascularisation est assurée par une artère septale naissant de l’artère interventriculaire antérieure, ce qui explique que les infarctus de cette branche septale soient pourvoyeurs de troubles conductifs.
Faisceau atrioventriculaire (ou faisceau de His)
Le faisceau de His naît du nœud atrioventriculaire et chemine dans le septum interventriculaire (fig. 6.1). Tout comme le nœud atrioventriculaire, il possède des rapports étroits avec la valve aortique et peut être lésé en cas d’endocardite infectieuse aortique ou de remplacement valvulaire aortique. Il se sépare en deux branches :
- la branche droite se dirige vers le bas et la paroi antérieure du ventricule droit ;
- la branche gauche se sépare rapidement en une branche antérieure, plus fine que la branche postérieure, à destinée de la majeure partie de l’innervation du ventricule gauche.
Innervation extrinsèque du cœur
Le système sympathique est cardio-accélérateur, alors que le système parasympathique est cardio-inhibiteur. Les fibres parasympathiques proviennent des nerfs vagues et les fibres sympathiques des chaînes sympathiques latérovertébrales. Les fibres provenant du système nerveux autonome se rejoignent au niveau des plexus cardiaques d’où partiront des nerfs à destinée du cœur.
Autres structures en électrophysiologie
Sinus coronaire
Des petites veines permettent le retour du sang veineux directement dans les cavités cardiaques, mais la majorité (environ 85 %) du débit sanguin coronaire rejoint l’atrium droit par le sinus coronaire. L’anatomie des veines coronaires est très variable d’un individu à l’autre. L’ostium du sinus coronaire se situe entre l’abouchement de la veine cave inférieure et la valve tricuspide. Son entrée est gardée par une petite valve, la valvule de Thébésius. Le sinus coronaire est formé par la confluence de plusieurs veines (fig. 6.3) :
- la veine oblique de l’atrium gauche (veine de Marshall) qui chemine derrière l’atrium gauche ;
- la grande veine coronaire qui contourne l’anneau mitral par sa face postérieure (elle-même formée des veines antérieures et des veines latérales) ;
- les veines postérieures (interventriculaire postérieure et postérieure du ventricule gauche) ;
- la petite veine coronaire, située dans le sillon atrioventriculaire droit.
________________________________________________________________________________
Figure 6.3. Réseau veineux coronaire.
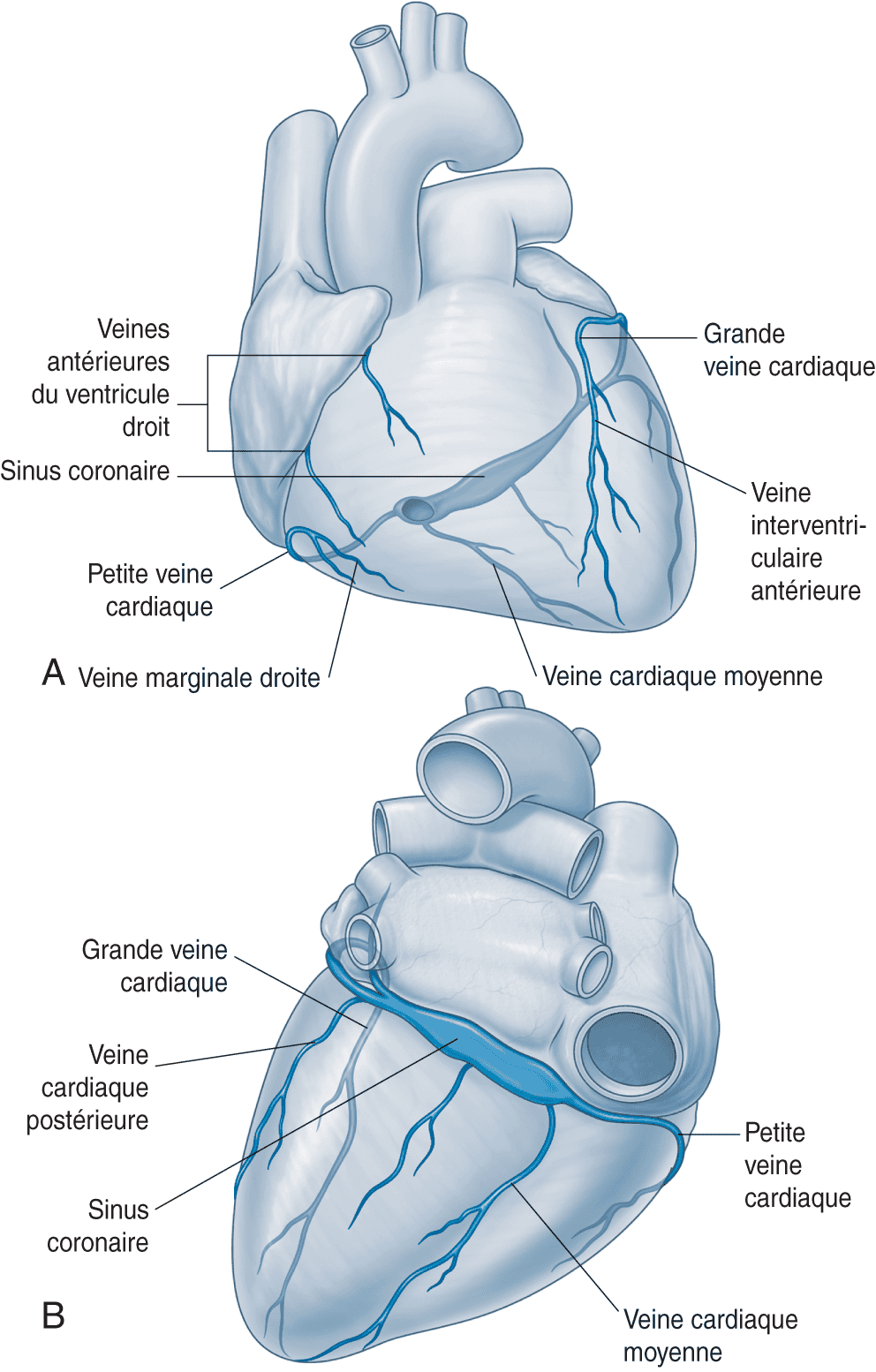
Le sinus coronaire a un trajet particulier, contournant l’orifice mitral. Il permet de stimuler le ventricule gauche sans abord artériel.
Source : Drake RL, Vogl AW. Mitchell AWM. Gray’s Anatomie pour les étudiants. 2e édition. Paris: Elsevier ; 2010.
________________________________________________________________________________
Le réseau veineux coronaire fait le tour de l’anneau mitral par sa face postérieure. Cela permet l’enregistrement de l’activité électrique de l’atrium gauche et du ventricule gauche par cathétérisme du sinus coronaire par voie veineuse et la mise en place d’une sonde de stimulation dans les branches les plus latérales de ce réseau veineux, permettant de stimuler la paroi latérale du ventricule gauche, là aussi grâce à une voie d’abord veineuse.
Isthme cavotricuspide
L’isthme cavotricuspide est une structure située entre la veine cave inférieure et l’orifice de la valve tricuspide. C’est une zone de conduction électrique lente par laquelle passe obligatoirement le circuit du flutter atrial appelé « typique » ou « commun » qui siège uniquement dans l’atrium droit. Ce circuit est une macro-réentrée car il chemine sur toute la circonférence interne de l’atrium droit (fig. 6.4).
________________________________________________________________________________
Figure 6.4. Schéma de l’atrium droit.
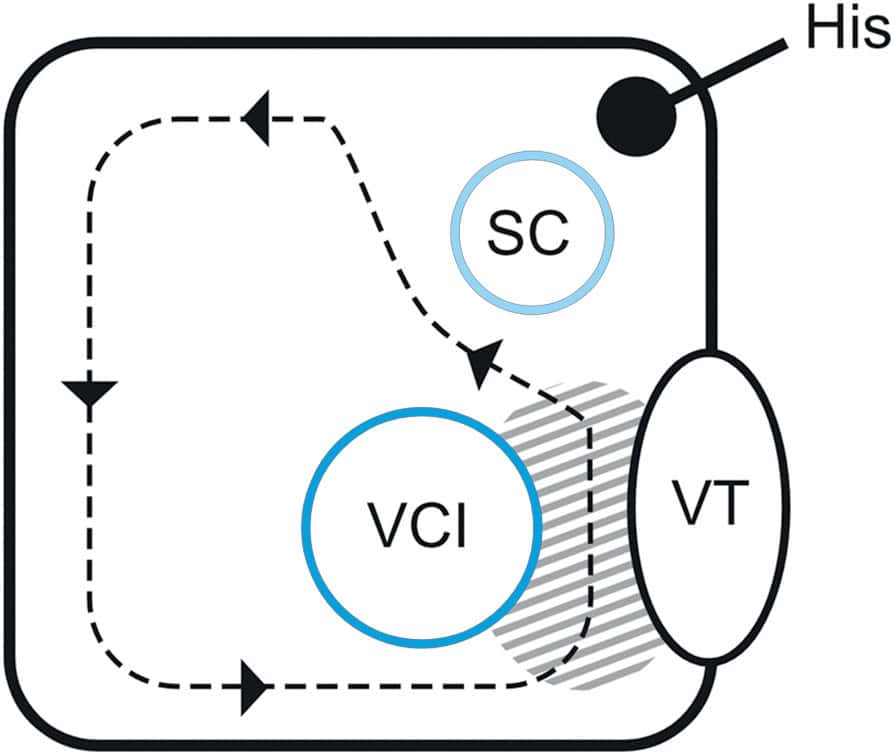
L’isthme cavotricuspide est une zone étroite, comprise entre l’abouchement de la veine cave inférieure et la valve tricuspide (en grisé). Les pointillés et les flèches montrent le trajet d’un flutter atrial typique antihoraire, passant par l’isthme cavotricuspide.
SC, sinus coronaire ; VCI, veine cave inférieure ; VT, valve tricuspide.
________________________________________________________________________________
Veines pulmonaires
Les veines pulmonaires ramènent le sang oxygéné des poumons vers l’atrium gauche. Le plus souvent, il existe deux veines pulmonaires droites et deux veines pulmonaires gauches, avec une veine supérieure et une veine inférieure de chaque côté (fig. 6.5). L’anatomie est, cependant, très variable et il n’est pas rare d’observer des veines surnuméraires accessoires ou, au contraire, un tronc commun à l’origine des deux veines pulmonaires.
________________________________________________________________________________
Figure 6.5. Reconstruction tridimensionnelle d’un scanner de l’atrium gauche, permettant de voir l’abouchement des deux veines pulmonaires gauches et des deux veines pulmonaires droites.
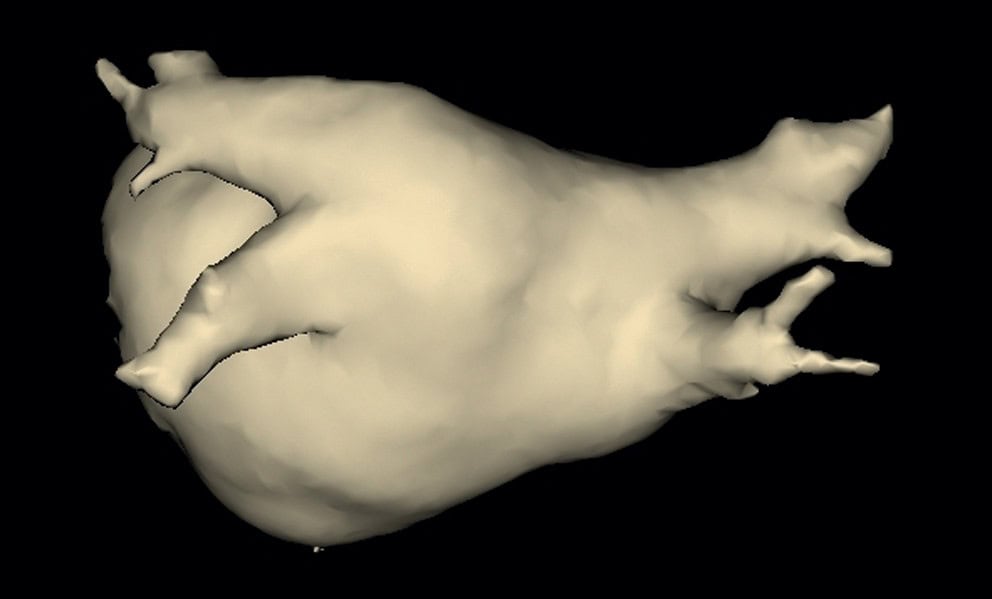
________________________________________________________________________________
Elles sont particulièrement importantes dans la physiopathologie de la fibrillation atriale. Le traitement par radiofréquence de la fibrillation atriale paroxystique consiste à isoler ces quatre veines pulmonaires du reste de l’atrium.
Histologie
Nœud sinusal, ou nœud sinu-artial
Comme le reste des structures participant à la génération et à la conduction du potentiel d’action, les cellules cardionectrices du nœud sinusal ne sont pas douées de propriétés contractiles. On ne retrouve donc pas les caractéristiques des autres cardiomyocytes. Ici, les cellules ne présentent pas de stries scalariformes, les myofibrilles sont peu nombreuses et ne sont pas organisées. Les cellules sont unies par des desmosomes. Les tubules T ne sont pas retrouvés dans les cellules cardionectrices – ces invaginations de la membrane plasmatique des cardiomyocytes permettent de mettre en contact la membrane (lieu de propagation du front de dépolarisation) et le réticulum sarcoplasmique (lieu du relargage de calcium, nécessaire à la contraction des myofibrilles). On note enfin de nombreux grains de glycogène et un tissu conjonctif riche en fibres de collagène et en vaisseaux. Le nœud sinusal est d’ailleurs centré sur l’artère du même nom (fig. 6.6). En périphérie de ce dernier, on trouve de nombreuses fibres nerveuses venant du système nerveux autonome et permettant de moduler son activité.
________________________________________________________________________________
Figure 6.6. Histologie du nœud sinusal.
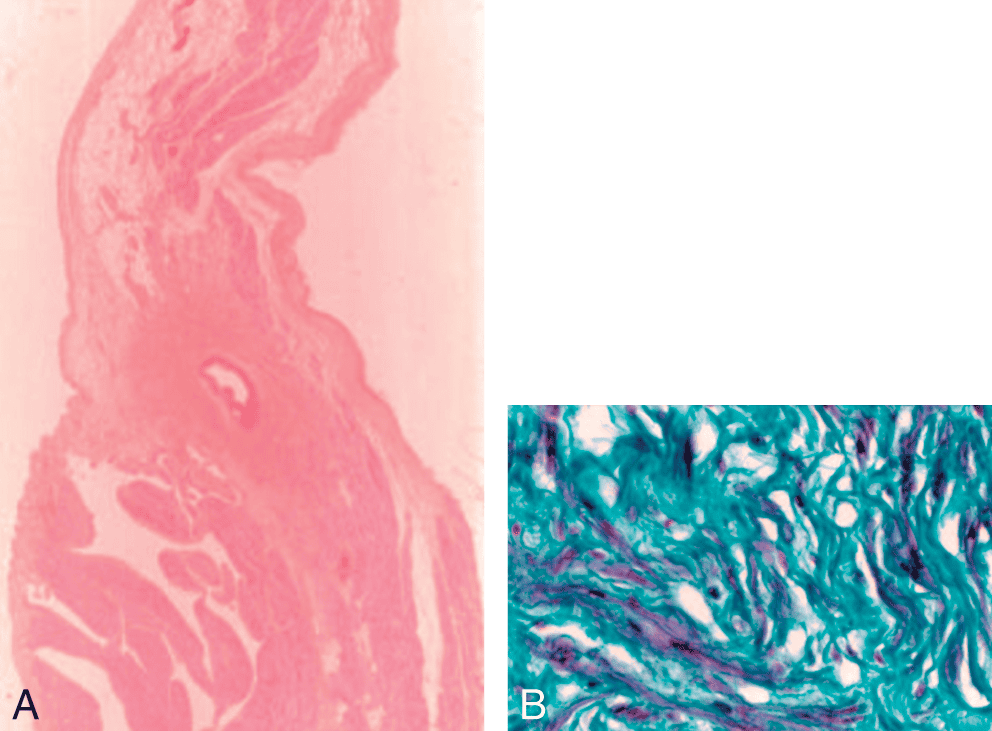
A. Le nœud sinusal centré par l’artère du nœud sinusal (coloration HES ; × 40). B. Cellules du nœud sinusal au sein du réseau conjonctif (coloration trichrome de Masson ; × 400).
________________________________________________________________________________
Nœud atrioventriculaire
Les caractéristiques histologiques du nœud atrioventriculaire sont identiques à celles du nœud sinusal.
Faisceau atrioventriculaire (faisceau de His)
Les cellules nodales y sont plus larges. Les myofibrilles sont mieux organisées, parallèles entre elles, mais peu nombreuses.
Réseau de Purkinje
À l’extrémité terminale des voies de conduction, les cellules de Purkinje forment un réseau complexe de fibres spécialisées dans la conduction du potentiel d’action. Elles sont localisées entre l’endocarde et le myocarde. Ces cellules sont de grande taille, avec un cytoplasme vacuolaire secondaire à la forte teneur en glycogène, visible par coloration par l’acide périodique-réactif de Schiff. La richesse en protéine αβ cristalline permet également de les voir en immunomarquage. Au-delà du réseau de Purkinje, la transmission du front de dépolarisation se fait de cellule myocardique à cellule myocardique par l’intermédiaire des jonctions communicantes. Même si les cellules myocardiques restent individualisées, elles sont électriquement connectées et on parle de syncytium fonctionnel.
Embryologie
Généralités
Le tissu nodal est nécessaire à la génération et à la diffusion rapide du potentiel d’action à l’ensemble du myocarde. Pourtant, lors des premières étapes du développement du cœur, le tissu cardionecteur n’existe pas. Initialement, le myocarde primitif se contracte de façon péristaltique (du segment d’admission vers la voie d’éjection) car les cardiomyocytes qui le composent possèdent certaines propriétés : ces cellules n’ont pas de potentiel de repos fixe, ce qui signifie que toutes les cellules myocardiques sont initialement douées d’automatisme ; la dépolarisation des cellules myocardiques est secondaire à l’activation de canaux calciques, dont l’ouverture est bien plus lente que les canaux sodiques ; les vitesses de conduction de l’influx électrique sont basses car il existe une faible densité de jonctions communicantes. Ces caractéristiques sont en fait celles que l’on retrouve sur le nœud atrioventriculaire adulte : aux stades les plus précoces du développement du cœur, l’ensemble des cellules myocardiques ont donc des propriétés cardionectrices.
À l’exception du tissu nodal qui conserve ces propriétés initiales, les étapes suivantes de l’embryogenèse sont marquées par une modification des propriétés électriques et fonctionnelles du myocarde : les cellules acquièrent un potentiel de membrane de repos stable. Il n’existe plus de pente de dépolarisation diastolique de la membrane et il y a donc perte de l’automaticité ; la phase 0 du potentiel d’action (dépolarisation) se fait par les canaux sodiques, dont l’activation est bien plus rapide que les canaux calciques ; l’expression des connexines, notamment de la connexine 43, est augmentée. L’augmentation du nombre de jonctions communicantes, véritable couplage électrique des cellules entre elles, aboutit à une augmentation de la vitesse de conduction du front de dépolarisation. Le mode de contraction initialement péristaltique devient synchrone.
Formation du nœud sinusal, ou nœud sinu-artial
Aux stades précoces du développement, sous la dépendance du gène Nkx2.5, le développement du nœud sinusal est bilatéral mais ne s’achève qu’à droite sous la dépendance du gène Pitx2c. Le gène Pitx2c est fondamental pour la latéralisation non seulement du cœur mais également pour tout l’organisme. En effet, chez la souris, une absence d’expression de Pitx2c aboutit à un isomérisme droit avec existence de deux atriums morphologiquement droits, de deux nœuds sinusaux ; mais, en revanche, il existe une asplénie.
Formation du nœud atrioventriculaire et des branches du faisceau de His
Le nœud atrioventriculaire garde les propriétés du myocarde primitif, expliquant qu’il s’agit d’une zone de conduction lente de l’influx électrique. Il est situé à la partie atriale de l’anneau fibreux isolant électriquement les atriums des ventricules et se prolonge par le faisceau de His et ses branches, permettant la transmission du front de dépolarisation aux ventricules. Il s’agit donc d’un « passage obligé » pour le potentiel d’action – sauf en cas de voie de conduction accessoire. Les études immunohistochimiques ont permis de mieux comprendre l’origine embryologique du nœud atrioventriculaire et du faisceau de His. Un anticorps monoclonal, dirigé contre un antigène tissulaire neural (G1N2), se lie également de façon spécifique à certains cardiomyocytes dans le cœur humain embryonnaire. L’évolution de ce marquage permet de suivre, d’étape en étape, le développement du nœud atrioventriculaire et des voies de conduction infra-nodales. L’ensemble des voies de conduction semble se développer à partir du myocarde formant le foramen interventriculaire primitif. La forme de cet « anneau » de G1N2+ suit les étapes de développement du cœur (fig. 6.7). Dans un premier temps, le déplacement de l’atrium primitif vers l’arrière et la droite crée une boucle de cellules G1N2+ localisée à la partie basse du canal atrioventriculaire. Au niveau de l’anneau atrioventriculaire droit (future valve tricuspide), les cellules G1N2+ donnent naissance au nœud atrioventriculaire. Ces cellules restent en continuité avec l’anneau initial qui donnera le faisceau de His et ses branches, lorsque la septation ventriculaire aura eu lieu. La branche droite et la branche postérieure gauche du faisceau de His proviennent de l’anneau de cellules G1N2+. Elles cheminent dans le septum interventriculaire quand la septation ventriculaire est terminée. La branche antérieure gauche est le résultat du déplacement de la voie d’éjection vers les cavités gauches. Lors de son trajet, l’anneau de cellules G1N2+ a un prolongement dans la chambre de chasse du ventricule gauche (fig. 6.1 et 6.7).
________________________________________________________________________________
Figure 6.7. Développement des voies de conduction.
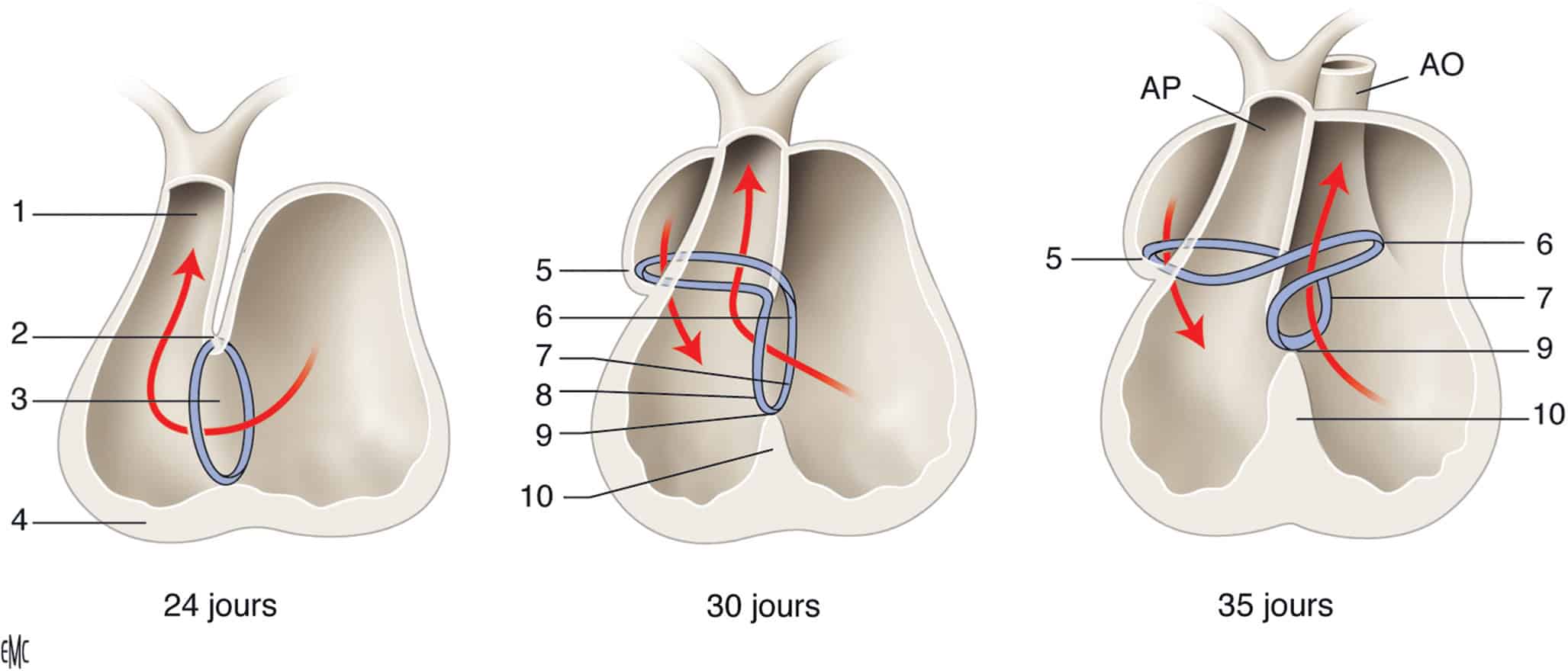
En bleu, les cellules myocardiques visibles par le marquage G1N2. Initialement situé en regard du foramen interventriculaire (à gauche), cet anneau va finalement avoir une forme bien plus complexe après le déplacement des atriums vers la droite (au centre) et de la voie d’éjection vers les cavités gauches (à droite).
AO, aorte ; AP, artère pulmonaire. 1. Anneau atrioventriculaire droit. 2. Zone du nœud atrioventriculaire. 3. Tronc du faisceau de His. 4. Branche septale. 5. Bifurcation du faisceau de His. 6. Septum interventriculaire. 7. Conotruncus. 8. Anneau primitif. 9. Courbure externe. 10. Courbure interne.
Source : d’après Houyel L. Embryologie du cœur normal. Encycl Méd Chir (Elsevier, Paris), Cardiologie, 11-001-C-10, 2009 ; modifié de Wessels et al. Copyright © 2009 Elsevier Masson SAS. Tous droits réservés.
________________________________________________________________________________
Physiologie cellulaire
Bases biophysiques de l’excitabilité cellulaire
Loi d’Ohm
La loi d’Ohm, lorsqu’elle s’applique à un circuit électrique, s’écrit : U = R · I. La différence de potentiel U (en volts) aux bornes d’une résistance R (en ohms) est proportionnelle à l’intensité du courant électrique I (en ampères) qui la traverse. En biologie, il est plus simple de parler de conductance que de résistance. La conductance d’un canal ionique pour un ion correspond donc à la capacité de ce canal à laisser passer l’ion en question. La conductance (notée g) est l’inverse d’une résistance. La formule devient donc : I = g · U.
Membranes biologiques
Les membranes biologiques sont constituées d’une bicouche lipidique, imperméable aux ions et aux charges électriques, et sont capables d’accumuler de façon asymétrique des charges électriques à leurs deux faces, comme les condensateurs. Dans la membrane, il existe des protéines appelées canaux permettant le passage des ions d’un côté à l’autre de la membrane. Le déplacement des ions d’une face à l’autre de la membrane engendre des courants électriques, permettant de charger le condensateur. La membrane est aussi une pile.
Conductance des canaux ioniques
Un type de canal donné possède une conductance g spécifique pour chaque type d’ions. Certains canaux ont une conductance très élevée au potassium et quasiment nulle aux autres ions, on parle alors de canal potassique. Il existe également des canaux moins spécifiques, pouvant laisser passer plusieurs sortes d’ions.
Potentiel d’équilibre d’un ion : exemple de la pile au potassium
Imaginons une cellule théorique qui n’aurait que des canaux potassiques et que l’ensemble de ces canaux soit fermé. La concentration de potassium est de 3 à 5 mM à l’extérieur de la cellule et d’environ 140 mM dans le cytosol. Il existe donc un gradient de concentration des ions K+ entre l’intérieur et l’extérieur de la cellule. Dans un deuxième temps, les canaux potassiques sont ouverts. Les ions K+ vont fuir le cytosol par les canaux. Le déplacement de ces ions charge la pile au potassium qu’est la membrane cellulaire : la fuite des ions potassiques rend la membrane positive sur son versant externe alors qu’elle sera négative sur son versant interne. Il devient plus difficile pour un ion K+ de sortir de la cellule, jusqu’au moment où le flux d’ion sortant par gradient de concentration devient égal au flux d’ion entrant par gradient électrochimique. Il n’y a plus de passage d’ions à travers la membrane : la membrane a atteint son potentiel d’équilibre (fig. 6.8).
________________________________________________________________________________
Figure 6.8. Potentiel de membrane.
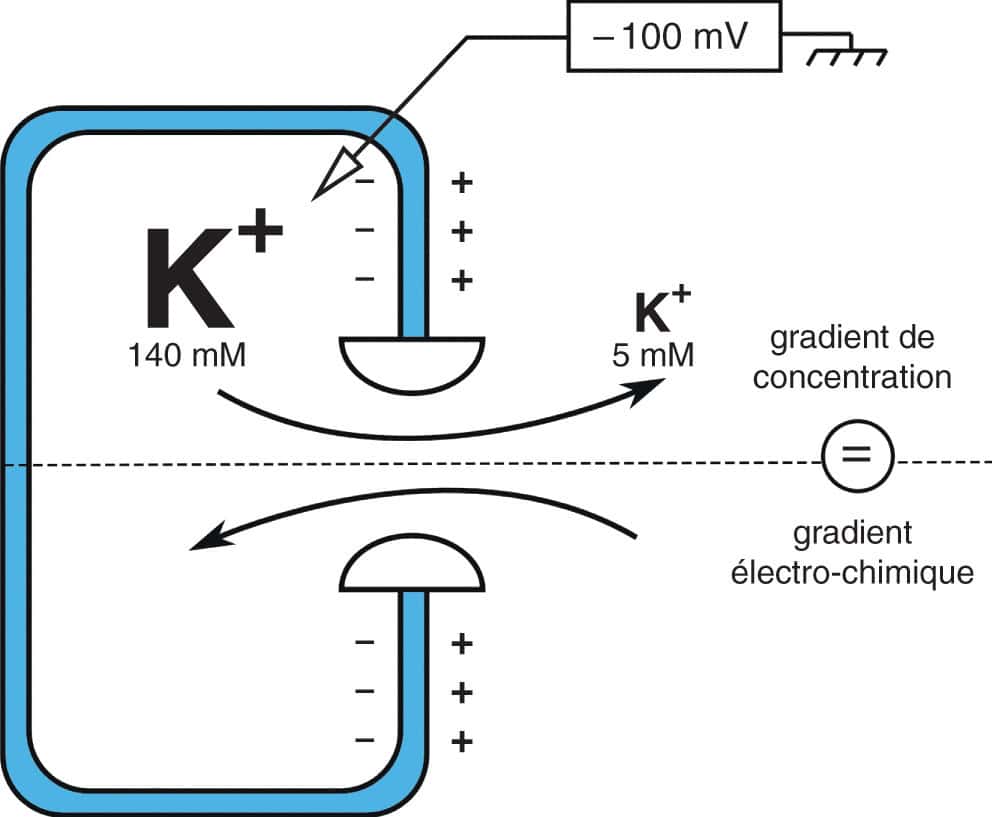
Cette cellule a un potentiel de membrane de – 100 mV. La quantité d’ions potassium entrant dans la cellule par le gradient électrochimique est égale à la quantité d’ions potassium sortant de la cellule par le gradient de concentration. Le bilan est nul, il s’agit du potentiel d’équilibre de l’ion (à condition qu’il n’y ait pas d’autres canaux laissant passer un autre ion).
________________________________________________________________________________
Pour chaque ion, l’équation de Nernst permet de calculer le potentiel d’équilibre (cf. encadré). Pour l’ion potassium, le calcul retrouve – 103 mV :
- si le potentiel de membrane est en dessous de – 103 mV, le flux d’ions K+ est entrant ;
- si le potentiel de membrane est au-dessus de – 103 mV, le flux d’ions K+ est sortant ;
- ce flux est d’autant plus intense qu’on est éloigné du potentiel d’équilibre de l’ion.
________________________________________________________________________________
Équation de Nernst
L’équation de Nernst donne le potentiel d’équilibre E pour un ion donné (en mV), en fonction de Ce, concentration à l’extérieur de la membrane de l’ion considéré (en mM), et Ci, concentration à l’intérieur de la membrane de l’ion considéré (en mM) :
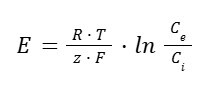
Avec :
- R : constante des gaz parfaits, égale à 8,314 J · mol− 1 · K− 1 ;
- T : température en °K ;
- z : valence de l’ion considéré ;
- F : constante de Faraday, égale à 96 485 C · mol− 1.
________________________________________________________________________________
Ouverture et fermeture des canaux ioniques
Différents stimulus d’ouverture des canaux
Il existe une grande variété de canaux ioniques (tableau 6.1). La plupart ont une origine génétique commune et il en existe des grandes familles possédant des caractéristiques communes. L’une d’entre elles est le stimulus d’activation : les canaux voltage-dépendants s’activent lorsque le potentiel de membrane atteint un potentiel cible. Certains sont sensibles au gradient de concentration de l’ion pour lequel ils ont la meilleure conductance et d’autres enfin sont couplés à une activité de récepteur et s’ouvrent en présence de calcium ou d’ATP.
Tableau 6.1. Principaux canaux ioniques.
| Nom du courant | Phase du potentiel d’action | Ions | Canal | Gène | Stimulus |
| INa | 0 | Na+ | NaV1.5 | SCN5A | Voltage-dépendant |
| Ito,f | 1 | K+ | Kv4.3 | KCND3 | Voltage-dépendant |
| Ito,s | 1 | K+ | Kv1.4 | KCNA4 | Voltage-dépendant |
| ICaL | 2 | Ca2 + | Cav1.2
DHPR |
Voltage-dépendant | |
| IKur | 3 | K+ | Kv1.5 | KCNA5 | Voltage-dépendant |
| IKr | 3 | K+ | Kv11.1
HERG |
KCNH2 | Voltage-dépendant |
| IKs | 3 | K+ | Kv7.1 | KCNQ1 | Voltage-dépendant |
| IK1 | 4 | K+ | Kir2.1, Kir2.2 | ||
| IKATP | K+ | Kir6.2 | ATP | ||
| IKAch | Kir3.1-Kir3.4 | Acétylcholine | |||
| INa-Ca | Toutes | 3Na+/Ca2 + | NCX | Gradients transmembranaires de Ca2+ et de Na+ | |
| INa/K-ATPase | Toutes | 3Na+/2K+ | Na/K-ATPase | ATP | |
| If | 4 | Na+, K+ | HCN | Voltage-dépendant |
Portes d’activation et d’inactivation
Un canal (et a fortiori tous les canaux d’une cellule) n’est pas ouvert ou fermé de manière figée. On parle plutôt de probabilité d’ouverture : si une population de canaux est dite ouverte, cela signifie que, statistiquement, la majeure partie d’entre eux sont ouverts, mais qu’en permanence ces canaux s’ouvrent et se ferment. Il faut savoir également que la majeure partie des canaux tendent à se fermer (toujours de façon probabiliste) après un certain temps d’ouverture. Cela est secondaire à la structure des canaux, souvent porteurs de deux portes : une porte d’activation rapide et une porte d’inactivation lente (fig. 6.9 et 6.10).
________________________________________________________________________________
Figure 6.9. Portes d’activation et d’inactivation. Exemple du canal sodique.
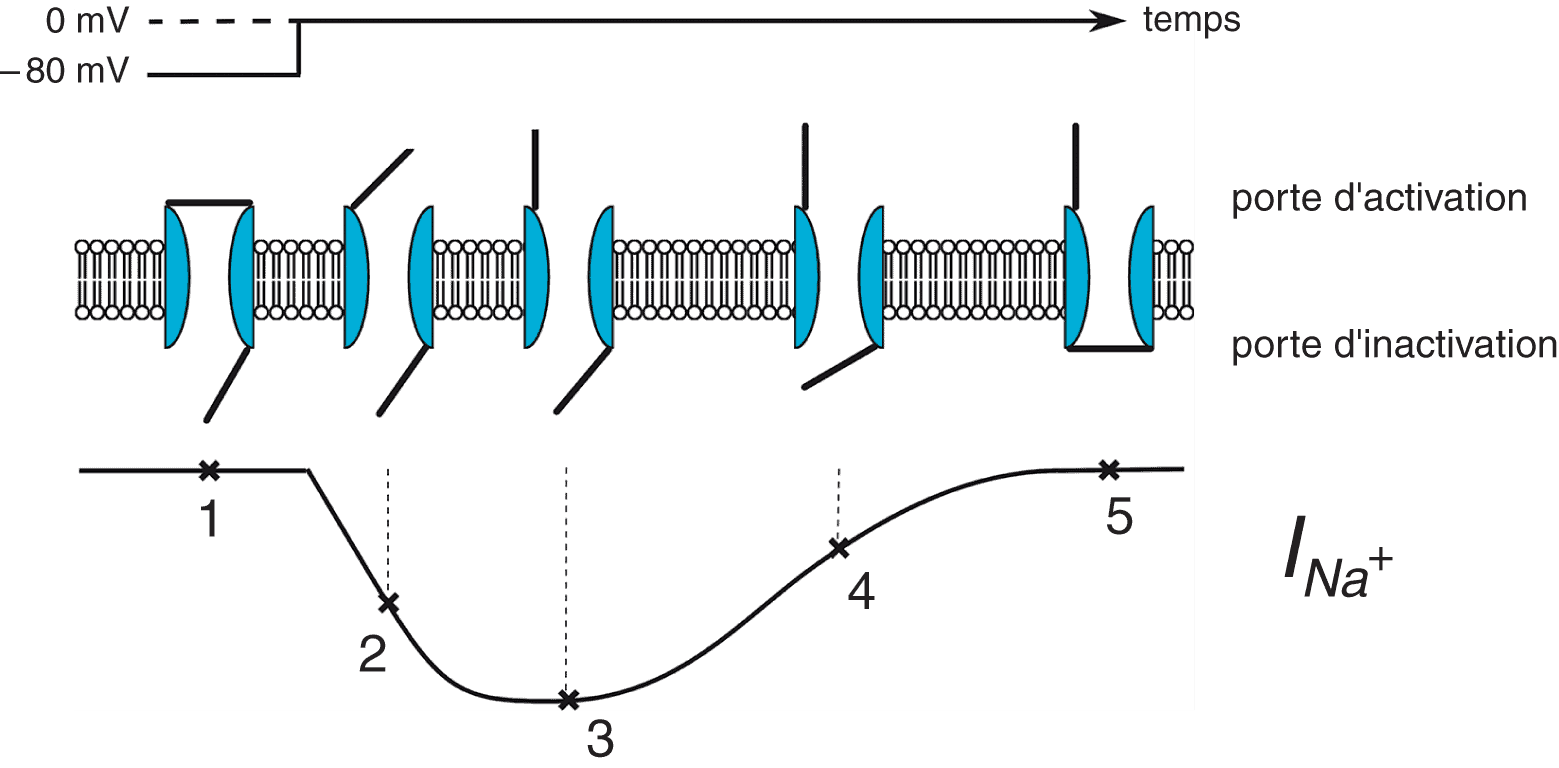
Lorsque la cellule est au potentiel de repos de – 80 mV, la porte d’activation est fermée et la porte d’inactivation est ouverte, le canal est fermé (1). Lorsqu’on dépolarise la cellule de -80 à 0 mV, la porte d’activation s’ouvre rapidement et le courant INa augmente rapidement en intensité (2, 3). Pendant ce temps, la porte d’inactivation se ferme, ce qui aboutit à une diminution du courant INa (4) puis à sa disparition quand l’ensemble des canaux sont inactivés (5), c’est-à-dire que la porte d’inactivation est fermée.
________________________________________________________________________________
Figure 6.10. Canal à trois états différents.
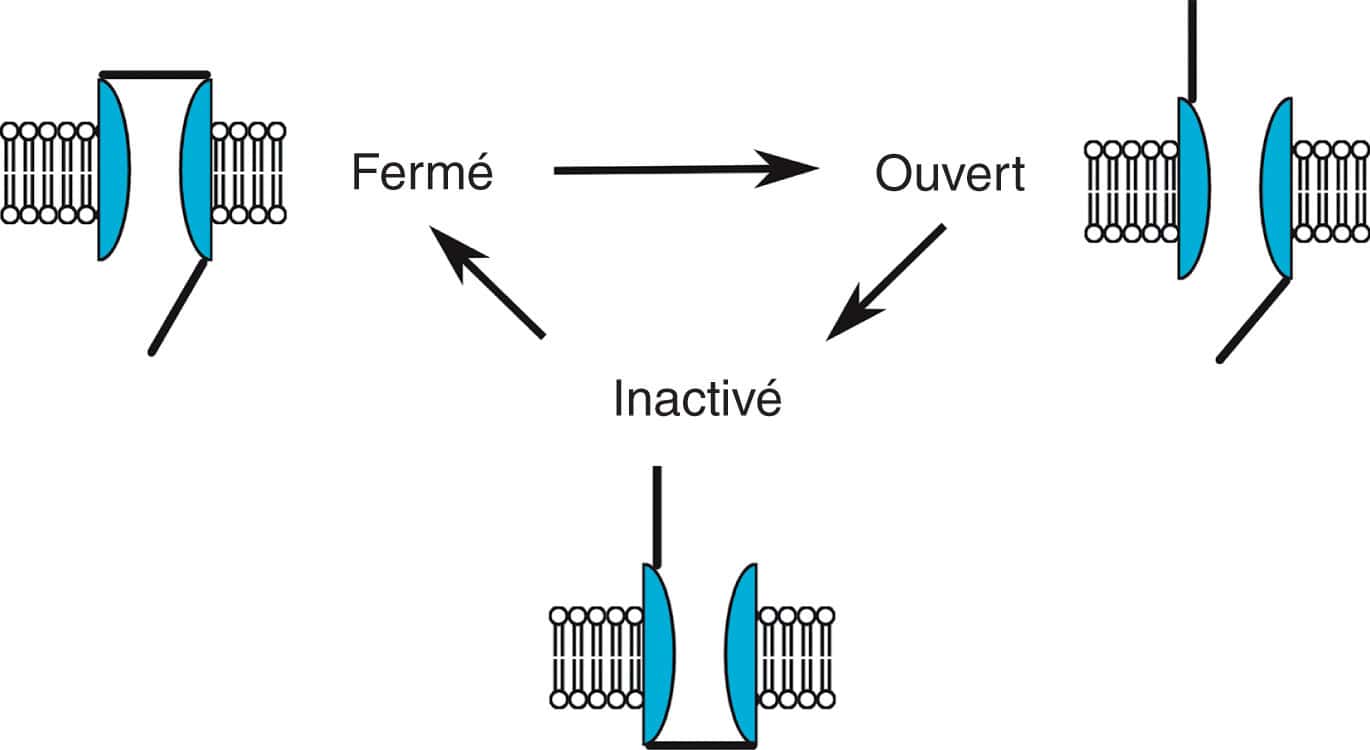
Certains canaux ont donc trois états différents : un état fermé pendant lequel un stimulus va pouvoir ouvrir le canal et le faire passer à l’état ouvert, et un troisième état inactivé. Dans ce dernier cas, le canal ne peut être réouvert même si le stimulus d’ouverture est présent. Il faut repasser par l’état fermé. La porte d’activation est en haut, la porte d’inactivation est en bas.
______________________________________________________________________________
À l’état de repos, la porte d’activation est fermée alors que la porte d’inactivation est ouverte. Lorsqu’une population de canaux voltage-dépendants est activée, les portes d’activation et d’inactivation changent de position. La porte d’activation rapide s’ouvre rapidement, laissant passer les ions car la porte d’inactivation est elle aussi ouverte. Mais la porte d’inactivation a débuté sa fermeture, plus lentement que l’ouverture de la porte d’activation. Après un certain temps, la porte d’activation est toujours ouverte mais le canal ne peut plus laisser passer d’ions car la porte d’inactivation est fermée : on dit que le canal est inactivé (fig. 6.9). Le canal est inactivé mais non fermé. La configuration des deux portes est l’exact inverse de la configuration de départ, lorsque le canal était fermé. À partir de cet état inactivé, le canal repasse ensuite à l’état fermé, autorisant sa réouverture si son stimulus déclencheur est présent. Le canal ne peut s’ouvrir lorsqu’il est inactivé. Ce concept est particulièrement important.
Prenons l’exemple des canaux sodiques rapides, responsables de la phase 0 du potentiel d’action dans les cardiomyocytes :
- le canal s’ouvre quand le potentiel de membrane atteint –50 mV (fig. 6.9) ;
- l’ouverture de ces canaux sodiques entraîne une brutale entrée de sodium dans la cellule par gradient de concentration ;
- cette entrée d’ions sodium conduit le potentiel de membrane au-dessus de 0 mV ;
- si les canaux ne s’inactivaient pas après un temps donné, les canaux sodiques seraient toujours ouverts, permettant au sodium de continuer d’entrer dans la cellule pendant le plateau du PA, ce qui empêcherait les canaux potassiques voltage-dépendants qui s’activent dans cette gamme de potentiels, de permettre la repolarisation du cardiomyocyte grâce aux courants potassiques sortants qu’ils transportent, autorisant le retour au potentiel membranaire de repos de –70 mV.
Courant dépolarisant et courant repolarisant
Le potentiel de repos d’une membrane est d’environ –70 mV. Un courant dépolarisant tend à amener le potentiel vers 0 mV. À l’inverse, un courant repolarisant tend à ramener le potentiel de membrane à sa valeur de repos. Il existe deux possibilités pour générer un courant dépolarisant ou un courant repolarisant :
- le courant dépolarisant est secondaire :
-
- à un courant entrant cationique ;
- ou à un courant sortant anionique :
- le courant repolarisant est secondaire :
-
- à un courant entrant anionique ;
- ou à un courant sortant cationique.
Potentiel d’action : intégration à la cellule entière
Le potentiel de membrane correspond à la sommation des différents potentiels d’équilibre des ions. Les piles, disposées en parallèle, contrôlent la tension aux bornes du condensateur membranaire.
Potentiel d’action des cardiomyocytes
Le potentiel d’action des cardiomyocytes est bien plus long que celui des autres cellules musculaires de l’organisme. Il est composé de plusieurs phases (fig. 6.11).
________________________________________________________________________________
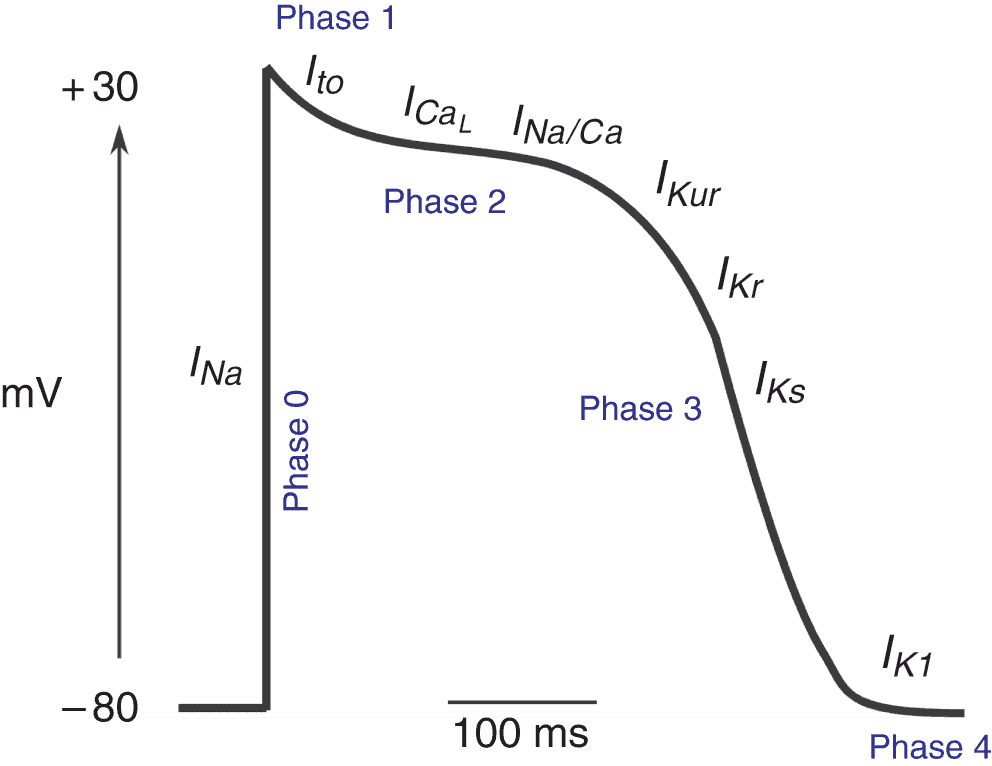
Figure 6.11. Le potentiel d’action du cardiomyocyte est constitué de plusieurs phases, correspondant aux ouvertures et fermetures successives de plusieurs canaux ioniques.
________________________________________________________________________________
Phase 0
C’est la phase de dépolarisation rapide. Lorsque la cellule est dépolarisée par la cellule voisine, le potentiel de membrane atteint le seuil d’activation des canaux sodiques rapides. L’ouverture de ces canaux amène le potentiel de membrane vers le potentiel d’équilibre des ions Na+ (+ 60 mV). À cet instant, la cellule n’est perméable qu’au Na+ et le fort gradient de concentration de ces ions est responsable d’un courant cationique entrant dépolarisant, INa. Les canaux sodiques rapides s’inactivent ensuite rapidement.
Phase 1
C’est la phase de repolarisation transitoire, sous la dépendance du courant appelé Ito. Il s’agit d’un courant sortant repolarisant potassique. Ce courant a pour but de maintenir le potentiel de membrane dans la gamme de valeur permettant l’ouverture des canaux calciques lents, activés au cours de la phase 2.
Phase 2
Pendant la phase en plateau, il existe une entrée de calcium par les canaux calciques lents. Il s’agit donc d’un courant entrant dépolarisant, ICaL. Cette phase est fondamentale car elle permet l’entrée dans le cardiomyocyte des ions Ca2 + nécessaires au couplage excitation-contraction (voir chapitre 1, figure 1.11).
Phase 3
C’est la phase de repolarisation, sous la dépendance de plusieurs canaux potassiques et donc de plusieurs courants : IKur ; IKr et IKs. Ce sont tous des courants sortants potassiques repolarisants. La fin de la repolarisation est également sous la dépendance du courant potassique sortant IK1.
Phase 4
Durant cette phase, le potentiel de membrane est revenu au potentiel de repos et est stable car il n’y a plus de courant ionique transmembranaire (ou bien les courants entrants et les courants sortants s’équilibrent). En particulier, la pompe Na+/K+-ATPase, qui fait sortir trois ions Na+ contre l’entrée de deux ions K+ – mécanisme constitutif du gradient de concentration sodique et potassique – est ainsi responsable d’un courant sortant de charges positives, ce qui a un effet constamment polarisant.
Cas particulier du potentiel d’action des cellules nodales
Le potentiel d’action des cellules du nœud sinusal est différent de celui des cardiomyocytes (fig. 6.12) : la dépolarisation se fait plus lentement car elle est liée à l’activation des canaux calciques, plus lents que les canaux sodiques rapides de la phase 0 des cardiomyocytes ; le potentiel d’action est plus court et la cellule du nœud sinusal n’a pas de potentiel de repos. Il existe en effet un courant entrant de Na+ et de Ca2 +, le courant If, responsable d’une dépolarisation diastolique lente et ainsi responsable de l’automatisme de ces cellules. En effet, la présence de ce courant dépolarisant amène le potentiel d’action dans la zone d’activation des canaux calciques, ce qui crée le potentiel d’action. Lors de la fin de la phase de repolarisation, le courant If redevient majoritaire et conduit à la génération d’un nouveau potentiel d’action.
________________________________________________________________________________
Figure 6.12. Le potentiel d’action des cellules du nœud sinusal est différent de celui des autres cardiomyocytes.
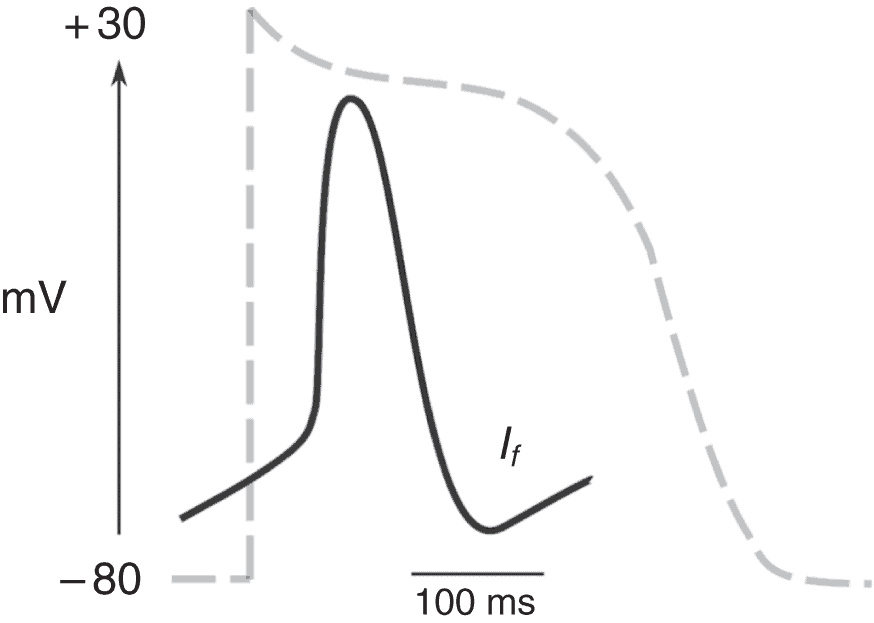
Il est plus court, la pente de dépolarisation (phase 0) est plus lente et il existe une pente de dépolarisation diastolique lente sous la dépendance du courant If.
________________________________________________________________________________
Physiopathologie des troubles du rythme
Les troubles du rythme cardiaque sont des variations inappropriées du rythme cardiaque mettant en jeu des mécanismes non physiologiques. On décrit plusieurs mécanismes d’arythmie.
Automatisme anormal
L’automatisme anormal survient quand le seuil d’activation des canaux sodiques ou la pente de dépolarisation diastolique varie. Il y a donc une genèse plus fréquente d’un potentiel d’action. L’hyperthyroïdie ou la fièvre sont deux situations pathologiques qui conduisent à une tachycardie sinusale par ce mécanisme. Cela s’observe dans certaines tachycardies atriales ou à la phase aiguë d’un infarctus du myocarde avec la survenue d’une tachycardie atriale.
Activités déclenchées
Post-dépolarisations précoces, ou EAD (early after-depolarizations)
Dans des conditions normales, les canaux sodiques s’ouvrent en phase 0 et s’inactivent rapidement. La cellule est alors en période réfractaire effective, c’est-à-dire qu’un stimulus n’est pas capable d’induire un nouveau potentiel d’action conduit. La période réfractaire effective laisse le temps aux canaux calciques lents de s’activer et ainsi de laisser rentrer le calcium dans la cellule (fig. 6.13).
________________________________________________________________________________
Figure 6.13. Période réfractaire.
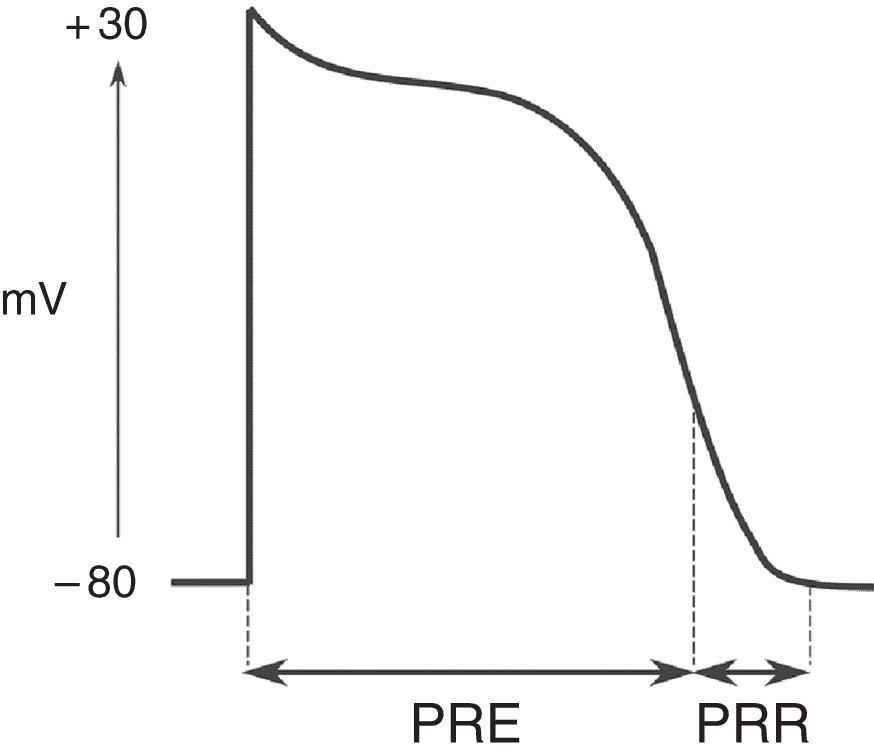
La période réfractaire effective (PRE) est la durée pendant laquelle un stimulus appliqué à la cellule ne peut pas, quelle que soit son intensité, déclencher un potentiel d’action conduit. La période réfractaire relative (PRR) est la durée pendant laquelle il est possible de générer un potentiel d’action pouvant être conduit, à condition d’appliquer un stimulus plus intense que lorsque la cellule est revenue à son potentiel de repos.
________________________________________________________________________________
Dans certaines conditions pathologiques, la repolarisation est insuffisamment rapide et se prolonge, ce qui permet à des courants entrants dépolarisants (essentiellement ICaL) de se réactiver permettant la génération d’un nouveau potentiel d’action. Ces EAD sont responsables de la survenue de torsades de pointes (fig. 6.14). Plusieurs mécanismes peuvent aboutir à ce phénomène :
- l’allongement du QT comme lors d’une bradycardie importante, l’hypokaliémie, l’hypomagnésémie ;
- la iatrogénie par médicaments diminuant l’activité des canaux potassiques repolarisants ;
- l’origine congénitale par canalopathie (perte de fonction des canaux potassiques ou gain de fonction des canaux sodiques par mutation du gène).
________________________________________________________________________________
Figure 6.14. Potentiel d’action myocardique.
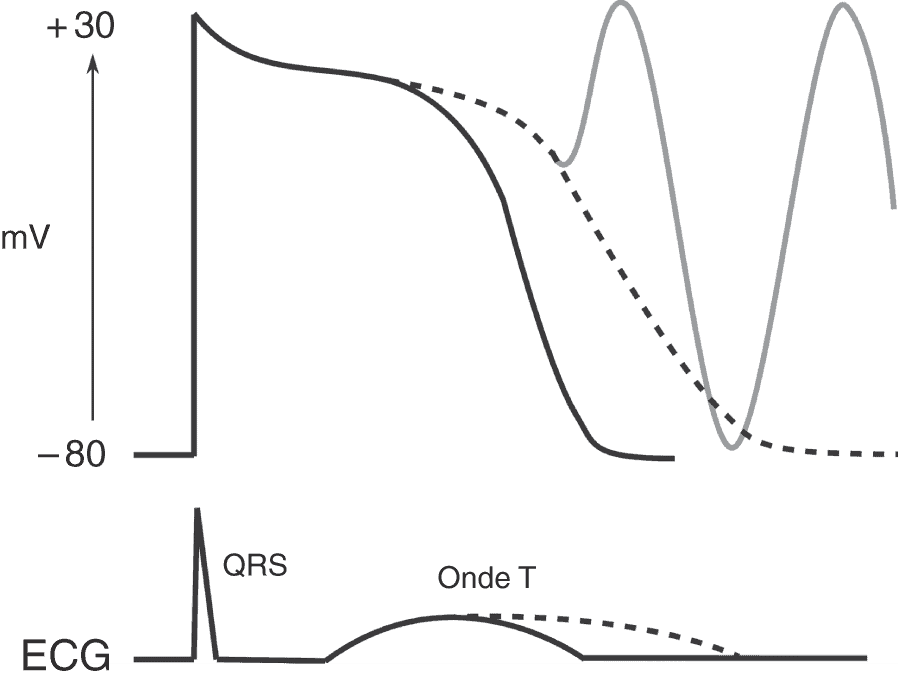
En trait plein, le potentiel d’action normal. En pointillé, un allongement pathologique du potentiel d’action avec en conséquence la survenue d’EAD.
________________________________________________________________________________
Post-dépolarisations tardives, ou DAD (delayed after-depolarizations)
Les DAD sont des arythmies se développant lors de la diastole, liées à l’expulsion du Ca2 + de la cellule. Lors de la phase 2, il existe une entrée de Ca2 + dans la cellule, nécessaire à la contraction myocardique. Il est important que ce Ca2 + puisse quitter le cytosol du cardiomyocyte en diastole. Pour cela, il existe deux mécanismes : le Ca2 + est d’une part pompé dans le réticulum sarcoplasmique (RS) par une Ca2 +-ATPase appelée SERCA pour être disponible lors de la systole suivante ; il (le Ca2 + qui est entré dans la cellule via ICaL) est, d’autre part, évacué de la cellule par l’échangeur Na+-Ca2 + (NCX) qui fait sortir de la cellule un ion Ca2 + contre l’entrée de trois ions Na+ (fig. 6.15). Le bilan électrique de l’échange est l’entrée d’une charge positive dans la cellule, donc un courant dépolarisant.
________________________________________________________________________________
Figure 6.15. L’échangeur Na+-Ca2 + permet la sortie des ions Ca2 + en diastole, mais cet échangeur est électrogène car il échange deux charges positives contre trois charges positives.

______________________________________________________________________________
Dans certaines situations pathologiques, comme l’insuffisance cardiaque, les mécanismes de recapture du Ca2 + dans le RS sont déficients et davantage de calcium doit être expulsé de la cellule en diastole par l’échangeur Na+-Ca2 +, ce d’autant qu’il existe également des fuites de Ca2 + hors du RS pendant la diastole. Le courant dépolarisant secondaire à l’activité de l’échangeur Na+-Ca2 + est important et peut aboutir à la génération d’un potentiel d’action prématuré et conduire ainsi à la survenue d’une arythmie (fig. 6.16).
________________________________________________________________________________
Figure 6.16. Le potentiel de membrane peut ne pas être stable en phase 4 et générer un potentiel d’action prématuré.
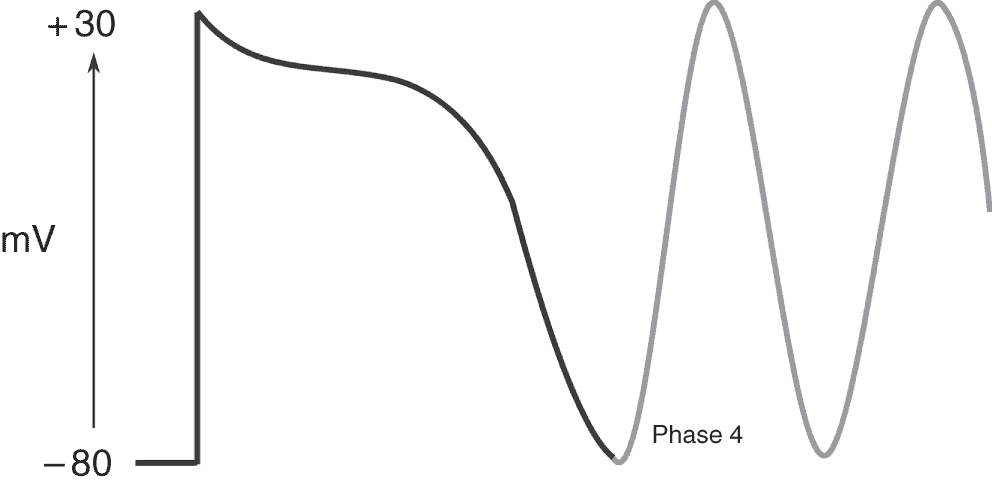
________________________________________________________________________________
Réentrée du front de dépolarisation
Il s’agit de l’excitation répétée du myocarde par circulation de l’impulsion électrique autour d’un obstacle. Il existe deux types de réentrée : la réentrée sur obstacle anatomique (comme en cas de flutter atrial, de réentrée intra-nodale ou empruntant une voie accessoire, et de réentrée autour d’une cicatrice d’infarctus) et la réentrée sans obstacle anatomique au sein même du potentiel d’action.
Réentrée sur obstacle anatomique
Le circuit de la réentrée comprend un obstacle anatomique autour duquel l’impulsion électrique peut tourner. On peut citer deux exemples :
- flutter atrial : l’influx électrique fait une boucle dans l’atrium droit. Pour fermer le circuit, il faut que le front de dépolarisation passe par l’isthme cavotricuspide (fig. 6.4). Il s’agit d’une bande relativement fine de myocarde où la conduction est plus lente. Lorsque l’influx électrique arrive dans l’isthme cavotricuspide, la conduction se fait plus lentement. Pendant que le courant traverse l’isthme cavotricuspide de proche en proche, le reste du myocarde atrial a le temps de sortir de sa période réfractaire. Lorsque le front de dépolarisation sort de l’isthme cavotricuspide, il peut rapidement dépolariser l’atrium jusqu’à l’autre extrémité de l’isthme cavotricuspide. L’influx électrique va pouvoir à nouveau emprunter cette voie, pérennisant ainsi l’arythmie ;
- réentrée intra-nodale : chez 30 % de la population, le nœud atrioventriculaire présente deux voies d’entrées : une voie lente et une voie rapide. Ces deux voies ont des propriétés électrophysiologiques très différentes :
- la voie rapide est la voie classique, que le front de dépolarisation en provenance de l’atrium emprunte pour rejoindre le ventricule. Cette voie est capable de conduire rapidement l’influx électrique, mais sa période réfractaire est longue. Entre deux dépolarisations de l’atrium, cette voie a le temps de sortir de sa période réfractaire et dans des conditions physiologiques, c’est par cette voie que passe la totalité des dépolarisations en provenance de l’atrium ;
- la voie lente possède une période réfractaire beaucoup plus courte que la voie rapide.
Dans des conditions physiologiques (fig. 6.17A), l’influx en provenance des atriums arrive dans les deux voies de manière simultanée et chemine dans la voie lente et dans la voie rapide en même temps. C’est par cette voie que l’influx électrique sort en premier pour atteindre la partie inférieure du nœud atrioventriculaire puis le His pour ensuite dépolariser le ventricule. Il remonte également dans la voie lente de manière rétrograde et rencontre l’influx arrivant lentement dans l’autre sens, formant ainsi un front de collision. Lorsque survient une extrasystole atriale (fig. 6.17B), il est possible que la voie rapide soit encore en période réfractaire. La voie lente a une période réfractaire plus courte et elle peut conduire l’influx électrique. Quand le front de dépolarisation arrive à la fin de la voie lente, il dépolarise le ventricule mais aussi de manière rétrograde la voie rapide qui, entre-temps, a eu le temps de ressortir de sa période réfractaire (fig. 6.17C). À la fin de la conduction rétrograde dans la voie rapide, l’atrium est dépolarisé de manière rétrograde, créant une onde P’ sur l’ECG, mais l’influx peut redescendre dans la voie lente et l’arythmie se poursuit (fig. 6.17D).
________________________________________________________________________________
Figure 6.17. La réentrée intra-nodale est un circuit de réentrée localisé au niveau du nœud atrioventriculaire.

Il existe deux voies d’entrée au nœud atrioventriculaire : une voie à conduction lente mais période réfractaire courte et une voie à conduction plus rapide mais période réfractaire longue. La survenue d’une extrasystole supraventriculaire (ESA) lors de la période réfractaire de la voie rapide oblige l’influx à descendre par la voie lente, puis à remonter par la voie rapide. À chaque tour, le ventricule est dépolarisé.
________________________________________________________________________________
Réentrée de phase 2
Par réentrée sans obstacle anatomique, on désigne une réentrée ayant lieu au sein du myocarde, sans obstacle anatomique réel. Elle survient lorsqu’il existe une hétérogénéité de repolarisation entre des cellules myocardiques adjacentes.
Prenons l’exemple d’une ischémie myocardique. L’ischémie modifie la forme du potentiel d’action local car il existe des canaux potassiques sensibles à l’ATP. Il peut donc se passer une réentrée entre des cellules proches : les cellules sorties de leur période réfractaire peuvent se faire dépolariser par les cellules voisines, encore en cours de repolarisation.
On classe également dans les réentrées de phase 2 les troubles du rythme secondaires à une hétérogénéité de repolarisation entre les couches myocardiques. On sait que la répartition des canaux est différente entre les myocytes sous-épicardiques, du milieu du myocarde et sous-endocardiques. Lors de certains processus pathologiques notamment génétiques, comme dans le syndrome de Brugada, ces différences de repolarisation entre les couches sont accentuées et il se produit des réentrées entre les différentes couches par hétérogénéité de repolarisation.
Sémiologie
Syncope et lipothymie
Définitions
Syncope
La syncope est une perte de connaissance complète, brutale, sans prodromes, transitoire, accompagnée d’une chute du tonus postural avec récupération spontanée, due à une hypoperfusion cérébrale généralisée et transitoire. La syncope d’Adams-Stokes est une syncope compliquant les blocs sinuatriaux et les blocs atrioventriculaires de haut degré mais également les troubles du rythme ventriculaire rapides, appelée également syncope à l’emporte-pièce, de début brutal et de fin brutale, non précédée de prodromes et sans confusion postcritique.
Lipothymie
La lipothymie ( near syncope des Anglo-Saxons) est un malaise passager caractérisé par une impression de malaise imminent. Ce « malaise » est souvent une forme mineure de syncope ou un état préalable qui peut laisser au sujet le temps de s’asseoir ou de s’allonger. Bien qu’apparemment moins grave, la lipothymie a la même valeur sémiologique que la syncope. Ces symptômes sont un motif de consultation fréquent aux urgences et peuvent témoigner de pathologies de gravité variable : l’excellent pronostic des syncopes vasovagales tranche avec la gravité des troubles du rythme ventriculaire, tout particulièrement en cas de cardiopathie sous-jacente.
Enjeu
L’enjeu devant une syncope est double et repose sur l’évaluation de la gravité potentielle de la situation (fondée sur l’interrogatoire, l’examen clinique et des examens simples disponibles facilement) et le bilan étiologique. L’évaluation de la gravité potentielle consiste en la stratification du risque de l’épisode, qui est une étape fondamentale tant sur le plan diagnostique qu’en ce qui concerne la surveillance et la rapidité du bilan. On s’attachera tout particulièrement à rechercher : une cardiopathie sous-jacente, des douleurs thoraciques, des anomalies à l’ECG (séquelle d’infarctus, cardiomyopathie hypertrophique, canalopathies congénitales, etc.), des syncopes itératives. La recherche de l’étiologie (cf. infra) fera appel aussi bien à l’examen clinique qu’aux examens complémentaires et devra essayer d’éliminer tout ce qui n’est pas une syncope d’origine cardiaque…
Interrogatoire
L’interrogatoire doit être « policier ». On fera préciser tout particulièrement :
- les symptômes et circonstances de leur apparition avant l’épisode (signes cardiaques, neurologiques, neurovégétatifs) ;
- les caractéristiques de la perte de connaissance (survenue au repos ou à l’effort) ;
- l’existence de symptômes immédiatement après la reprise de connaissance ;
- les antécédents médicaux (notamment les antécédents de syncope et leur traitement) ;
- le terrain (existence d’une cardiopathie) ;
- les antécédents familiaux cardiaques et de mort subite (canalopathie congénitale, cardiomyopathie hypertrophique).
Examen clinique
L’examen clinique consistera en :
- la recherche d’une cardiopathie : signes d’insuffisance cardiaque, anomalie à l’auscultation cardiaque comme un souffle de rétrécissement aortique en cas de syncope survenue à l’effort ;
- la recherche d’une hypotension orthostatique : cette recherche se fait en mesurant la PA et le pouls au repos puis, après un lever rapide (à 1, 3 et 5 minutes). Le diagnostic est positif si la PA systolique chute de plus de 20 mmHg dans les 5 minutes suivant le lever, reproduisant les symptômes ;
- la réalisation d’un massage sinocarotidien à la recherche d’une hypersensibilité sinocarotidienne de chaque côté, après auscultation des carotides afin d’éviter le massage en regard d’une plaque athéromateuse sténosante et soufflante. Il est réalisé sous contrôle ECG. Une hypersensibilité sinocarotidienne est diagnostiquée lorsque le massage induit une pause > 3 secondes ;
- la réalisation d’un examen neurologique complet ;
- la recherche de conséquences traumatiques de la chute.
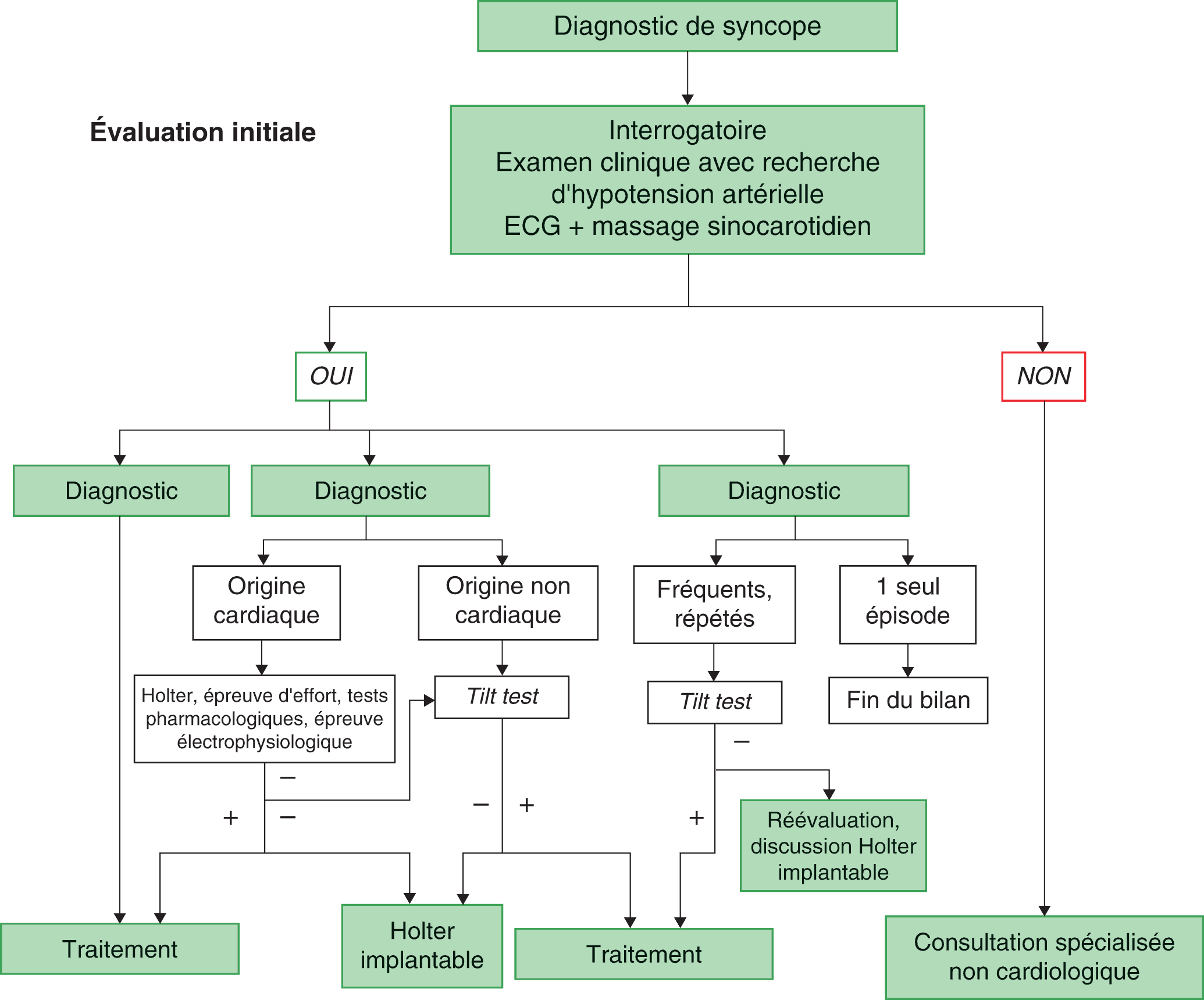
Examens complémentaires usuels (fig. 6.18)
Bilan minimum
Les examens complémentaires devront absolument comprendre dans un premier temps (avec massage sinocarotidien) :
- un ECG, qui reste un examen incontournable, avec 12 dérivations et avec obligatoirement une dérivation longue (idéalement D2) :
- il permettra l’analyse complète du rythme cardiaque : présence ou non d’une onde P sinusale, mesure de l’espace PR, de la durée du QRS, du QT, calcul de l’axe du cœur, présence de complexes anormaux (ESA, ESV) ;
- il peut mettre directement en évidence la cause de la syncope : troubles conductifs de haut degré (bloc sinu-artial ou bloc atrioventriculaire de type Mobitz II ou du 3e degré), présence d’association de troubles conductifs, allongement du PR, association d’un bloc de branche droit et d’une déviation axiale gauche, survenue d’une tachycardie ventriculaire ; dysfonctionnement de stimulateur cardiaque avec défaut de capture ;
- sinon, il permet de rechercher des anomalies indirectes hautement suspectes : des troubles conductifs isolés (bloc atrioventriculaire, bloc de branche, déviation axiale), des extrasystoles surtout ventriculaires, un allongement du QT excessif, autant d’arguments en faveur d’une origine cardiaque à la syncope ;
- une échocardiographie avec Doppler, à la recherche d’une cardiopathie sous-jacente associée ou non aux anomalies rythmiques ou conductives détectées sur l’ECG : elle permettra de mettre en évidence une anomalie de la structure du cœur (cardiomyopathie dilatée, hypertrophique, obstructive, trouble segmentaire de la cinétique) ou de son aspect (aspect brillant évoquant une amylose cardiaque), une anomalie des valves notamment aortique (rétrécissement) ; une analyse de la partie droite du cœur (à la recherche d’une cardiomyopathie arythmogène ou DAVD) est également indispensable.
________________________________________________________________________________
Figure 6.18. Syncope : orientation des examens complémentaires en fonction du diagnostic certain, suspect, inexpliqué ou si ce n’est pas une syncope.
________________________________________________________________________________
Autres examens complémentaires (effectués en cas de négativité des précédents)
Suite à ce bilan obligatoire et minimum, en l’absence de diagnostic évident et compatible avec la sémiologie de la syncope, seront réalisés un Holter rythmique des 24 heures, une épreuve d’effort, un tilt test (test d’inclinaison), des tests pharmacologiques, voire une épreuve électrophysiologique qui est l’examen complémentaire le plus invasif. Enfin, en cas de bilan négatif complet, une décision d’implantation d’un Holter de longue durée (> 72 h, moniteur cardiaque implantable) peut se justifier en cas de syncopes répétées.
Le Holter rythmique des 24 heures permet un enregistrement sur deux voire trois dérivations du rythme cardiaque. C’est un examen qui sera réalisé en cas de suspicion d’un trouble électrique paroxystique non retrouvé sur l’ECG, ou à haut risque de récidive en raison de troubles conductifs associés sur l’ECG (allongement du PR, bloc de branche + déviation axiale).
L’épreuve d’effort sera réalisée en cas de syncope survenant à l’effort et pourrait mettre en évidence un bloc de haut degré n’apparaissant qu’à l’effort ou un trouble du rythme ventriculaire.
Le tilt test, ou test d’inclinaison, est proposé en cas de forte suspicion de syncope vagale. Il ne sera proposé qu’après avoir réalisé les précédents examens et consiste à mettre en évidence lors du passage de la position allongée à l’orthostatisme soit une chute de pression artérielle, soit une chute de la fréquence cardiaque, soit les deux associés.
Les tests pharmacologiques, d’utilisation récente, ne sont réalisés qu’en cas de syncope inexpliquée survenant surtout au repos (test à l’ajmaline ou à la flécaïnide), mais aussi plus rarement à l’effort (test à l’isoproprénaline) chez des sujets jeunes notamment, s’il existe des antécédents familiaux de mort subite ou de syncope inexpliquée. Ces tests permettent de rechercher des arguments pour une maladie familiale survenant sur cœur sain et touchant les canaux ioniques (canalopathies).
L’épreuve électrophysiologique peut se justifier au terme des investigations précédentes en cas de syncope suspecte alors que le bilan non invasif précédent est négatif. Elle consiste en l’analyse de l’activité électrique à l’intérieur du cœur entre le nœud sinu-artial et le nœud atrioventriculaire et entre ce dernier et le faisceau de His, afin de mettre en évidence des temps de conduction électrique allongés.
Cet examen peut s’associer à une stimulation ventriculaire programmée droite ayant pour but de tenter de déclencher un trouble du rythme ventriculaire. Cet examen est réalisé sous anesthésie locale avec des sondes introduites via un abord fémoral droit qui permet un accès direct au cœur via la veine cave inférieure. Cet examen ne sera réalisé qu’en cas de troubles conductifs présents sur l’ECG (allongement de l’intervalle PR, bloc de branche complet avec ou sans déviation axiale associée), notamment en cas d’association de ces anomalies conductives.
La stimulation ventriculaire programmée gauche sera réalisée uniquement s’il est retrouvé une anomalie segmentaire du ventricule gauche séquellaire d’un infarctus du myocarde ou en cas d’atteinte du ventricule droit.
Orientation diagnostique
Elle se fera en fonction de l’interrogatoire, de l’examen clinique, de l’ECG et des autres examens complémentaires réalisés en fonction du contexte clinique (tableau 6.2) :
- une syncope réflexe : syncope vasovagale ou par hyperréflectivité sinocarotidienne : instabilité vasomotrice et réduction brutale des résistances vasculaires périphériques ;
- une hypotension orthostatique ;
- une obstruction mécanique à l’éjection aortique (le rétrécissement aortique ou la cardiomyopathie hypertrophique obstructive entraînant une syncope à l’effort) ;
- une réduction du débit cardiaque en rapport avec une inefficacité de la pompe cardiaque d’origine rythmique par un mécanisme de :
- tachycardie, en particulier tachycardie ventriculaire ;
- ou bradycardie (troubles conductifs de haut degré).
Tableau 6.2. Orientation diagnostique en fonction des symptômes.
| Symptômes | Diagnostic probable |
| – Après une douleur soudaine, un repas ou une émotion intense
– Ambiance surchauffée – Apparition progressive, présence de prodromes (nausées, sueurs, « malaise général ») – Retour progressif à la normale, possibles vomissements et asthénie intense |
– Syncope vasovagale |
| – Pendant ou immédiatement après une miction, une toux, une défécation, une déglutition, une névralgie | – Syncope situationnelle |
| – Au moment du lever
– Prise de médicaments antihypertenseurs – Recherche d’hypotension orthostatique positive |
– Hypotension artérielle orthostatique |
| – Pendant un effort | – Rétrécissement aortique
– Cardiomyopathie hypertrophique obstructive – Embolie pulmonaire – Hypertension artérielle pulmonaire – Rétrécissement mitral |
| – Mouvement de la tête (rasage, col serré, compression sinus carotidiens)
– Massage sinocarotidien pathologique |
– Hypersensibilité sinocarotidienne |
| – Syncope vraie, sans prodromes
– Pas de signes post-critiques – Cardiopathie sous-jacente – Anomalies à l’ECG (troubles conductifs, extrasystoles ventriculaires) |
– Évoque une syncope d’origine cardiaque, par troubles conductifs de haut degré ou troubles du rythme ventriculaire |
Palpitations
Définition
Il s’agit d’une perception anormale des battements cardiaques qui, physiologiquement, ne sont pas perçus.
Enjeu
Il existe deux étapes dans la réflexion diagnostique : l’évaluation de la gravité (mauvaise tolérance des palpitations, syncopes, cardiopathie sous-jacente) permettant de stratifier le risque des patients et le degré d’urgence avec lequel un bilan doit être réalisé ; la recherche étiologique (certains épisodes de palpitations présentent des caractéristiques sémiologiques très évocatrices, ECG). L’ECG per-critique permet de poser le diagnostic.
Interrogatoire
L’interrogatoire recherchera en particulier :
- une cardiopathie sous-jacente ;
- des antécédents familiaux de mort subite ;
- des signes de mauvaise tolérance : syncope, lipothymie, dyspnée… ;
- le contexte de survenue (stress, à l’effort) ;
- le type de palpitations : description des modalités de début et de fin (brutal/progressif, facteur déclenchant), régulières/irrégulières.
Plusieurs types de palpitations correspondant à plusieurs troubles du rythme peuvent être cliniquement décrits :
- les extrasystoles : en général, ce n’est pas le battement extrasystolique qui est ressenti mais le repos compensateur qui lui fait suite et le battement suivant. Les patients rapportent alors une sensation de « raté » ou d’« arrêt du cœur », suivi d’un battement « fort ». Il existe deux types d’extrasystoles : atriale et ventriculaire (tableau 6.3). L’extrasystole atriale (ESA) est caractérisée par une onde P précoce (arrivant plus tôt que prévu), ayant une morphologie, une amplitude voire une polarité différente des ondes P sinusales, et qui est soit bloquée soit suivie d’un QRS, fin ou large (en cas de bloc de branche fonctionnel) (fig. 6.19A). Une extrasystole ventriculaire est un complexe QRS large non précédé d’une onde P et qui arrive précocement après un complexe P-QRS-T normal (fig. 6.19B). Ces extrasystoles peuvent être isolées, en doublets (fig. 6.19C), triplets ou en salves. Elles peuvent être observées une fois sur deux en alternance avec un complexe P-QRS-T normal et on parlera d’extrasystole bigéminée, ou une fois sur tous les deux complexes normaux et on parlera d’extrasystole trigéminée ;
________________________________________________________________________________
Figure 6.19. Extrasystoles.

A. Extrasystole atriale : l’onde P’ arrive précocement après le complexe P-QRS-T (flèche) précédent et est accompagnée d’un QRS fin. B. Extrasystole ventriculaire : large, non précédée d’une onde P (flèche). C. Doublet d’extrasystoles ventriculaires à couplage précoce avec phénomène R/T (l’extrasystole débute dans l’onde T).
________________________________________________________________________________
- les palpitations de la « maladie » de Bouveret : ces crises ont été décrites avant la découverte de l’électrocardiogramme. La tachycardie de Bouveret est donc plus un symptôme qu’une maladie. Ces épisodes de palpitations correspondent le plus souvent à des tachycardies jonctionnelles. Les éléments d’orientation les plus forts sont : début et fin brutales, habituellement rapides et régulières, âge de début souvent jeune, absence de cardiopathie, arrêt sous l’effet de manœuvres vagales ;
- les palpitations correspondant à la fibrillation atriale : le caractère irrégulier des palpitations est très évocateur – autres diagnostics possibles devant une tachycardie irrégulière : extrasystoles sur un fond de rythme sinusal ou autres troubles du rythme atriaux avec conduction variable (flutter ou tachycardie atriale) ;
- les palpitations correspondant à des troubles du rythme ventriculaire, qui sont régulières et qui s’observent généralement chez les personnes âgées et en présence d’une cardiopathie sous-jacente.
Tableau 6.3. Différentes caractéristiques ECG des extrasystoles atriales et ventriculaires.
| Extrasystole atriale | Extrasystole ventriculaire | |
| Présence d’une onde P précédent le QRS | Oui | Non |
| Largeur du QRS | Fin ou large en cas de bloc de branche | Large |
| Couplage | Précoce (phénomène P/T) ou tardif | Précoce (phénomène R/T) ou tardif |
| Morphologie | Monomorphe ou polymorphe | Monomorphe ou polymorphe |
| Phénomène répétitif | Isolée, en doublet, triplet… en salve | Isolée, en doublet, triplet… en salve |
| Fréquence | Isolée, bigéminée, trigéminée… | Isolée, bigéminée, trigéminée… |
Examen clinique
Il consistera en la prise du pouls au moment de la crise (régulier/irrégulier, fréquence cardiaque) et en un examen cardiologique standard, à la recherche d’une cardiopathie sous-jacente (avec signes d’insuffisance cardiaque).
Examens complémentaires
Ils comporteront idéalement :
- un ECG per-critique ;
- sinon, à défaut, un ECG intercritique : recherche de signes électriques en faveur d’une cardiopathie sous-jacente (bloc de branche gauche, ondes Q de nécrose), extrasystoles (atriales ou ventriculaires, évocatrices de l’origine des palpitations) ;
- Holter-ECG rythmique : enregistrement du rythme cardiaque pendant 24 heures, parfois plus longtemps ;
- parfois une épreuve d’effort si les manifestations surviennent à l’effort.
Orientation diagnostique
L’orientation diagnostique se fera en fonction des éléments recueillis vers trois types de tachycardie, située à l’étage atrial, jonctionnel ou ventriculaire (tableau 6.4) :
- un trouble du rythme atrial (cf. infra) : fibrillation atriale, flutter, tachycardie atriale.
- une tachycardie jonctionnelle (rythmes réciproques, cf. supra Physiopathologie) :
-
- ces tachycardies sont le plus souvent bénignes et il en existe deux types : la réentrée intra-nodale et la tachycardie empruntant une voie accessoire rétrograde (faisceau de Kent) appelée la tachycardie orthodromique,
- ces deux tachycardies sont représentées sur l’ECG par une tachycardie à QRS fins, régulière, rapide (entre 160 et 220 battements par minute) sans ondes P visibles pour la première et avec une onde P visible pour la seconde qui a la particularité d’être négative en DII, DIII, aVF (fig. 6.20 et 6.21),
________________________________________________________________________________
Figure 6.20. Réentrée intra-nodale.
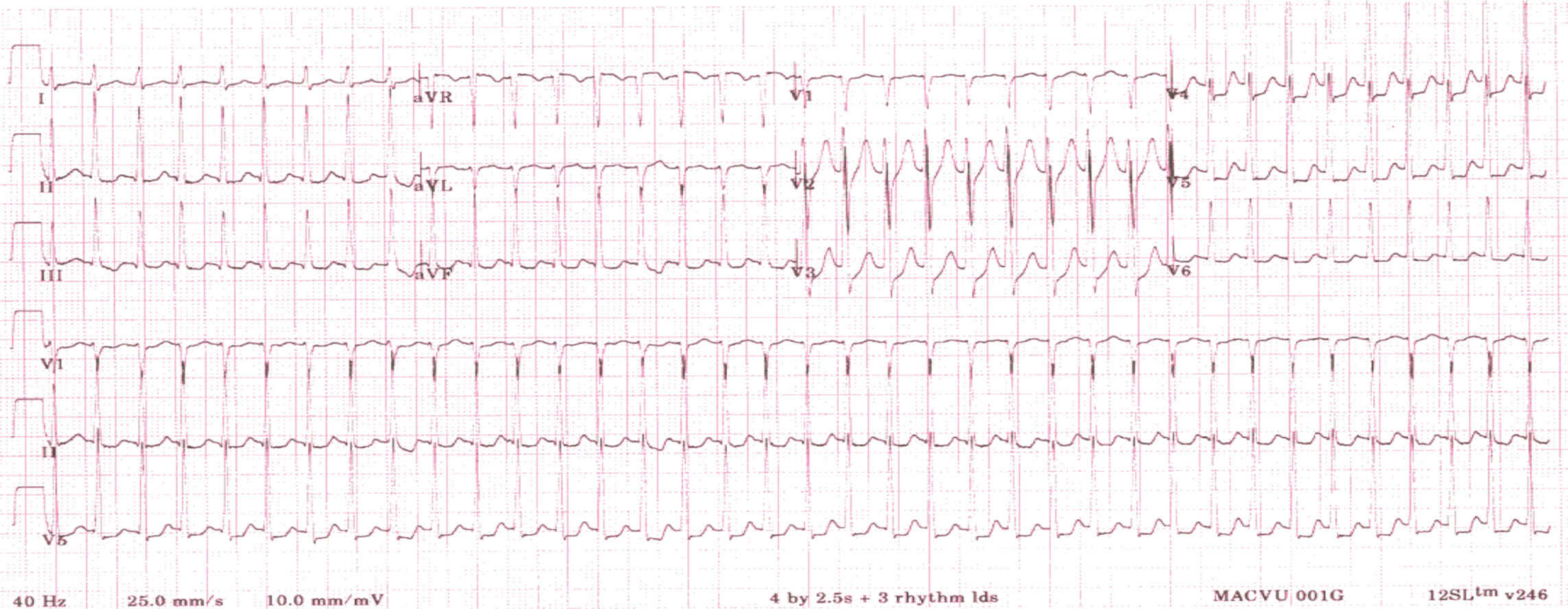
Tachycardie régulière à QRS fins sans ondes P visibles.
________________________________________________________________________________
Figure 6.21. Tachycardie orthodromique.
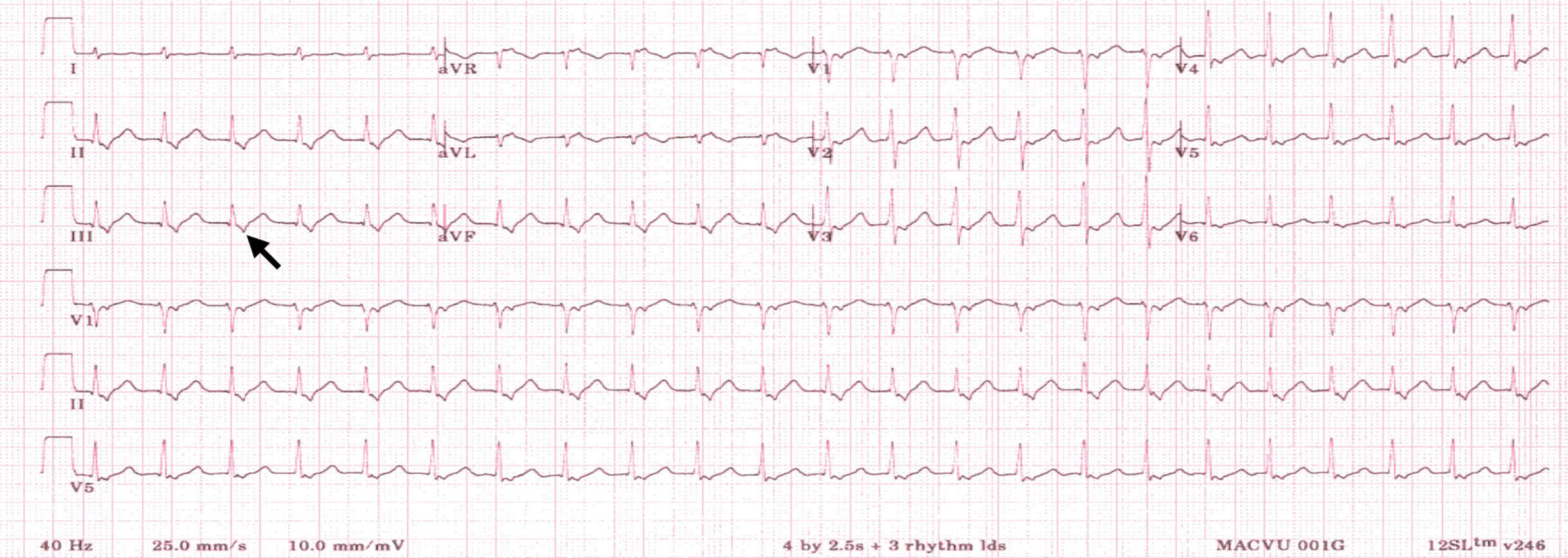
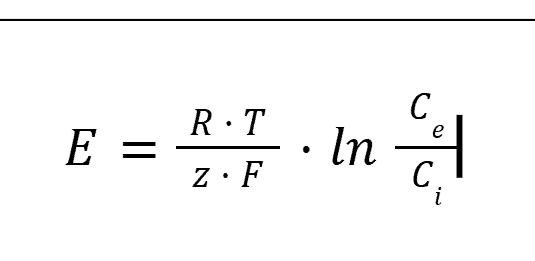
Tachycardie régulière à QRS fins avec ondes P’ rétrograde à la fin du QRS (flèche).
________________________________________________________________________________
-
- en cas de tachycardie survenant sur une voie accessoire rétrograde (tachycardie orthodromique), lorsque cette voie accessoire en dehors des crises de tachycardie en rythme sinusal est également fonctionnelle en antérograde, on observe un ECG typique avec un espace PR court, une onde delta et un QRS élargi. Cette anomalie ECG s’appelle un syndrome de Wolff-Parkinson-White ou syndrome de pré-excitation (fig. 6.22). Lorsque la tachycardie tourne dans le sens inverse en empruntant la voie accessoire en antérograde (ce qui est rare), on parle de tachycardie antidromique ;
________________________________________________________________________________
Figure 6.22. Syndrome de Wolff-Parkinson-White.
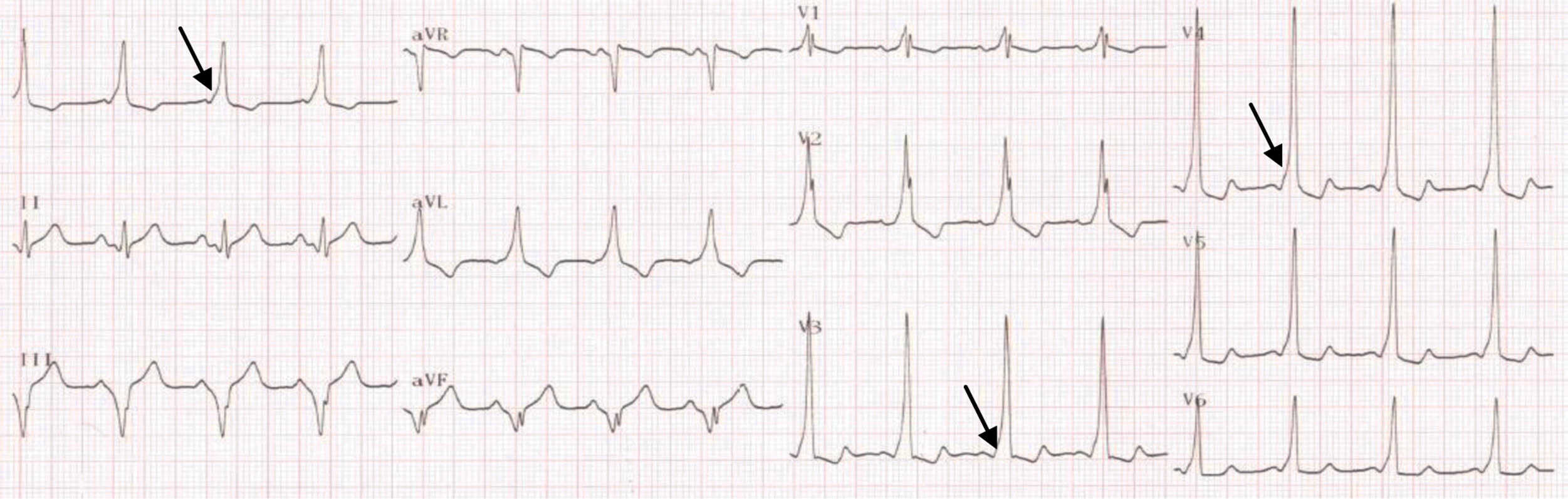
Aspect typique de PR court avec onde delta (flèche) correspondant à l’existence d’une pré-excitation antérograde empruntant un faisceau de Kent.
________________________________________________________________________________
- un trouble du rythme ventriculaire (tachycardie ventriculaire, torsades de pointes, fibrillation ventriculaire) :
-
- ces troubles surviennent généralement sur cœur pathologique et peuvent être de mauvais pronostic (en cas de cardiopathie sous-jacente, la tachycardie est généralement moins bien tolérée que les troubles du rythme supraventriculaire),
- pour la tachycardie ventriculaire, il s’agit d’une tachycardie à complexes larges (car elle naît en aval de la bifurcation du faisceau de His), tachycardie régulière, avec trois signes ECG typiques : la dissociation atrioventriculaire (plus de QRS que d’ondes P) et les complexes de capture et de fusion (fig. 6.23). Elle est généralement monomorphe, mais peut être polymorphe,
________________________________________________________________________________
Figure 6.23. Tachycardie ventriculaire.
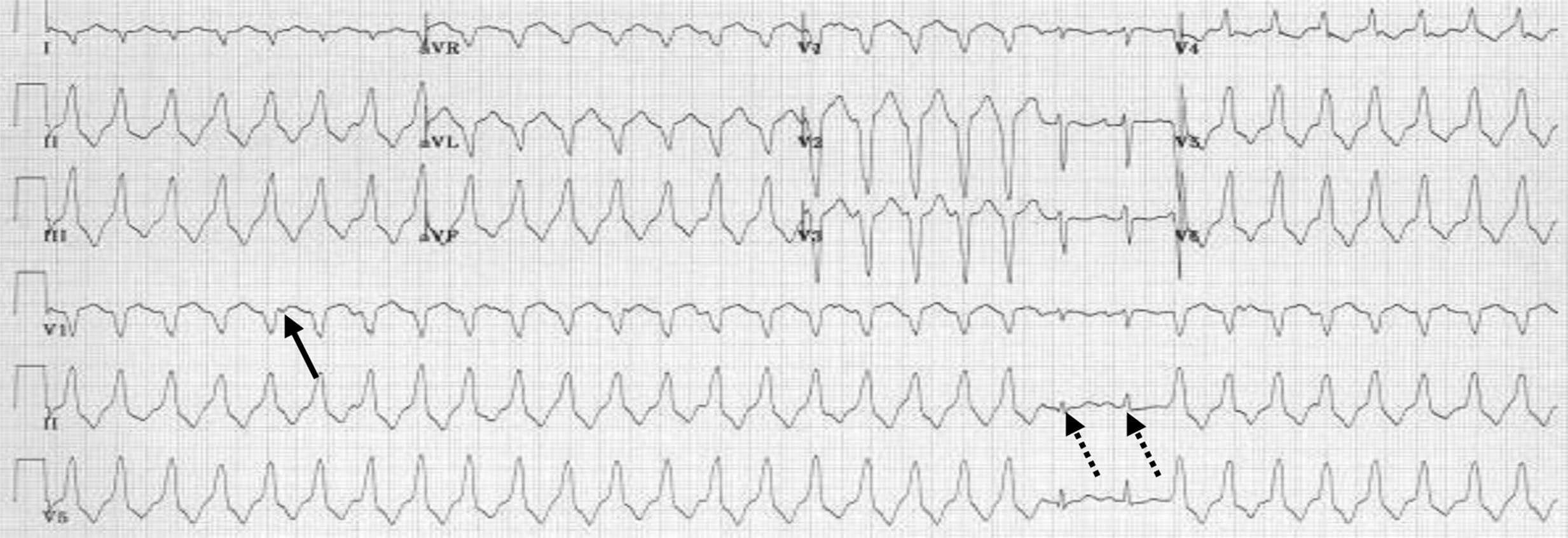
Tachycardie régulière à QRS large monomorphe avec dissociation atrioventriculaire (flèche) et complexes de capture-fusion (flèche en pointillé).
________________________________________________________________________________
-
- les torsades de pointes sont une tachycardie irrégulière à QRS de largeur variable (polymorphe) et, surtout, ayant une polarité qui varie régulièrement en fonction du temps et qui tourne autour de la ligne isoélectrique. Cette dernière est observée en cas d’allongement de l’espace QT soit iatrogène soit congénital (fig. 6.24),
________________________________________________________________________________
Figure 6.24. Torsades de pointes.
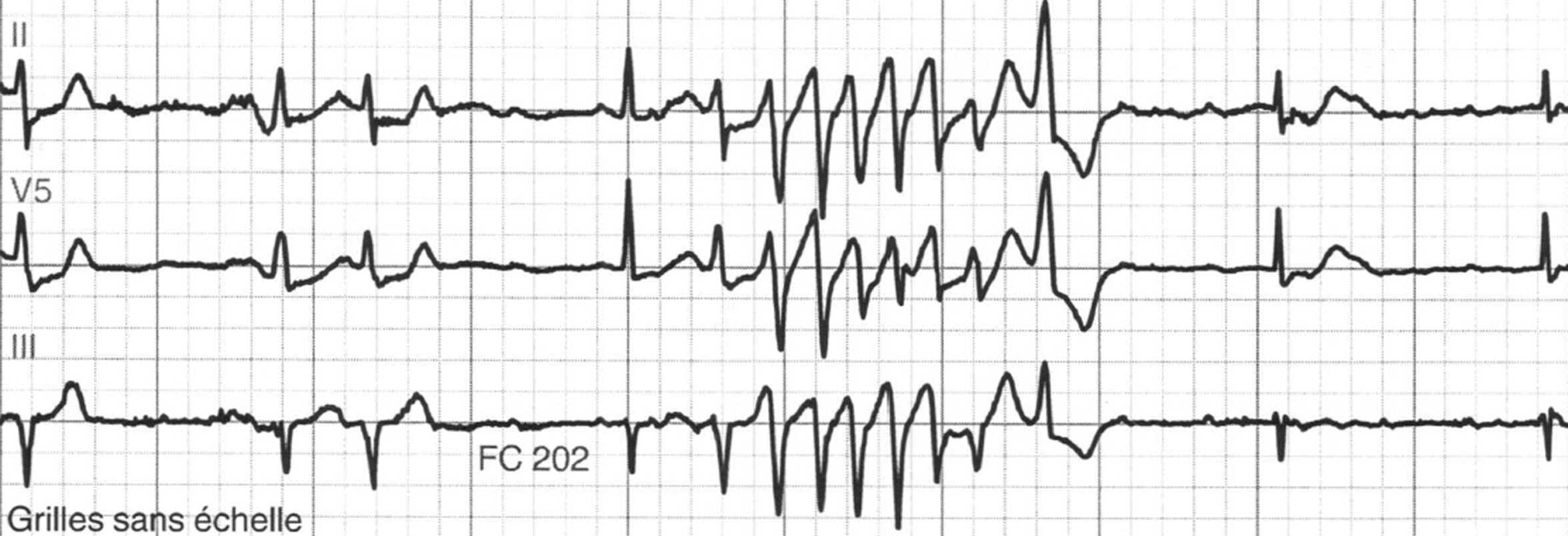
Tachycardie irrégulière à QRS de largeur variable (polymorphe) et surtout ayant une polarité qui varie régulièrement en fonction du temps et qui tourne autour de la ligne isoélectrique.
________________________________________________________________________________
-
- enfin, la fibrillation ventriculaire est soit présente d’emblée soit est secondaire à la transformation des deux premières tachycardies. Sur l’ECG sont observés des complexes QRS rapides, anarchiques et irréguliers, sans ondes P visibles et de faible amplitude. Elle s’observe généralement chez des patients présentant une cardiomyopathie sous-jacente.
Tableau 6.4. Différentes causes de tachycardie pouvant provoquer des palpitations.
| Localisation | Types |
| Étage atrial | Extrasystoles atriales en salves |
| Fibrillation atriale | |
| Flutter atrial | |
| Tachycardie (tachysystolie) atriale | |
| Étage jonctionnel | Réentrée intra-nodale |
| Tachycardie orthodromique ou antidromique (empruntant une voie accessoire) | |
| Étage ventriculaire | Extrasystoles ventriculaires en salves |
| Tachycardie ventriculaire | |
| Torsades de pointes | |
| Fibrillation ventriculaire (généralement la sensation de palpitations est peu probable car provoque d’emblée une syncope, sauf en cas de tachycardie ventriculaire préalable) |
Il peut également exister des causes non cardiaques de palpitations, qui sont généralement d’origine fonctionnelle : leur survenue sur un terrain anxieux, la prise d’excitant et le fait que les palpitations décrites n’évoquent pas un tableau spécifique peut faire évoquer ce diagnostic après élimination des autres causes. Le patient se plaint souvent de battements « forts » plutôt que de tachycardie. Généralement le bilan est normal, notamment le Holter-ECG – où on peut, en revanche, fréquemment retrouver des épisodes de tachycardie sinusale peu rapides (environ de 100 à 120/min).
Électrocardiogramme normal et anormal
L’ECG est l’enregistrement de l’activité électrique du cœur en fonction du temps. Il se fait sur un papier millimétré, déroulant à vitesse constante. Le papier millimétré est composé de carrés de 5 mm × 5 mm. Ces carrés sont subdivisés en carrés plus petits d’1 mm de côté. Dans les conditions standard, le papier est déroulé à la vitesse de 25 mm à la seconde, de sorte que 1 mm corresponde à 0,04 seconde et 5 mm à 0,20 seconde. L’étalonnage standard de l’ECG enregistre en ordonnées une déflexion de 10 mm pour un voltage de 1 mV. Un étalonnage correct est indispensable à l’interprétation des tracés. Le patient doit être couché sur le dos, en relaxation musculaire complète, dans une position confortable. Quatre électrodes sont placées sur les membres, à la face interne des avant-bras et à la face externe des jambes. Elles peuvent également être placées à la racine des membres (dérivations frontales ou périphériques). Habituellement, six électrodes sont placées sur le thorax et enregistrent les dérivations dites précordiales (fig. 6.25).
________________________________________________________________________________
Figure 6.25. Positionnement des neuf dérivations précordiales gauches et droites (à gauche) et des trois dérivations postérieures gauches (à droite).

________________________________________________________________________________
L’analyse de l’ECG doit être méthodique (tableau 6.5). Elle comporte l’étude :
- des conditions d’enregistrement (calibration, vitesse de déroulement, inversion d’électrodes) ;
- du rythme (sinusal ou non) et de sa fréquence ;
- de la dépolarisation atriale (onde P : durée et amplitude) ;
- de la conduction atrioventriculaire (durée de l’intervalle PR) ;
- de la dépolarisation ventriculaire (complexe QRS) ;
- de la repolarisation ventriculaire (segment ST).
________________________________________________________________________________
Il existe six dérivations frontales à partir de quatre électrodes placées sur les membres :
- DI : mesure bipolaire entre bras droit et bras gauche ;
- DII : mesure bipolaire entre bras droit et jambe gauche ;
- DIII : mesure bipolaire entre bras gauche et jambe gauche ;
- aVR : mesure unipolaire sur le bras droit ;
- aVL : mesure unipolaire sur le bras gauche ;
- aVF : mesure unipolaire sur la jambe gauche.
DI, DII, et DIII décrivent le triangle d’Einthoven.
Il existe aussi six dérivations précordiales :
- V1 : quatrième espace intercostal droit, bord droit du sternum (parasternal) ;
- V2 : quatrième espace intercostal gauche, bord gauche du sternum (parasternal) ;
- V3 : à mi-chemin entre V2 et V4 ;
- V4 : cinquième espace intercostal gauche, sur la ligne médioclaviculaire ;
- V5 : même horizontale que V4, ligne axillaire antérieure ;
- V6 : même horizontale que V4, ligne axillaire moyenne.
Par ailleurs, il existe aussi d’autres dérivations. Elles sont faites dans certains cas pour affiner, par exemple, le diagnostic topographique d’un syndrome coronaire aigu :
- V7 : même horizontale que V4, ligne axillaire postérieure ;
- V8 : même horizontale que V4, sous la pointe de la scapula ;
- V9 : même horizontale que V4, à mi-distance entre V8 et les épineuses postérieures ;
- V3R : symétrique de V3 par rapport à la ligne médiane ;
- V4R : symétrique de V4 par rapport à la ligne médiane ;
- VE : au niveau de la xiphoïde.
________________________________________________________________________________
Tableau 6.5. Valeurs normales pour les différents composants de l’ECG.
| Composants | Valeurs normales | Diagnostic si anormal |
| Onde P | Durée ≤ 120 ms | Si > 120 ms : hypertrophie atriale gauche |
| Amplitude ≤ 2,5 mm | Si > 2,5 mm : hypertrophie atriale droite | |
| Espace PR | Durée ≤ 200 ms | Si > 200 ms : bloc atrioventriculaire du 1er degré |
| Complexe QRS | Durée ≤ 80 ms | Si entre 80 et 120 ms : bloc de branche incomplet |
| Si > 120 ms : bloc de branche complet | ||
| Amplitude ≤ 35 mm (S en V1 + R en V5) | Si > 35 mm : hypertrophie ventriculaire gauche | |
| Axe du cœur entre – 30° et + 120° | Si au-delà de – 30° : déviation axiale gauche | |
| Si au-delà de + 120° : déviation axiale droite | ||
| Espace QTc | Durée ≤ 400–440 ms | Si > 440 ms (homme) et 460 ms (femme) : QT long |
Étude des conditions d’enregistrement
- Vitesse de déroulement : classiquement 25 mm par seconde (un « petit carreau » = 40 ms, un « gros carreau » = 200 ms).
- Étalonnage : classiquement 10 mm pour 1 mV.
Étude du rythme et de la fréquence cardiaque
- Définition du rythme sinusal :
-
- c’est un rythme dans lequel l’ensemble de l’activation cardiaque est sous la dépendance du nœud sinusal ;
- sur l’ECG : chaque onde P est suivie d’un QRS et chaque QRS est précédé par une onde P ;
- de plus, l’onde P sinusale est toujours positive en DI et dans le territoire inférieur (DII, DIII, aVF), et négative en aVR.
- Détermination de la fréquence cardiaque : on peut le faire à partir d’une règle à ECG ou en retenant la séquence « 300/150/100/75/60/50/42/37,5… » (fig. 6.26).
________________________________________________________________________________
Figure 6.26. Calcul de la fréquence cardiaque sur un ECG.
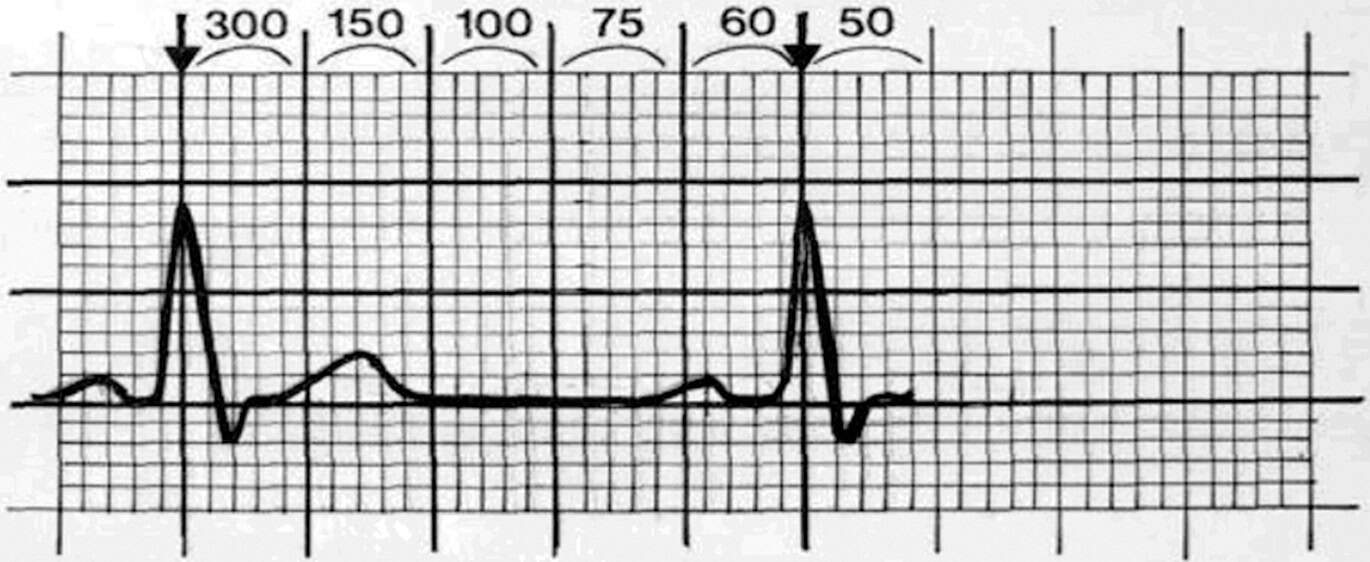
On prend comme curseur un QRS sur la ligne verticale d’un carreau et on calcule la fréquence en fonction de la position du QRS suivant.
________________________________________________________________________________
Analyse de la dépolarisation atriale : onde P
- L’onde P sinusale est toujours positive en DI et dans le territoire inférieur (DII, DIII, aVF), et négative en aVR.
- Sa durée normale est inférieure à 100 ms (2,5 petits carreaux) et son amplitude inférieure à 2,5 mm. En cas d’onde P > 120 ms, on parlera d’hypertrophie de l’atrium gauche et d’hypertrophie atriale droite en cas d’onde P > 2,5 mm.
- En cas d’absence d’onde P sinusale visible sur un ECG, alors que les QRS sont présents et réguliers, on parlera de bloc sinuatrial (BSA) du troisième degré ou de BSA complet (fig. 6.27). À moindre niveau, on parlera de BSA du deuxième degré de type 2 lorsque l’absence de l’ensemble des complexes P-QRST sera observée de façon temporaire (une fois sur deux : BSA 2/1 ; deux fois sur trois : BSA 3/1, etc.) (fig. 6.28). On parlera de BSA du deuxième degré de type 1 lorsqu’on observera une diminution progressive de l’espace P-P jusqu’à l’observation d’une augmentation brutale de l’espace P-P suivant, cette augmentation restant inférieure au double de l’espace P-P précédent (fig. 6.29). Enfin le BSA du premier degré est difficile à décrire sur l’ECG. On peut considérer qu’il est représenté par une bradycardie sinusale excessive avec l’ensemble de la séquence P-QSR-T (fig. 6.30).
________________________________________________________________________________
Figure 6.27. BSA du 3e degré, ou complet.
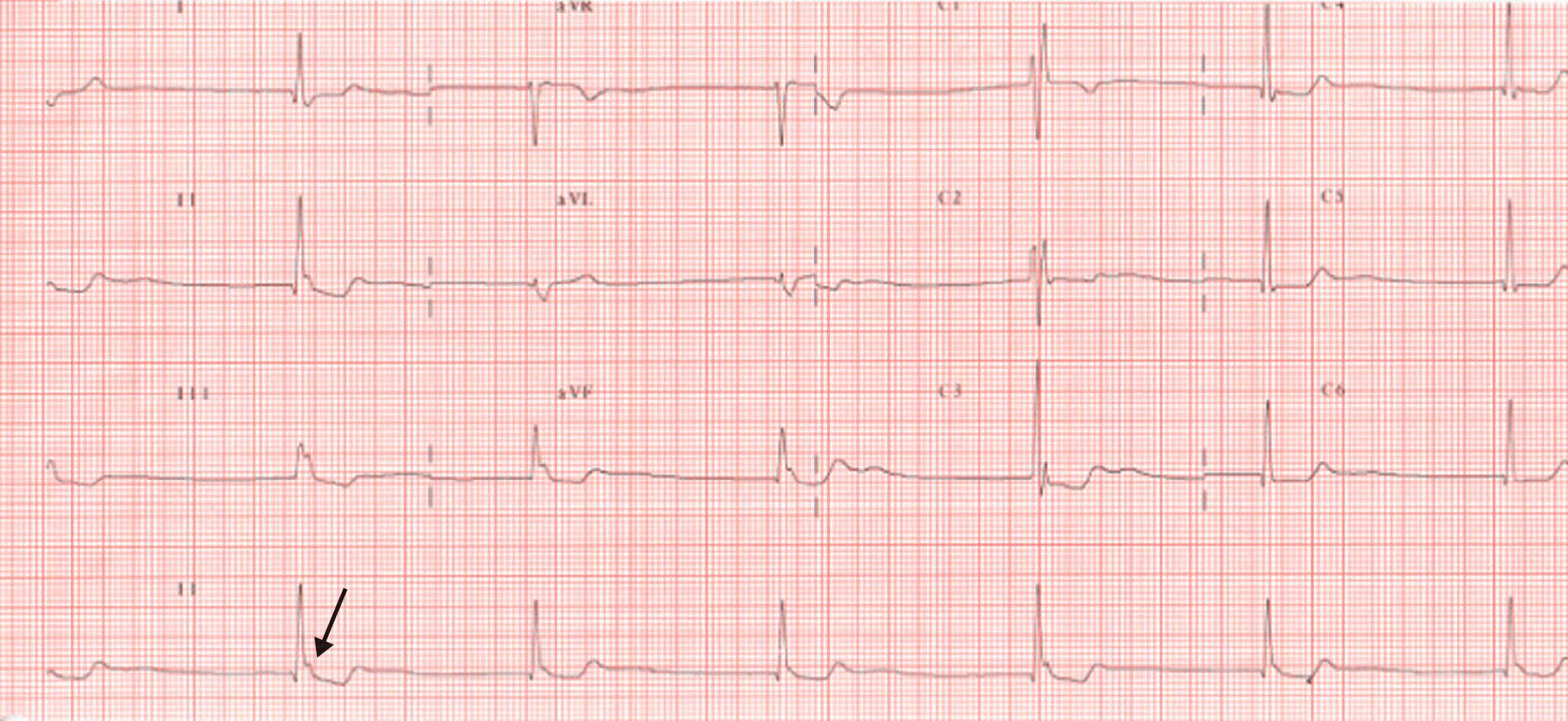
Bradycardie régulière à QRS fins sans ondes P visibles avant les QRS. Notez la présence d’ondes P’ rétrogrades à la fin des QRS (flèche).
________________________________________________________________________________
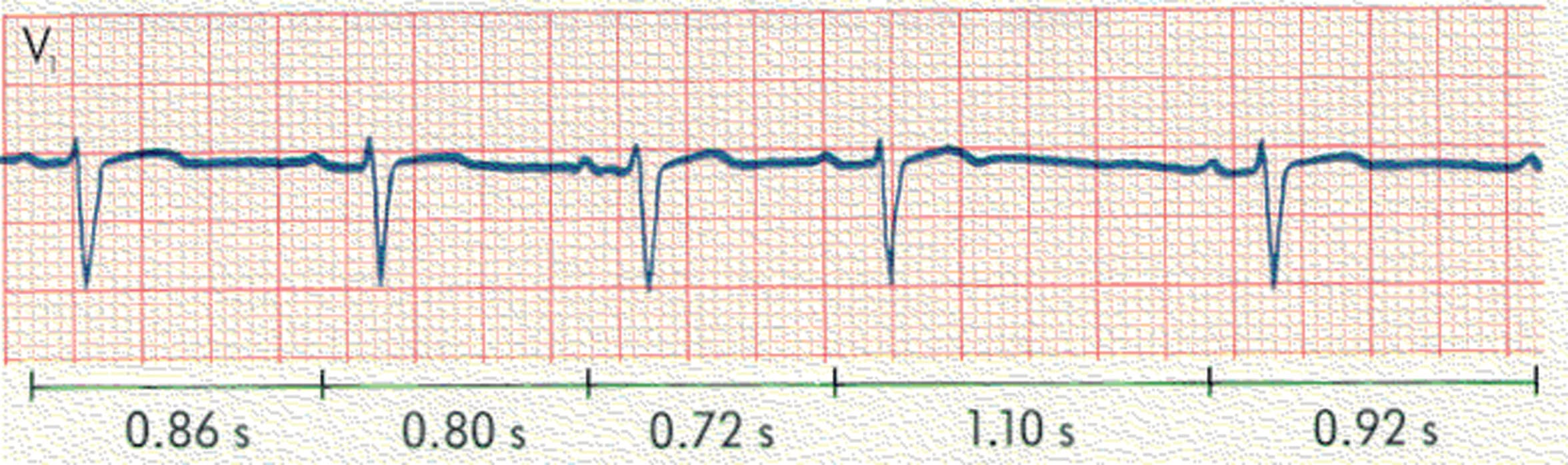
Figure 6.28. BSA du 2e degré de type 2.
Après deux complexes P-QRS-T, il existe une pause de 2,5 secondes avec reprise d’un rythme avec l’ensemble du complexe P-QRS-T. Cette pause correspond à 3 fois l’espace P-P précédent (0,82 sec) ; ce qui correspond à un BSA du 2e degré de type 2 en 3/1. Sur la partie droite du tracé, BSA du 2e degré de type 2 en 2/1.
________________________________________________________________________________
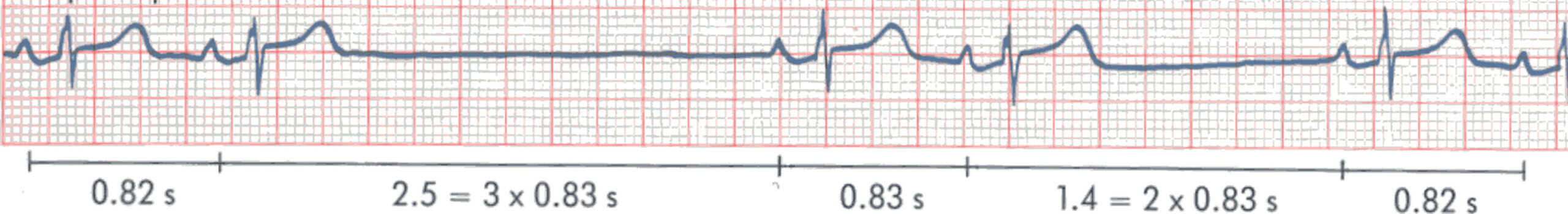
Figure 6.29. BSA du 2e degré de type 1.
On observe un raccourcissement progressif du P-P avec brutalement un allongement de l’espace P-P. Cet allongement reste inférieur au double de l’espace P-P précédent : 1,10 s < 1,44 (2 × 0,72 s).
________________________________________________________________________________
Figure 6.30. BSA du 1er degré.
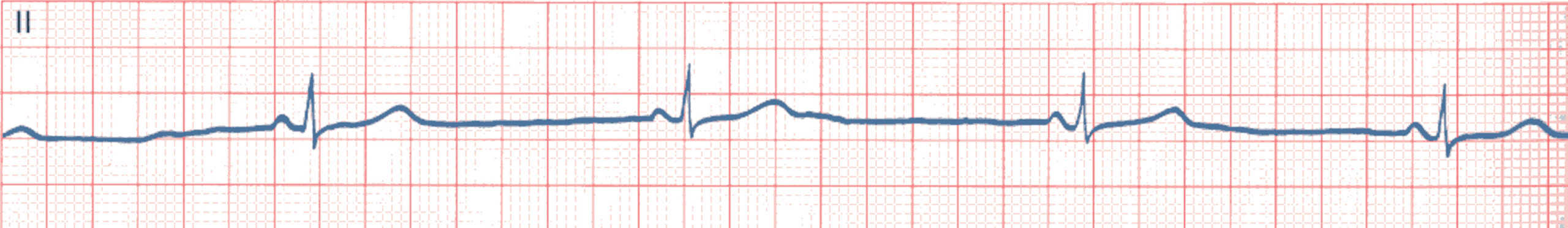
Il n’existe pas vraiment de critère ECG de ce type de BSA. On peut considérer qu’en cas de bradycardie sinusale importante (< 50/min), cela peut correspondre à un BSA du 1er degré.
________________________________________________________________________________
- En cas de présence d’onde P excessives avec plus d’ondes P que de QRS, on parlera d’un trouble du rythme atrial. Ceux-ci se déclinent en trois types d’arythmies atriales :
-
- la fibrillation atriale (FA), qui correspond à une activité atriale désorganisée et anarchique représentée sur l’ECG par une trémulation ou un tremblement de la ligne isoélectrique (fig. 6.31). La fréquence de l’activité atriale est entre 400 et 600 impulsions par minute. À cette fréquence, le nœud atrioventriculaire joue son rôle de frein et transmet de façon aléatoire l’activité électrique aux ventriculaires (phénomène de Wenkebach). L’activité ventriculaire qui en résulte est irrégulière et habituellement à QRS fins (sauf en cas de bloc de branche fonctionnel) ;
________________________________________________________________________________
Figure 6.31. Fibrillation atriale.
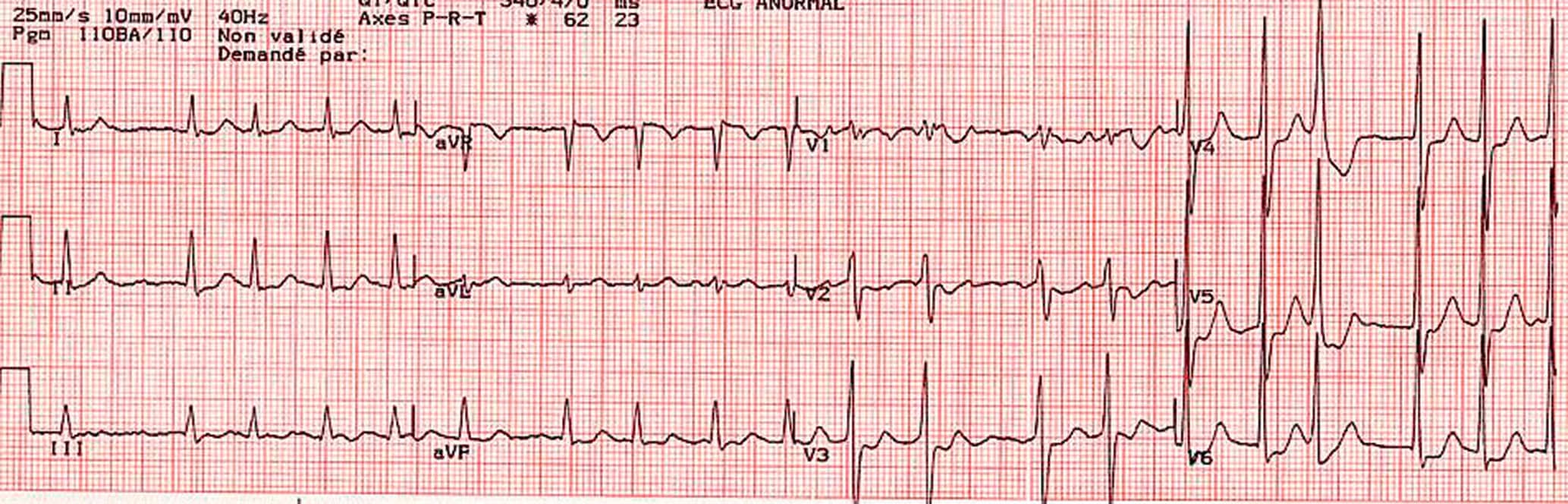
Tachycardie à QRS fins irrégulière avec une ligne isoélectrique trémulante (DIII). Noter l’amplitude des QRS en V5 et V6 compatible avec une hypertrophie ventriculaire gauche électrique.
________________________________________________________________________________
-
- le flutter atrial, circuit électrique qui chemine dans l’atrium droit à une fréquence habituellement de 300 battements par minute : il est représenté sur l’ECG par une activité atriale organisée typiquement en « dents de scie » ou en « toit d’usine » sans retour à la ligne isoélectrique, avec une transmission également aléatoire aux ventricules (fig. 6.32). L’activité ventriculaire qui en résulte est irrégulière (mais peut être régulière) et habituellement à QRS fins (sauf en cas de bloc de branche fonctionnel) ;
________________________________________________________________________________
Figure 6.32. Flutter atrial.
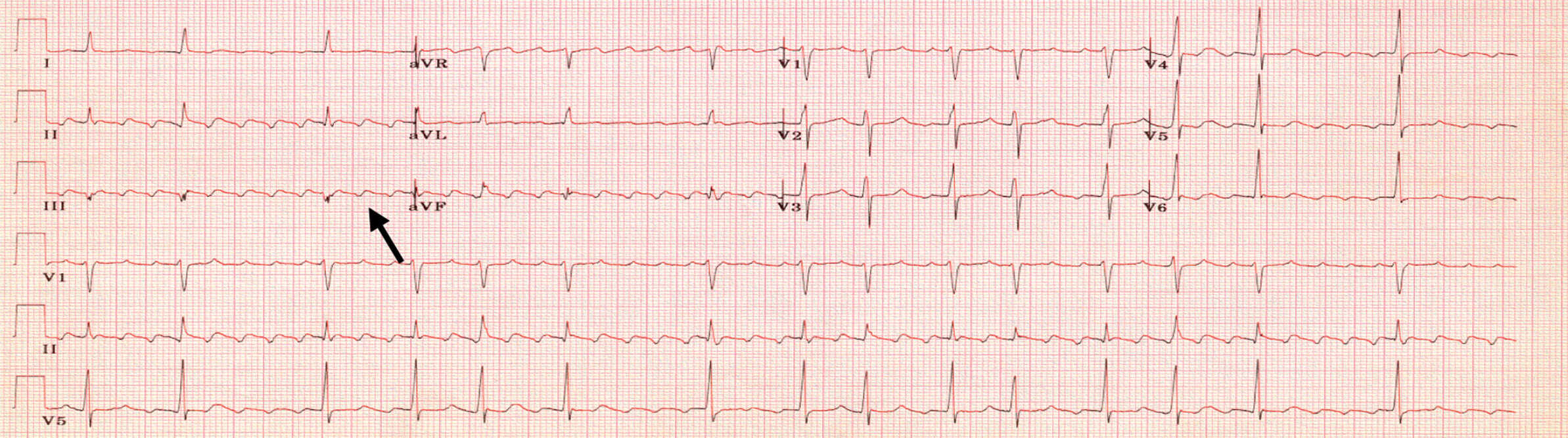
Tachycardie à QRS fins irrégulière avec présence d’onde P en « toit d’usine » ou en « dents de scie » (flèche) sans retour à la ligne isoélectrique.
________________________________________________________________________________
-
- la tachycardie atriale, ou tachysystolie atriale, qui est secondaire à un foyer ectopique dans l’une ou l’autre des atriums, battant entre 220 et 240 battements par minute et qui est représentée sur l’ECG par une activité atriale bien identifiée avec un retour à la ligne isoélectrique et avec une transmission également aléatoire aux ventricules (fig. 6.33). L’activité ventriculaire qui en résulte est irrégulière (mais peut être régulière) et habituellement à QRS fins (sauf en cas de bloc de branche fonctionnel).
________________________________________________________________________________
Figure 6.33. Tachycardie atriale.
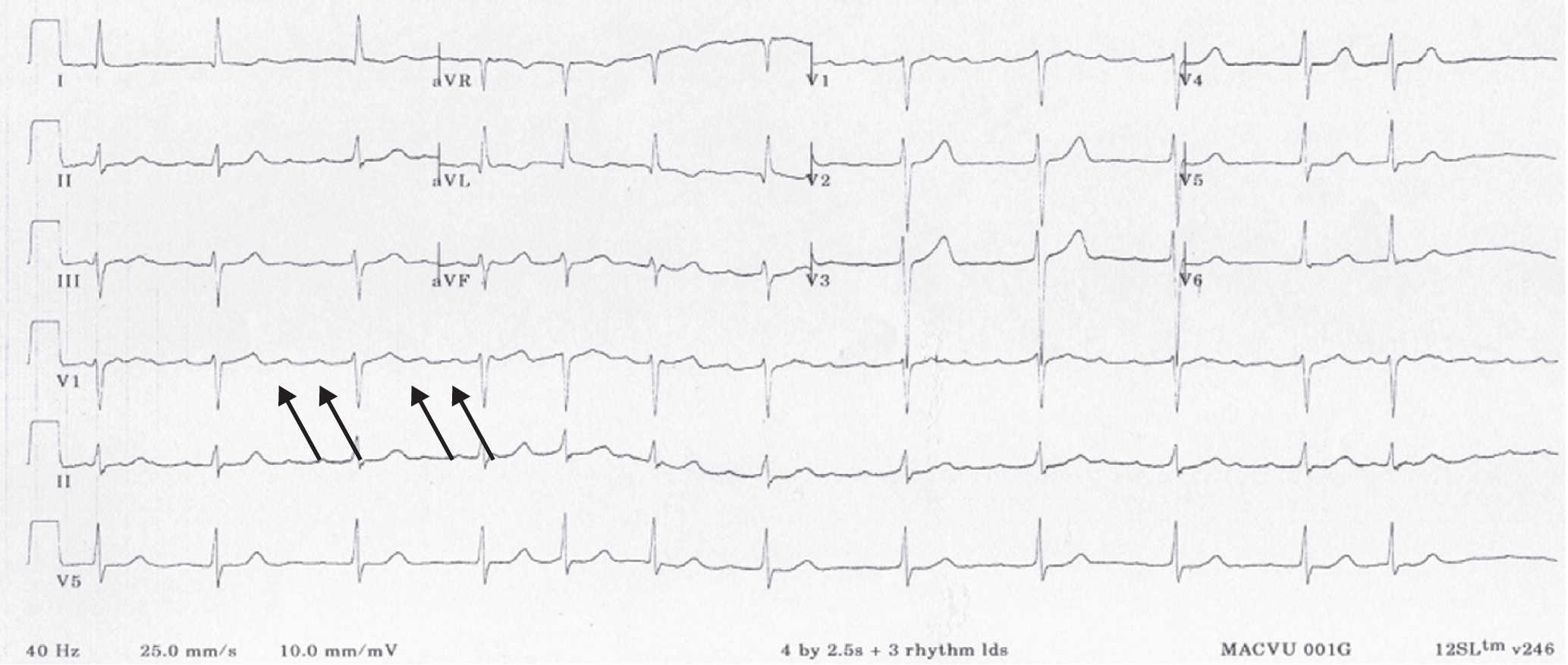
Tachycardie à QRS fins irrégulière avec présence d’ondes P rapides (flèches) et retour à la ligne isoélectrique.
________________________________________________________________________________
Analyse de la conduction atrioventriculaire : espace PR
- La durée de l’espace PR normale est comprise entre 120 et 200 ms (trois petits carreaux et un gros carreau). Elle se mesure entre le début de l’onde P et le début du QRS.
- Lorsqu’il existe une anomalie de l’espace PR soit par allongement excessif soit par absence de complexe QRS après une onde P, on parlera de bloc atrioventriculaire (BAV).
- En cas d’allongement de l’espace PR > 200 ms, mais ce dernier étant toujours fixe et constitué de l’ensemble de la séquence P-QRS-T, on parlera de BAV du premier degré (fig. 6.34).
________________________________________________________________________________
Figure 6.34. BAV du 1er degré associé à un bloc de branche droit complet et déviation axiale gauche.
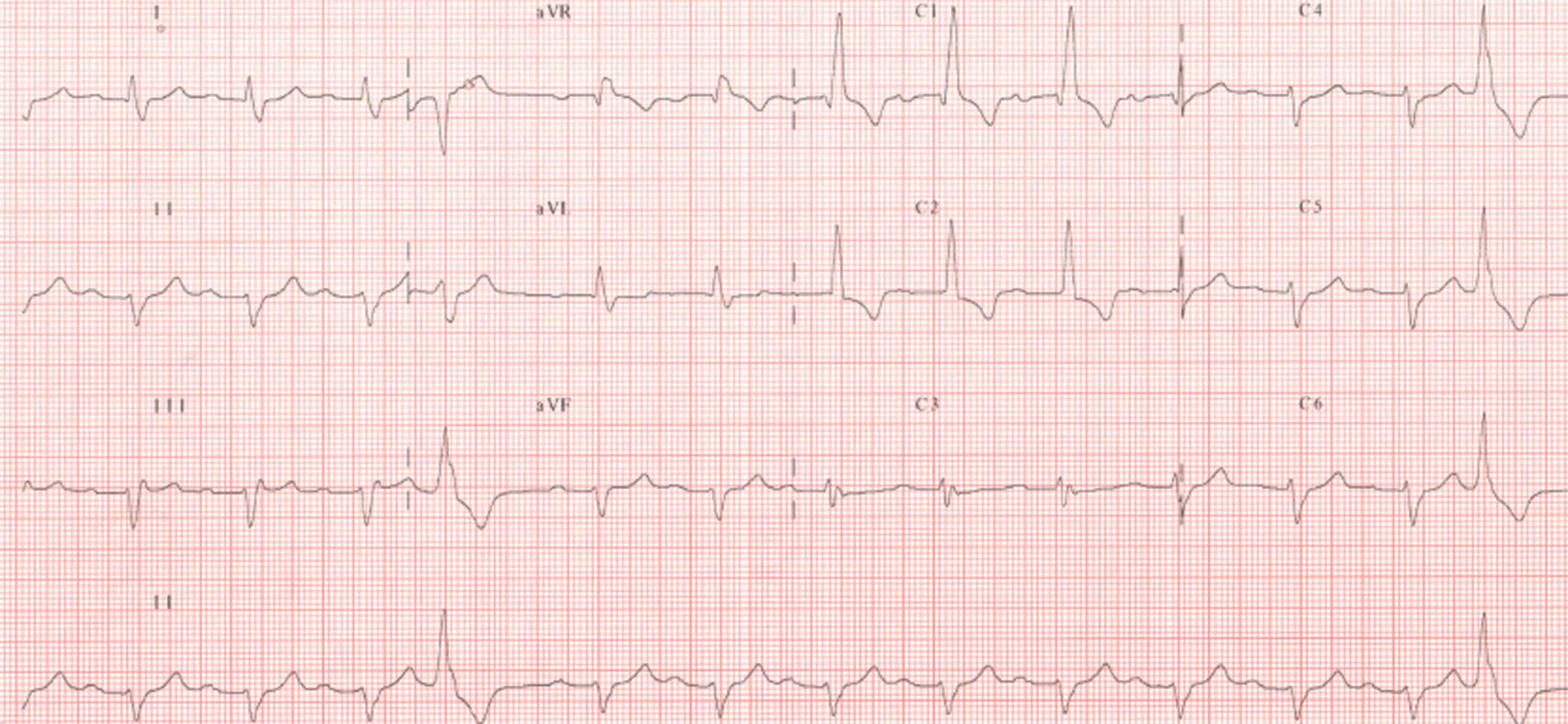
Allongement de l’espace PR > 200 ms et aspect RsR’ en V1.
________________________________________________________________________________
- Lorsqu’on observera sur un ECG un allongement progressif de cet espace PR jusqu’à la survenue d’une onde P bloquée, on parlera de BAV du deuxième degré de type 1 (ou appelé phénomène de Wenkebach) (fig. 6.35). Lorsqu’on observera sur un ECG une onde P non suivi d’un QRS, on parlera de BAV du deuxième degré de type 2 (fig. 6.36). Cependant, cette onde P bloquée doit être observée à une fréquence identique aux ondes P précédentes suivies d’un QRS, et les espaces P-QRS-T des complexes précédents doivent être fixes sans allongement progressif. Enfin, on parlera de BAV du deuxième degré de type 2 en 2/1 lorsqu’il existera une onde P bloquée sur deux, 3/1 en cas de deux ondes P bloquées consécutives sur trois…
________________________________________________________________________________
Figure 6.35. BAV du 2e degré de type 1 (période de Luciani-Wenkebach).
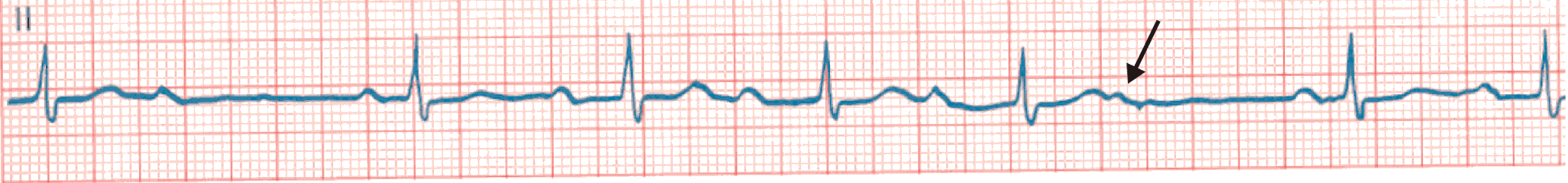
Allongement progressif de l’espace PR jusqu’à la survenue d’une onde P bloquée (flèche).
________________________________________________________________________________
Figure 6.36. BAV du 2e degré de type 2 en 2/1.
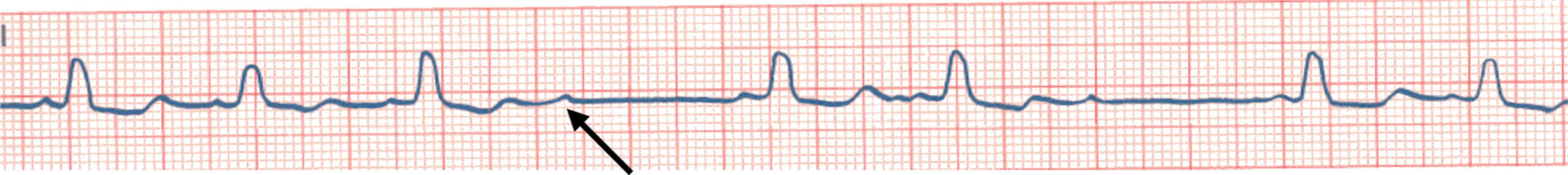
Survenue d’une onde P bloquée (flèche) non prématurée avec intervalles P-P précédant et suivant identiques. Il n’existe pas au préalable d’allongement progressif des espaces PR précédents.
________________________________________________________________________________
- Le BAV du 3e degré, ou BAV complet, est observé lorsqu’il existe une dissociation complète entre les ondes P et les complexes QRS. Les ondes P sont régulières et battent à leur propre fréquence, les QRS sont également réguliers et battent à leur propre fréquence, et il n’existe aucune relation entre ces deux activités. Les QRS sont fins quand le niveau de bloc est situé avant la bifurcation du faisceau de His et larges quand il se situe en aval (fig. 6.37).
________________________________________________________________________________
Figure 6.37. BAV du 3e degré, ou complet.
Les ondes P sont régulières et battent à leur propre fréquence, les QRS sont également réguliers et battent à leur propre fréquence, et il n’existe aucune relation entre ces deux activités. Les QRS sont fins quand le niveau de bloc est situé avant la bifurcation du faisceau de His et large quand il se situe en aval. Notez l’intérêt d’une dérivation longue en bas pour affirmer le diagnostic.
________________________________________________________________________________
Analyse de la dépolarisation ventriculaire : complexe QRS
- Définitions :
-
- la lettre « R » désigne la première onde positive, « Q » une onde négative précédant l’onde R, « S » une onde négative suivant l’onde R (même en l’absence d’onde Q) ;
- si deux ondes positives sont présentes, la deuxième est appelée « R’ » ;
- un aspect QS désigne une dérivation entièrement négative.
- Analyse de l’axe de QRS dans le plan frontal : on utilise pour ce faire les dérivations frontales, en particulier DI, DII et DIII, et on s’aide du cadran représenté en figure 6.38. Lorsque le QRS est globalement positif dans une dérivation, la dépolarisation va vers cette dérivation ; à l’inverse, s’il est négatif, elle s’en éloigne. L’axe du QRS est perpendiculaire à la dérivation où le QRS est globalement nul. Les valeurs normales se situent entre – 30° et + 120°. En dessous de – 30°, on parle de déviation axiale gauche ou d’hémibloc antérieur gauche (classiquement QRS positif en DI et négatif en DII/DIII) (fig. 6.39) ; au-delà de + 120°, de déviation axiale droite ou d’hémibloc postérieur gauche (classiquement QRS négatif en DI, positif en DII/DIII) (fig. 6.40).
________________________________________________________________________________
Figure 6.38. Cadran trigonométrique permettant le calcul de l’axe du cœur.
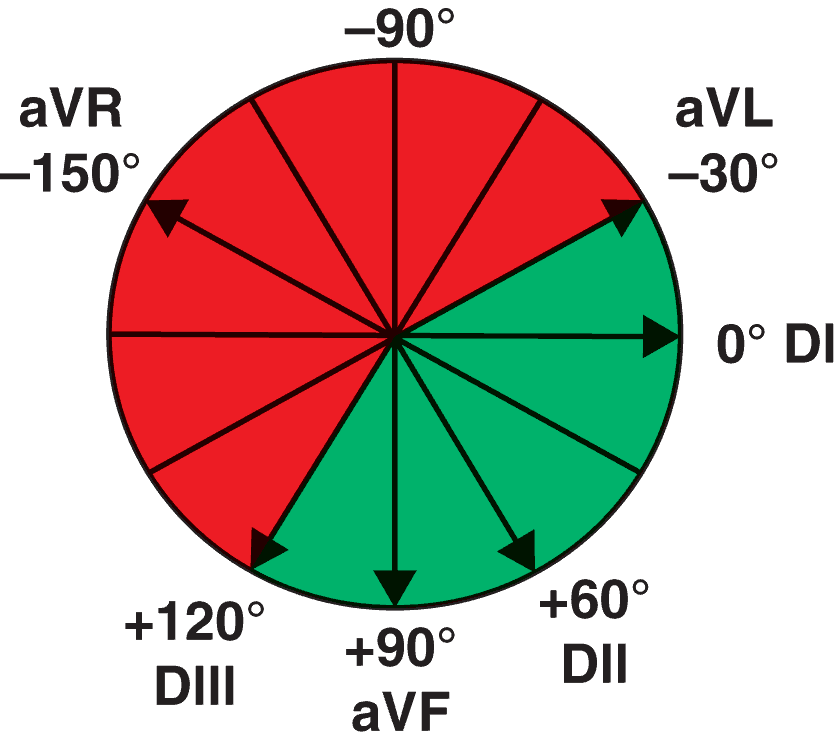
________________________________________________________________________________
Figure 6.39. Hémibloc antérieur gauche.
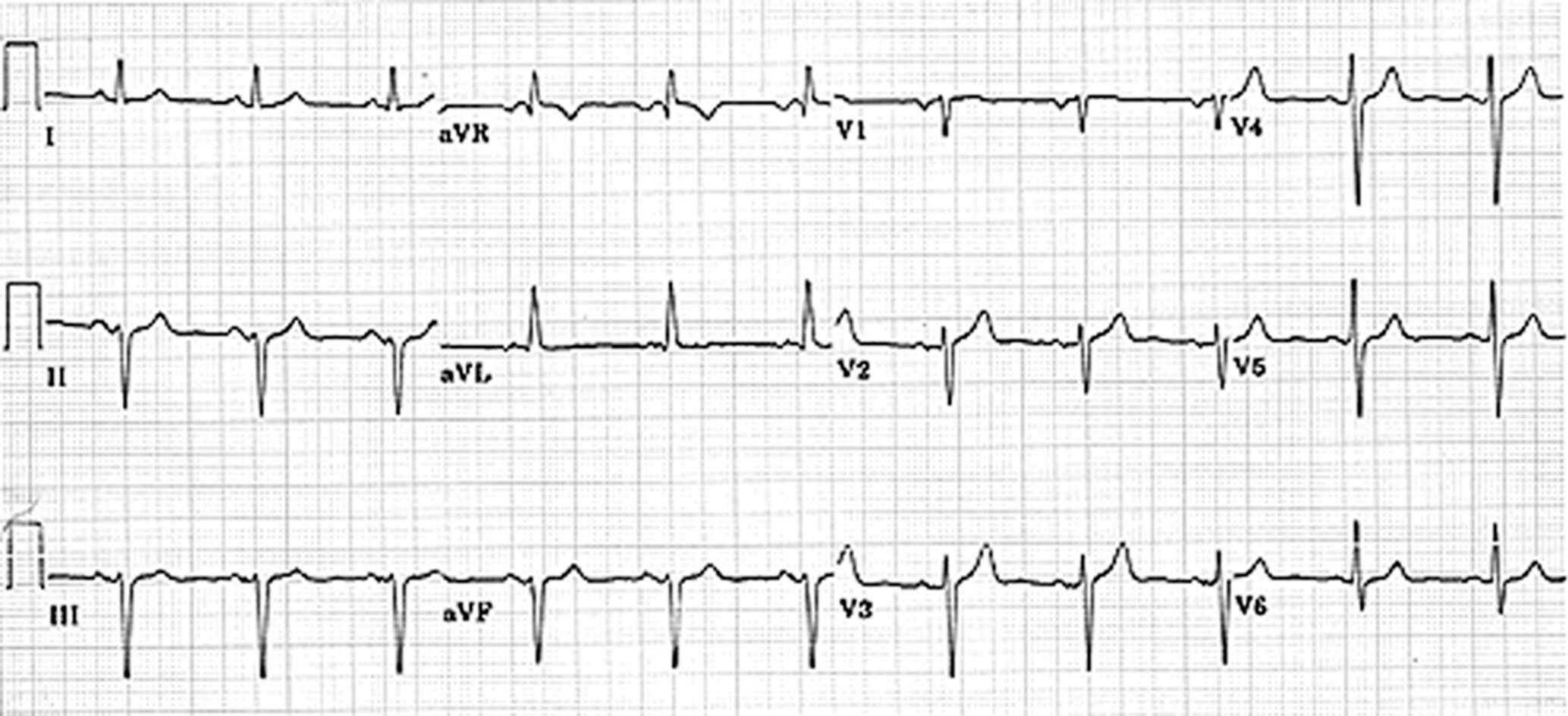
Déviation axiale gauche (QRS négatif en DII, DIII, aVF).
________________________________________________________________________________
Figure 6.40. Hémibloc postérieur gauche.
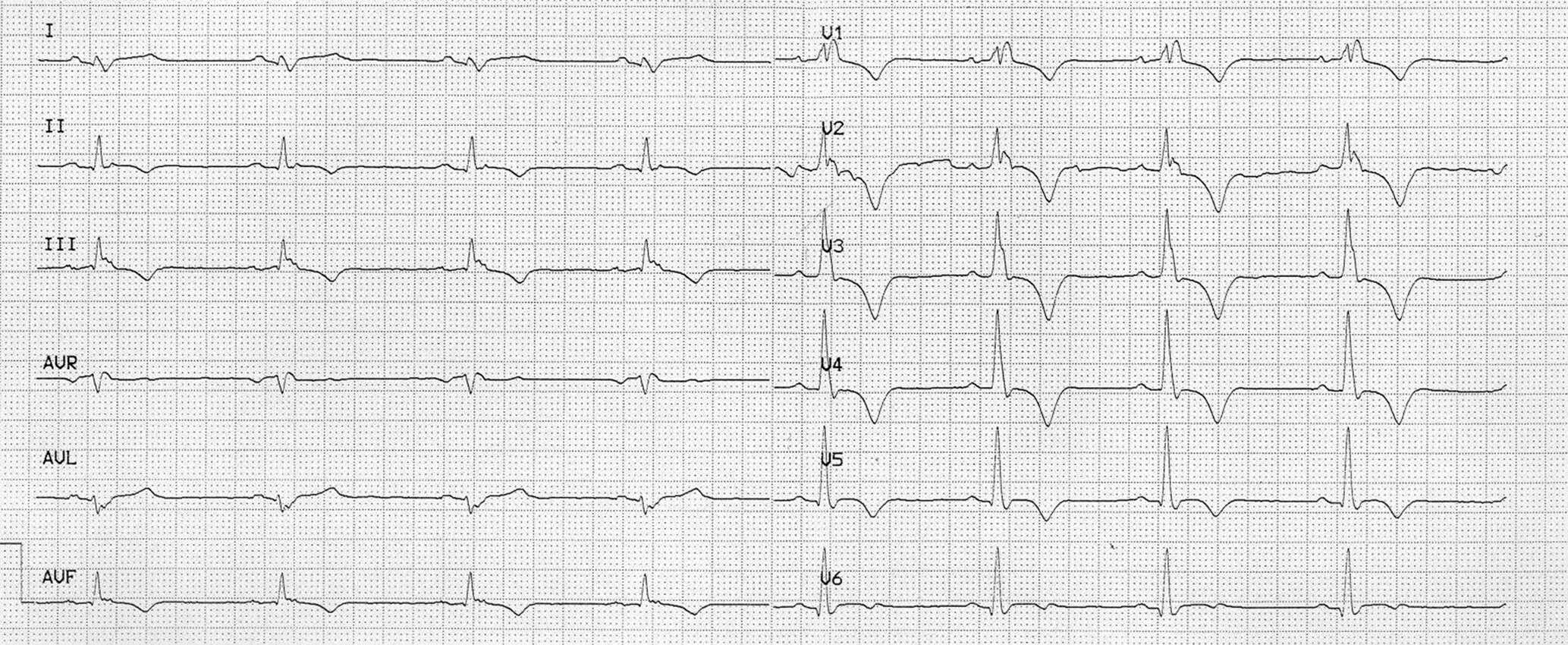
Déviation axiale droite (QRS négatif en DI, aVL).
________________________________________________________________________________
- La positivité du QRS en aVR est classiquement un signe d’inversion des électrodes (sauf rare déviation axiale majeure).
- Analyse de la morphologie du QRS : l’onde R croît de V1 à V6.
- Analyse de l’amplitude du QRS :
-
- diminuée : en cas d’amplitude du QRS < 5 mm dans l’ensemble des dérivations précordiales, on parle de microvoltage ;
- augmentée : il s’agit d’un élément en faveur d’une hypertrophie ventriculaire gauche. Cette dernière peut être évaluée par la mesure de l’indice de Sokolow (amplitude de S en V1 plus celle de R en V5 : pathologique si > 35 mm) (fig. 6.41). Il faut noter que l’hypertrophie ventriculaire gauche électrique liée à une surcharge ventriculaire gauche systolique (HTA, rétrécissement aortique) s’accompagne d’une négativation des ondes T dans le territoire latéral, alors que la surcharge diastolique (insuffisance aortique, insuffisance mitrale) s’accompagne plutôt de grandes ondes T positives.
________________________________________________________________________________
Figure 6.41. Hypertrophie ventriculaire gauche.
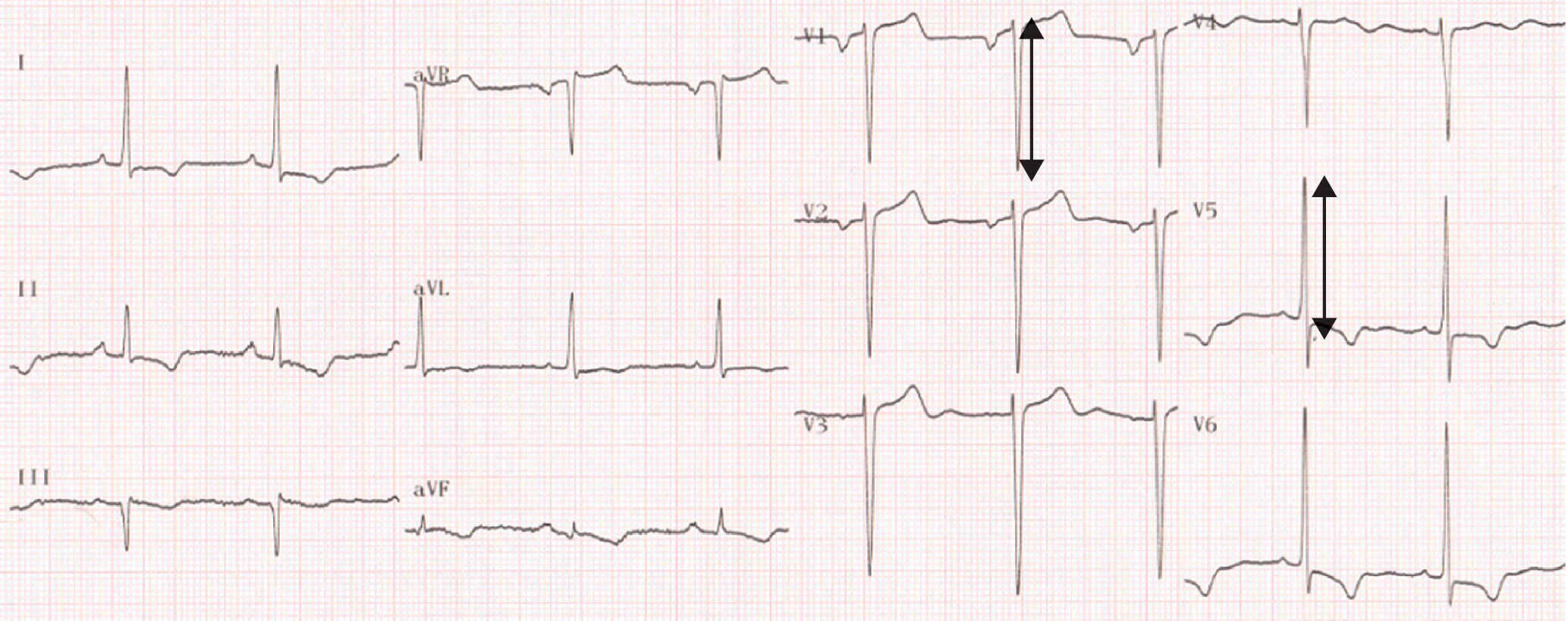
Amplitude de l’onde S en V1 + Amplitude de l’onde R en V5 > 35 mm. Ondes T négatives en V5, V6.
________________________________________________________________________________
- Analyse de la durée du QRS : le QRS normal dure moins de 80 ms (deux petits carreaux). Une durée des QRS > 120 ms traduit un asynchronisme entre la contraction du ventricule gauche et celle du ventricule droit (bloc de branche, qui peut être droit ou gauche). En cas de bloc de branche gauche (BBG), on observera en V6 un aspect RR’ avec en V1 un aspect QS ou une petite onde r et une grande onde S (fig. 6.42). En cas de bloc de branche droit (BBD), on observera en V1 un aspect RsR’ avec un aspect rS en V6 (fig. 6.43). On parlera de BBG ou de BBD complet quand ces anomalies seront associées à une largeur de QRS > 120 ms, ou incomplet lorsque la largeur des QRS est comprise entre 80 et 120 ms.
________________________________________________________________________________
Figure 6.42. Bloc de branche gauche complet.
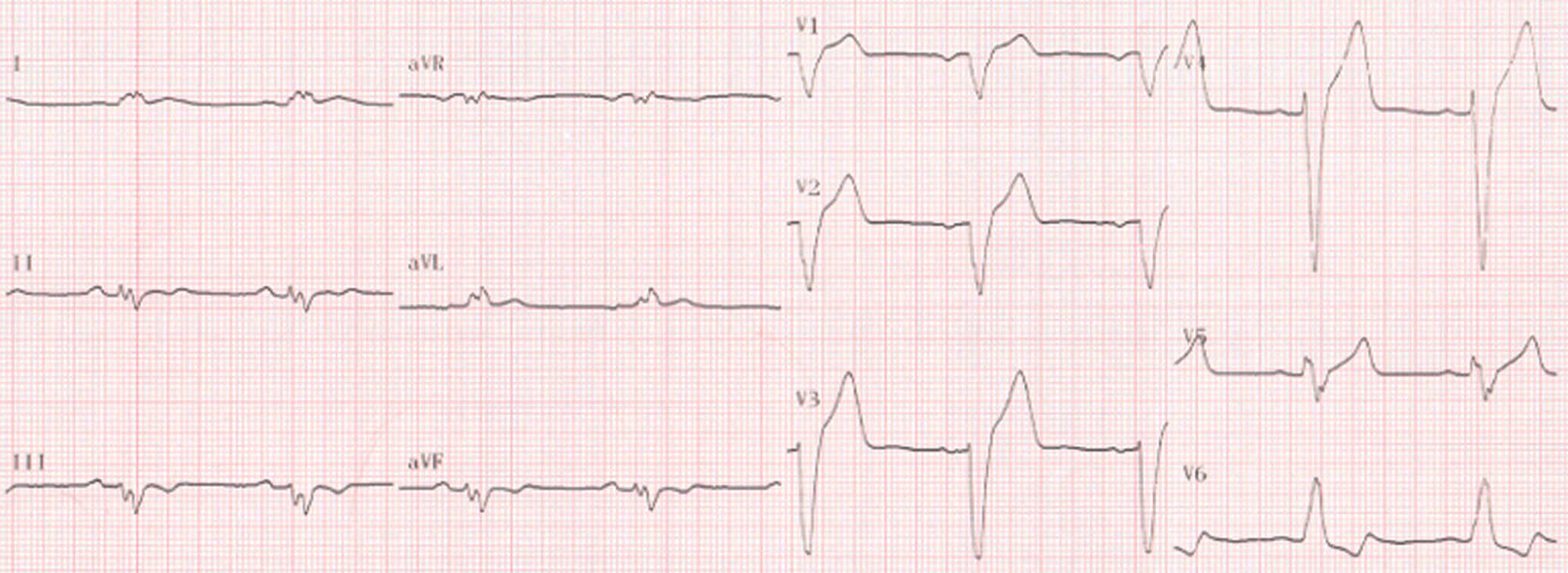
Aspect RR’ en V6 et aspect rS en V1.
________________________________________________________________________________
Figure 6.43. Bloc de branche droit complet.
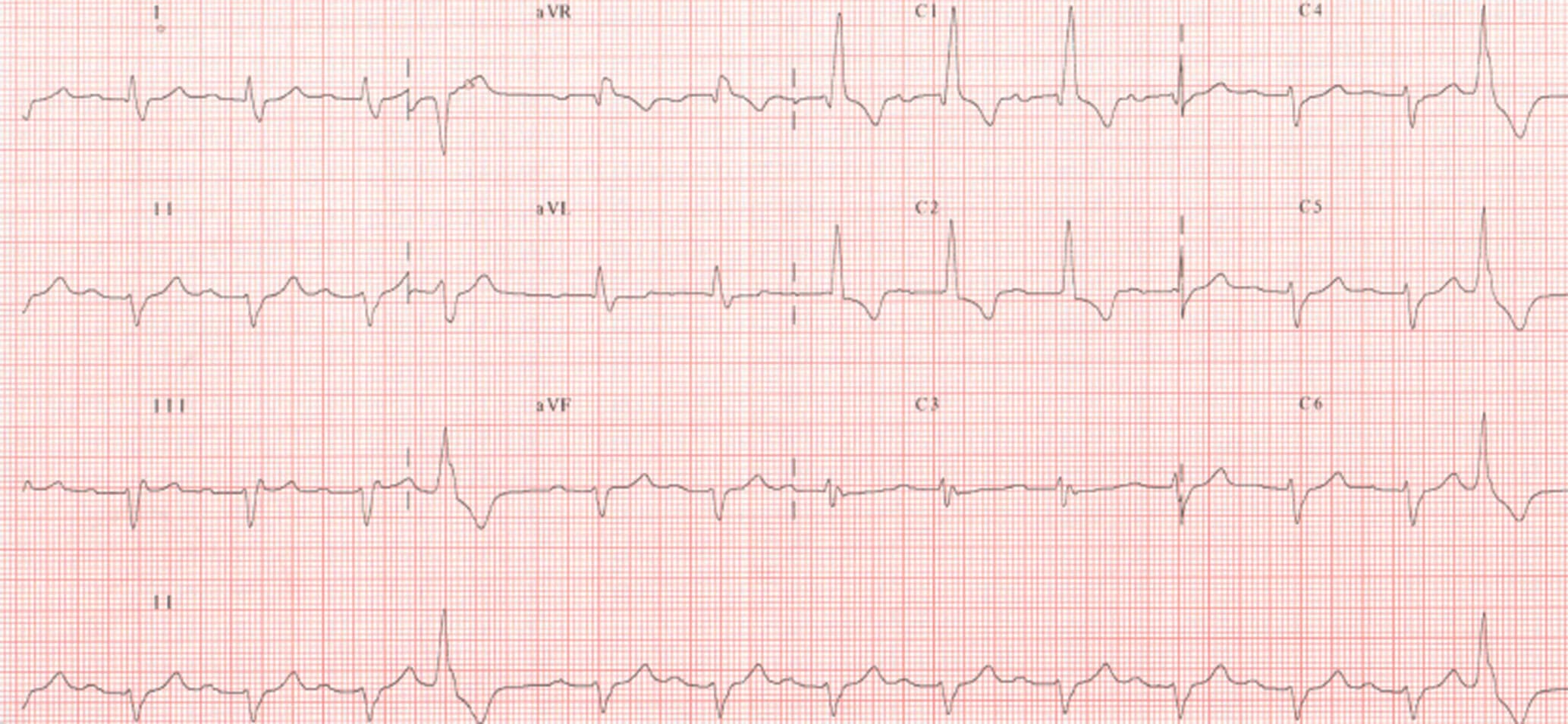
Aspect RsR’ en V1 et rS en V6 (à droite).
________________________________________________________________________________
Analyse de la repolarisation ventriculaire (segment ST, onde T, espace QT)
- Il est classique d’analyser les troubles de la repolarisation en termes de territoire myocardique :
-
- V1 à V3 : antéroseptal ;
- V3-V4 : apical ;
- V5-V6 : latéral bas ;
- DI-aVL : latéral haut ;
- V1 à V4 : antéro-septo-apical ;
- V1 à V6 + DI aVL : antérieur étendu ;
- DII, DIII, aVF : inférieur ;
- DII, DIII, aVF et V1 à V3 : septal profond ;
- V7 à V9 : postérieur ;
- V3R, V4R : ventricule droit.
- La jonction entre segment QRS et segment ST s’appelle le point J.
- Le segment ST normal est isoélectrique.
- L’onde T est habituellement de faible amplitude et de même sens que QRS. Elle est normalement positive en DI, DII, DIII, aVF et de V2 à V6. Une onde T diphasique ou négative en DIII et V1 doit être considérée comme physiologique.
- L’espace QT doit être mesuré entre le début du QRS et la fin de l’onde T. Sa durée normale varie avec la fréquence cardiaque (elle diminue avec l’accélération du rythme cardiaque). Valeur normale : environ 400 ms pour une fréquence cardiaque de 60/min. Il existe des méthodes de calcul pour « corriger » le QT en fonction de la fréquence cardiaque (QTc = QT mesuré/√Intervalle RR(en ms)).
Notions pharmacologiques élémentaires en électrophysiologie
Différentes familles de thérapeutiques
Il existe quatre grandes familles thérapeutiques en électrophysiologie : les antiarythmiques à proprement parler, les bêtabloquants, les inhibiteurs ou antagonistes calciques à action cardiaque (dit « bradycardisants ») et les digitaliques. Chaque famille thérapeutique est utilisée en fonction de son action pharmacologique précise : les antiarythmiques bloquent directement les canaux participant au potentiel d’action cellulaire ; les bêtabloquants ne bloquent pas directement ces canaux mais ont un impact sur leur fonction en bloquant les effets des catécholamines ; les inhibiteurs calciques bloquent les canaux calciques membranaires ; les digitaliques, qui n’appartiennent pas à la classification de Vaughan-Williams (cf. infra), ont une action inhibitrice sur la pompe Na+/K+-ATPase et non sur les canaux du potentiel d’action.
Classification de Vaughan-Williams et indications en électrophysiologie
Cette classification est fonction de l’action spécifique dominante des thérapeutiques. Elle est constituée de quatre classes I, II, III et IV et ne concerne pas les digitaliques (tableau 6.6).
Tableau 6.6. Classification des antiarythmiques de Vaughan-Williams.
| Classe | Action | Exemples |
| Classe I | Blocage des canaux Na+ | IA : quinidine, ajmaline, disopyramide |
| IB : lidocaïne, mexilétine, diphénylhydantoïne | ||
| IC : flécaïnide, propafénone, cibenzoline | ||
| Classe II | Blocage des récepteurs adrénergiques | Tous les bêtabloquants |
| Classe III | Blocage des canaux K+ | Amiodarone |
| Sotalol (également en classe II) | ||
| Classe IV | Blocage des canaux Ca2 + | Vérapamil, diltiazem |
Classe I de Vaughan-Williams
Les médicaments appartenant à la classe I sont des bloqueurs des canaux sodiques, limitant donc l’entrée de Na+ (phase de dépolarisation) dans la cellule au cours de la phase 0 (fig. 6.11). Il existe trois sous-classes, IA, IB et IC. Ils s’utilisent dans le traitement curatif et la prévention des récidives des troubles du rythme atriaux en grande majorité et, plus rarement, ventriculaires. En cas de surdosage, de par leur action, ce sont les complexes QRS qui sont élargis (ce qui correspond à la dépolarisation ventriculaire).
Classe II de Vaughan-Williams
Les médicaments appartenant à la classe II sont les bêtabloquants qui s’opposent à l’action des catécholamines en bloquant leurs récepteurs membranaires, ce qui entraîne une limitation de l’entrée de Ca2 + dans les cellules. Ils ne bloquent donc pas directement les canaux calciques, mais leur action rend la cellule moins excitable. Par ailleurs, toujours indirectement, ils provoquent une diminution de la pente de dépolarisation diastolique lente (phase 4 du potentiel d’action) des cellules du nœud sinusal, entraînant une diminution de l’automatisme et une bradycardie. Par conséquent, les bêtabloquants sont considérés comme des antiarythmiques. Ils sont utilisés dans le traitement et la prévention de tous les troubles du rythme, notamment ventriculaires, favorisés par une stimulation adrénergique ou par l’ischémie myocardique.
Classe III de Vaughan-Williams
Les médicaments appartenant à la classe III sont des bloqueurs des canaux potassiques, limitant donc la sortie de K+ de la cellule au cours de la phase 3 (fig. 6.11). Ils provoquent une augmentation de la durée du potentiel d’action cellulaire. Ils s’utilisent dans le traitement et la prévention de la récidive des troubles du rythme atrial et, plus souvent, ventriculaire. En cas de surdosage, de par leur action, c’est la repolarisation ventriculaire qui est touchée, provoquant un allongement du QT. Dans cette classe thérapeutique on trouve un bêtabloquant, le sotalol, qui est également un bloqueur des canaux potassiques.
Classe IV de Vaughan-Williams
Les médicaments appartenant à la classe IV sont les inhibiteurs calciques qui diminuent le courant entrant Ca2 + (ICaL) de la phase 2 du potentiel d’action. Ils diminuent donc l’importance de la phase plateau, mais sont également responsables de la diminution de l’automatisme du potentiel d’action du nœud sinusal, comme les bêtabloquants. Leur utilisation est rare car leur efficacité semble limitée. Ils peuvent être utilisés dans le traitement curatif et la prévention de certaines tachycardies atriales et ventriculaires dépendant du Ca2 +.
Enfin, les digitaliques, qui n’appartiennent pas à cette classification et n’ont donc pas d’action antiarythmique propre, ont une action bradycardisante via le blocage de la pompe Na+/K+-ATPase. Ils sont utilisés comme ralentisseur de la conduction au niveau du nœud atrioventriculaire en cas de fibrillation atriale, flutter atrial ou tachycardie atriale trop rapide.
Prise en charge thérapeutique des troubles du rythme cardiaque en fonction de leur localisation
En cas de trouble du rythme atrial : fibrillation atriale, flutter atrial et tachycardie atriale
À la phase aiguë, mise en route d’un traitement anticoagulant immédiat avec ralentissement de la cadence ventriculaire (bêtabloquants, digitaliques), et décision de réduction si certitude d’une ancienneté de moins de quarante-huit heures de l’arythmie.
Après la phase aiguë, décision de proposer une réduction de l’arythmie si cette dernière est bien tolérée après trois semaines de traitement anticoagulant ou plus rapidement si l’arythmie est mal tolérée — après élimination d’un caillot dans l’atrium gauche (auricule gauche en particulier) grâce à l’échographie transœsophagienne. Au bout de trois semaines, discussion d’une réduction pharmacologique ou électrique ou décision de respect de l’arythmie en cas d’absence total de symptômes. Il peut être proposé en cas de récidive sous traitement ou éventuellement d’emblée pour un flutter atrial un traitement curatif par ablation par radiofréquence (voir plus loin, Prise en charge interventionnelle).
En cas de décision de respect de l’arythmie, il faudra contrôler la fréquence cardiaque à l’aide d’un bêtabloquant et/ou d’un digitalique, et discuter le traitement anticoagulant au long cours en fonction du score de risque d’infarctus cérébral et d’embolie artérielle (score de risque thromboembolique artériel CHA2DS2VASc), en prenant en considération le risque hémorragique (score HASBLED).
________________________________________________________________________________
- Score de risque thromboembolique artériel CHA2DS2VASc (maximum : 9) :
-
- 2 points sont assignés à un antécédent d’AIC/AIT ou âge ≥ 75 ans ;
- 1 point pour chacun des autres facteurs : antécédent d’HTA, antécédent de diabète et antécédent d’insuffisance cardiaque récente ou FEVG < 40 %, pathologie vasculaire dont infarctus du myocarde ou AOMI ou athérome aortique, âge entre 65 et 75 ans, sexe féminin.
- Score de risque hémorragique HASBLED (maximum : 9) : hypertension artérielle (non contrôlée), anomalie de fonction rénale ou hépatique (score 1 ou 2), AIC/AIT, tendance ou prédisposition au saignement, INR labiles (si warfarine), âge (> 65 ans, fragilité), médicaments (aspirine ou AINS) ou intoxication alcoolique (score 1 ou 2).
________________________________________________________________________________
En cas de décision de réduction de l’arythmie, un traitement antiarythmique sera utilisé (classe Ic + II de première intention, ou classe III en cas de maladie cardiaque associée) et on discutera l’indication du traitement anticoagulant au long cours en fonction du score de risque thromboembolique artériel CHA2DS2VASc.
En cas de récidive de l’arythmie, il sera discuté soit un respect de cette dernière avec contrôle de la fréquence cardiaque, soit une nouvelle tentative de réduction, soit un traitement interventionnel avec ablation des foyers atriaux d’arythmie par application d’un courant de radiofréquence (voir plus loin, traitement interventionnel).
En cas de trouble du rythme jonctionnel (tachycardie de Bouveret)
En cas de crise isolée et bien tolérée, l’abstention thérapeutique sera privilégiée. La tentative de réduction par manœuvres vagales est enseignée au patient.
En cas de crises répétées, bien ou mal tolérées, sera discuté un traitement pharmacologique avec en première intention un antiarythmique de classe II ou IV et, en seconde intention un antiarythmique de classe Ic. Le recours aux antiarythmiques de classe III reste exceptionnel.
En cas de crise récidivante sous traitement, un traitement interventionnel par ablation par radiofréquence ou cryothérapie pourra être discuté (voir ci-dessous, Prise en charge interventionnelle).
En cas de trouble du rythme ventriculaire
En cas de crise mal tolérée, seul un choc électrique permettra sans risque de réduire la tachycardie ventriculaire (risque de dégradation en fibrillation ventriculaire). En cas de tachycardie ventriculaire bien tolérée, l’utilisation d’un antiarythmique de classe II ou IV pourra être proposée en l’absence de cardiopathie sous-jacente. Dans le cas contraire, il faudra proposer un antiarythmique de classe III en choisissant l’amiodarone.
Après réduction de la tachycardie ventriculaire, la discussion de prévention des récidives devra faire un choix entre un traitement médical (antiarythmique de classe I, II, III ou IV en fonction de la cardiopathie) en l’absence de dysfonction systolique ventriculaire gauche, ou la mise en place d’un défibrillateur automatique implantable en cas de dysfonction systolique ventriculaire gauche ou de mauvaise tolérance de la tachycardie (syncope). Une décision d’implantation d’un défibrillateur automatique ou d’un traitement curatif par ablation par radiofréquence sera discutée en fonction du contexte clinique et de la fonction ventriculaire gauche (voir ci-après).
Prise en charge interventionnelle spécifique des troubles de la conduction et du rythme cardiaque en fonction de leur localisation
En cas de troubles de la conduction sinu-artiale, atrioventriculaire et intraventriculaire
Le traitement interventionnel par implantation d’un stimulateur cardiaque dans les troubles de la conduction sinu-artiale et atrioventriculaire ne s’envisage qu’en cas de troubles de conduction de haut grade (à partir du deuxième degré et surtout en cas de troisième degré), chez des patients symptomatiques. Par ailleurs, plusieurs traitements comme les bêtabloquants, les digitaliques et les antiarythmiques peuvent induire des troubles conductifs qui seront réversibles à l’arrêt de ces traitements. Si ces traitements ne sont pas indispensables, et si le trouble conductif a disparu à l’arrêt du traitement incriminé, il ne sera pas nécessaire d’implanter un stimulateur cardiaque. À l’inverse, si le traitement doit être maintenu ou si le trouble conductif persiste malgré l’arrêt du traitement incriminé, il faudra implanter un stimulateur cardiaque.
En cas de troubles de la conduction du premier degré ou de la conduction inter ou intraventriculaire (bloc de branche incomplet ou complet, hémibloc antérieur ou postérieur gauche), l’implantation d’un stimulateur cardiaque n’est pas indiquée chez le patient asymptomatique. En cas de symptômes, notamment de syncope, des examens complémentaires seront réalisés pour décider s’il sera nécessaire ou non d’implanter un stimulateur cardiaque
En cas de trouble du rythme atrial : fibrillation atriale, flutter atrial et tachycardie atriale
Le traitement de la récidive de ces trois troubles du rythme atriaux repose sur la thérapeutique médicamenteuse à l’aide des différents traitements antiarythmiques. En cas de récidive sous ces traitements ou d’effets indésirables de ces derniers, un traitement interventionnel pourra être proposé par ablation par radiofréquence.
L’ablation par radiofréquence du flutter atrial est de loin la plus simple, et consiste par voie veineuse fémorale droite sous anesthésie locale de monter des cathéters directement dans l’oreillette droite afin de procéder à une ablation de l’isthme cavo-tricuspide (situé entre la veine cave inférieure en arrière et la valve tricuspide en avant , voir fig. 6.4). C’est à ce niveau que le circuit du flutter atrial passe pour auto-entretenir cette arythmie.
L’ablation de la tachycardie atriale est plus complexe car cette tachycardie peut se situer aussi bien dans l’oreillette droite que dans l’oreillette gauche. Par le même abord veineux fémoral droit, les cathéters sont montés dans l’oreillette droite si la tachycardie se situe à ce niveau. En revanche, en cas de localisation dans l’oreillette gauche, il sera nécessaire de traverser le septum interatrial (via une ponction transeptale) afin de cartographier et ablater le foyer de tachycardie.
Enfin, l’ablation de la fibrillation atriale nécessite obligatoirement la réalisation d’une ponction transeptale afin de positionner les cathéters dans l’oreillette gauche. L’origine de la fibrillation atriale provient de foyers situés à l’intérieur des quatre veines pulmonaires. Le traitement consiste à empêcher le passage de l’activité électrique provenant des veines pulmonaires vers l’oreillette gauche par une isolation circonférentielle autour de chacune des veines pulmonaires. L’énergie utilisée sera soit de la radiofréquence, soit de la cryothérapie.
En cas de trouble du rythme jonctionnel (tachycardie de Bouveret)
Comme pour les troubles du rythme atriaux, le traitement de la récidive d’un trouble du rythme jonctionnel repose sur la thérapeutique médicamenteuse à l’aide des différents traitements antiarythmiques. En cas de récidive sous ces traitements ou d’effets indésirables de ces derniers, un traitement interventionnel pourra être proposé par ablation par radiofréquence ou par cryothérapie. La localisation de la voie anormale (soit dans l’oreillette droite, soit dans l’oreillette gauche) et sa proximité par rapport à la voie électrique normale, déterminera en cas de décision d’ablation quel type d’énergie sera utilisé. L’abord se fera par voie veineuse (en cas de localisation dans l’oreillette droite) ou artérielle (en cas de localisation dans l’oreillette gauche) fémorale droite.
En cas de trouble du rythme ventriculaire
L’implantation d’un défibrillateur automatique sera justifiée d’emblée en cas de trouble du rythme ventriculaire mal toléré ou ayant entraîné une syncope et/ou une mort subite récupérée. Cette implantation est dite secondaire car le trouble du rythme est déjà survenu. Le défibrillateur automatique a les fonctions d’un stimulateur cardiaque (stimuler le cœur lorsque celui-ci est trop lent), mais est capable en plus d’envoyer un choc électrique interne lorsque le cœur est trop rapide (défibrillation). En cas de récidive d’un trouble du rythme ventriculaire, malgré la présence d’un traitement antiarythmique chez un patient porteur ou non d’un défibrillateur, une ablation par radiofréquence sera proposé afin de traiter soit dans le ventricule droit (via un abord veineux fémoral droit) soit dans le ventricule gauche (via un abord artériel fémoral droit) le foyer ou le circuit responsable du trouble du rythme ventriculaire.
Maladies génétiques en électrophysiologie : les canalopathies
Dans le tableau 6.1 sont présentés de façon schématique les différents canaux ioniques à l’origine de la genèse et de la transmission de l’activité électrique cardiaque. Comme indiqué plus haut, la plupart ont une origine génétique commune mais chaque canal dépend d’un gène précis pour sa synthèse et son fonctionnement. Ainsi, si l’activité d’un canal est altérée en raison d’une diminution ou d’une augmentation de sa fonction, le potentiel d’action de la cellule cardiaque peut être modifié. Ces anomalies peuvent survenir dès la naissance en raison d’une transmission génétique qui se fait généralement sur un mode autosomique (peut toucher aussi bien les deux sexes) dominant ou plus rarement récessif. Ces maladies génétiques touchant les canaux cardiaques peuvent provoquer des troubles du rythme en majorité ventriculaire (tachycardie ventriculaire ou torsades de pointes) à l’origine de syncope ou de mort subite chez les enfants et les adolescents. Par exemple, si le gène KCNQ1 codant canal potassique Iks (Kv7.1, intervenant dans la phase 3 de repolarisation du potentiel d’action) est modifié en raison d’une anomalie génétique touchant ce gène, le potentiel d’action cellulaire sera allongé en cas de diminution de sa fonction (syndrome du QT long), ou raccourci en cas d’augmentation de sa fonction (syndrome du QT court) (fig. 6.44). La conséquence est la survenue de post-potentiels précoces ou tardifs qui vont entraîner des troubles du rythme ventriculaire. Ces anomalies génétiques touchent en majorité les canaux potassiques (Iks, Ikr), le canal sodique (INa), les canaux calciques (ICa) et les récepteurs de la ryanodine (canaux calciques du réticulum sarcoplasmique).
________________________________________________________________________________
Figure 6.44. Allongement du QT (syndrome du QT long) secondaire à une mutation génétique touchant soit KCNQ1 (courant IKs) soit HERG (courant IKr).

La conséquence de la baisse de l’activité de l’un des deux canaux potassiques repolarisants est un allongement du temps de repolarisation, donc du potentiel d’action cellulaire. Au niveau de l’ECG, la conséquence sera un allongement de l’espace QT. Le risque est la survenue de post-potentiels précoces (EAD) qui peuvent entraîner la survenue de torsades de pointes à l’origine de syncope ou de mort subite. INa : courant sodique dépolarisant ; Ito, IKr et IKs : courants potassiques repolarisants.
________________________________________________________________________________
Points importants
- L’innervation intrinsèque du cœur dépend du système cardionecteur qui est constitué : du nœud sinusal (ou nœud sinuatrial de Keith et Flack), du nœud atrioventriculaire (ou nœud de Aschoff-Tawara), du faisceau atrioventriculaire (ou faisceau de His) et du réseau de Purkinje.
- L’activité électrique prend naissance dans le nœud sinusal et est transmise de haut en bas à travers les autres structures jusqu’au réseau de Purkinje.
- Les cellules cardionectrices des nœuds sinusal et atrioventriculaire sont différentes des cardiomyocytes : les myofibrilles sont peu nombreuses, ne sont pas organisées et sont unies par des desmosomes. On retrouve de nombreuses fibres nerveuses venant du système nerveux autonome permettant de moduler leur activité.
- Le réseau de Purkinje forme un réseau complexe de fibres spécialisées dans la conduction du potentiel d’action.
- Au-delà du réseau de Purkinje, la transmission du front de dépolarisation se fait de cellule myocardique à cellule myocardique par l’intermédiaire des jonctions communicantes : on parle de syncytium fonctionnel.
- Lors des premières étapes du développement du cœur, le tissu cardionecteur n’existe pas.
- Initialement, le myocarde primitif se contracte de façon péristaltique et les cardiomyocytes qui le composent sont initialement douées d’automatisme.
- Aux stades les plus précoces du développement du cœur, l’ensemble des cellules myocardiques ont donc des propriétés cardionectrices.
- L’activité électrique est générée par la création d’un potentiel d’action cellulaire à travers une membrane biologique. Cette dernière est constituée de canaux ioniques ayant une conductance et des propriétés spécifiques ressemblant à une véritable pile électrique.
- Les mouvements des ions à travers la membrane dépendent d’une différence de potentiel de part et d’autre de cette membrane et d’un gradient électrochimique.
- Les différents canaux peuvent être dans un état d’activation/inactivation les rendant ouverts ou fermés au passage des ions.
- À travers les canaux passent des courants entrants (sodiques et calciques) ou sortants (potassiques) qui participent à la genèse, l’amplitude et la durée du potentiel d’action.
- Le potentiel d’action est constitué de cinq phases (de 0 à 4) et est la cible des traitements antiarythmiques.
- Au niveau nodal, le potentiel d’action est différent : il est plus court, n’a pas de potentiel de repos et est responsable de l’automatisme de ces cellules.
- Il existe trois mécanismes à l’origine des troubles du rythme : l’automatisme anormal, les activités déclenchées constituées des post-dépolarisations précoces et tardives et la réentrée sur ou sans obstacle fixe.
- Il existe deux types de symptômes en électrophysiologie : la lipothymie, ou syncope, et les palpitations.
- La lipothymie doit être considérée comme équivalente à la syncope en termes de gravité clinique.
- La syncope d’Adams-Stokes est une perte de connaissance brève, brutale, sans prodrome ni confusion post-critique.
- La tachycardie de Bouveret est un symptôme et non une maladie.
- La tachycardie de Bouveret une tachycardie régulière, rapide à début et fin brutal.
- Dans l’exploration d’une syncope, l’interrogatoire est fondamental ainsi que l’examen clinique et devra comporter obligatoirement une recherche d’hypotension orthostatique et un massage carotidien, à la recherche d’une hyperréflectivité carotidienne.
- L’ECG et l’échographie cardiaque devront être systématiquement réalisés.
- Le reste du bilan de syncope (Holter de durée variable, moniteur cardiaque implantable, tilt test, exploration électrophysiologique) sera réalisé selon l’orientation diagnostique.
- Un ECG est constitué de douze dérivations standards (six périphériques et six précordiales). Il doit être enregistré à une vitesse de déroulement de 25 mm/s et avec un étalonnage de 10 mm/1 mV.
- Un ECG normal doit comporter une onde P avant chaque QRS ; un axe du cœur entre – 30° et + 120°, une onde P ≤ 120 ms, un espace PR ≤ 200 ms, un QRS ≤ 80 ms et un intervalle QT ≤ 440 ms.
- Il existe plusieurs troubles de conduction : les blocs sinuatriaux, les blocs atrioventriculaires, les blocs de branche.
- Il existe plusieurs troubles du rythme : les extrasystoles atriales et ventriculaires, les tachycardies touchant l’atrium (fibrillation, flutter et tachycardie atriales), la jonction entre atrium et ventricule (tachycardie jonctionnelle : réentrée intranodale et tachycardie orthodromique et antidromique) et les ventricules (tachycardie, fibrillation ventriculaire et torsades de pointes).
- Il existe différentes thérapeutiques médicamenteuses en électrophysiologie : les antiarythmiques qui bloquent les canaux sodiques et potassiques du potentiel d’action cellulaire (classe I et III), les bêtabloquants (classe II), les inhibiteurs calciques (classe IV) et les digitaliques.
- Les antiarythmiques sont utilisés dans le traitement et la prévention des récidives des troubles du rythme atrial, jonctionnel et ventriculaire.
________________________________________________________________________________
Exercices en ligne
Les exercices relatifs à ce chapitre sont disponibles en ligne à l’adresse suivante : http://www.em-consulte.com/e-complement/475848
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

7.1 Pathologies de l'aorte et des artères cérébrales et périphériques Auteurs : V. Aboyans [...]

Auteurs : D. Legallois, P. Milliez Anatomie L'étude de l'électrophysiologie cardiaque nécessite de connaître [...]


