Suivez-nous sur les réseaux sociaux !
Publications
Chapitre 7 – Pathologie vasculaire
7.1 Pathologies de l’aorte et des artères cérébrales et périphériques
Auteurs : V. Aboyans , S. Ben Ahmed , J. Capron , A. Cohen , E. Messas et F. Sanchez
Introduction
L’athérosclérose est la principale maladie des artères et affecte le plus souvent (mais pas seulement) les artères coronaires (voir chapitre 3), l’aorte et les artères périphériques, notamment celles à destinées cérébrales ou des membres inférieurs. D’autres affections, regroupées sous le terme des « maladies artérielles non-athéromateuses » sont beaucoup plus rares. Parmi eux, seuls les anévrysmes seront traités dans ce précis.
Épidémiologie
Les lésions athéromateuses sont fréquentes au niveau de l’aorte ainsi que de ses branches. Le plus souvent, cette maladie a un long développement infraclinique avant son expression clinique. Ainsi, l’épidémiologie de l’athérome aortique et périphérique dépend des moyens diagnostiques : la prévalence est plus importante si des examens tels que l’imagerie sont utilisés pour détecter les formes infracliniques, alors que les premières études se sont attachées à rapporter les incidences et prévalences des formes cliniques, essentiellement sous forme d’accident vasculaire cérébral (AVC) ou d’artériopathie oblitérante des membres inférieurs (AOMI).
Les maladies cardiovasculaires sont la première cause de décès en France, et parmi elles, les accidents vasculaires cérébraux sont la deuxième cause, après les accidents coronaires. On estime à 140 000 le nombre d’AVC par an en France (soit un toutes les quatre minutes), dont 30 000 fatals. Tous les AVC ne sont pas liés à l’athérosclérose, mais celui-ci est considéré comme étant la première cause, soit par occlusion d’une artère cérébrale intracrânienne, soit le plus souvent par un mécanisme embolique, avec migration de matériel fibrino-cruorique venant de lésions athéromateuses plus proximales, notamment des artères carotides, vertébrales ou de la crosse aortique.
La prévalence de la sténose carotidienne est estimée à 3-5 %, atteignant plus de 12 % chez les hommes et 6 % chez les femmes de plus de 65 ans. Comme toute maladie athéromateuse, cette prévalence est d’autant plus importante que le patient est exposé à des facteurs de risque d’athérome : tabagisme, hypertension artérielle, hypercholestérolémie ou un diabète au long cours.
On estime à plus de 200 millions le nombre d’individus affectés par l’AOMI dans le monde (et environ 1 million en France). Cette estimation inclut non seulement les formes cliniques de la maladie mais également sa forme infraclinique, diagnostiquée notamment par la mesure de l’index de pressions systolique (cf. infra). Cette maladie est très rare avant 40 ans, et augmente de manière exponentielle à partir de 65 ans, tant chez l’homme que la femme, atteignant près de 20 % de la population après 80 ans. On estime de 1/5 à 1/3 la proportion de la population affectée par la forme symptomatique de cette maladie, les autres ayant une maladie asymptomatique. Les symptômes sont essentiellement sous forme de claudication intermittente (cf. infra). Ainsi, des questionnaires ont été développés, ayant pour but de détecter cette maladie à partir des symptômes de claudication intermittente. Parmi eux, le questionnaire d’Édimbourg a été traduit et utilisé en France (fig. 7.1). La prévalence de la claudication intermittente est de l’ordre de 3-5 % après 60 ans.
Figure 7.1. Traduction française du questionnaire d’Édimbourg pour le dépistage de la claudication intermittente.
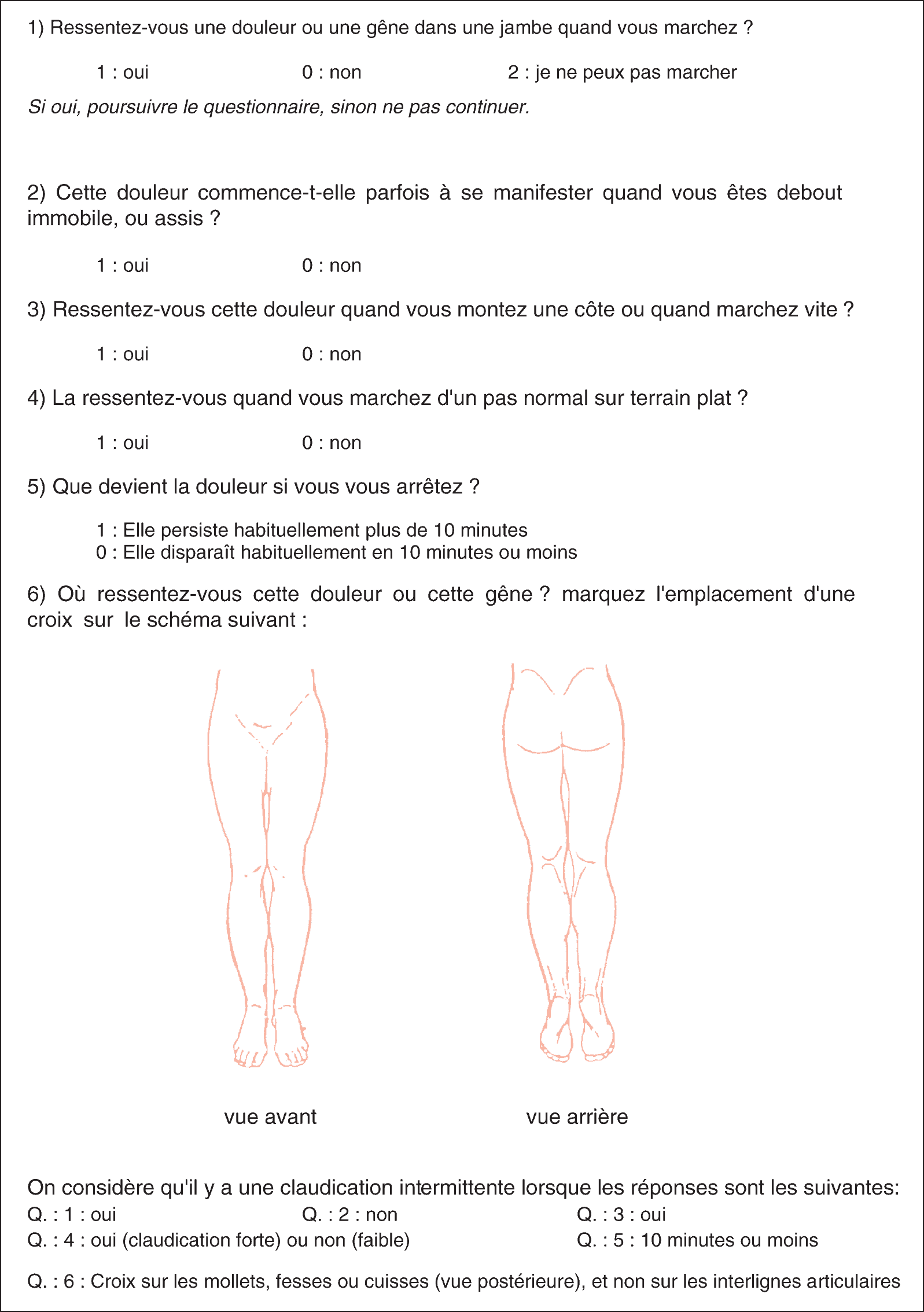
L’épidémiologie des autres atteintes artérielles athéromateuses est beaucoup moins étudiée. On estime à 10-15 % la prévalence d’atteinte artérielle digestive, notamment du tronc cœliaque, après 65 ans, mais ces lésions sont très souvent asymptomatiques. La sténose des artères rénales d’origine athéromateuse est aussi fréquente après 65 ans, de l’ordre de 9 % chez l’homme et 5 % chez la femme, le plus souvent sans retentissement clinique.
Globalement, la prévalence de la maladie athéromateuse dans un territoire vasculaire est d’autant plus élevée que le patient a déjà des atteintes dans d’autres territoires.
Anatomie (voir aussi chapitre 1)
Artères
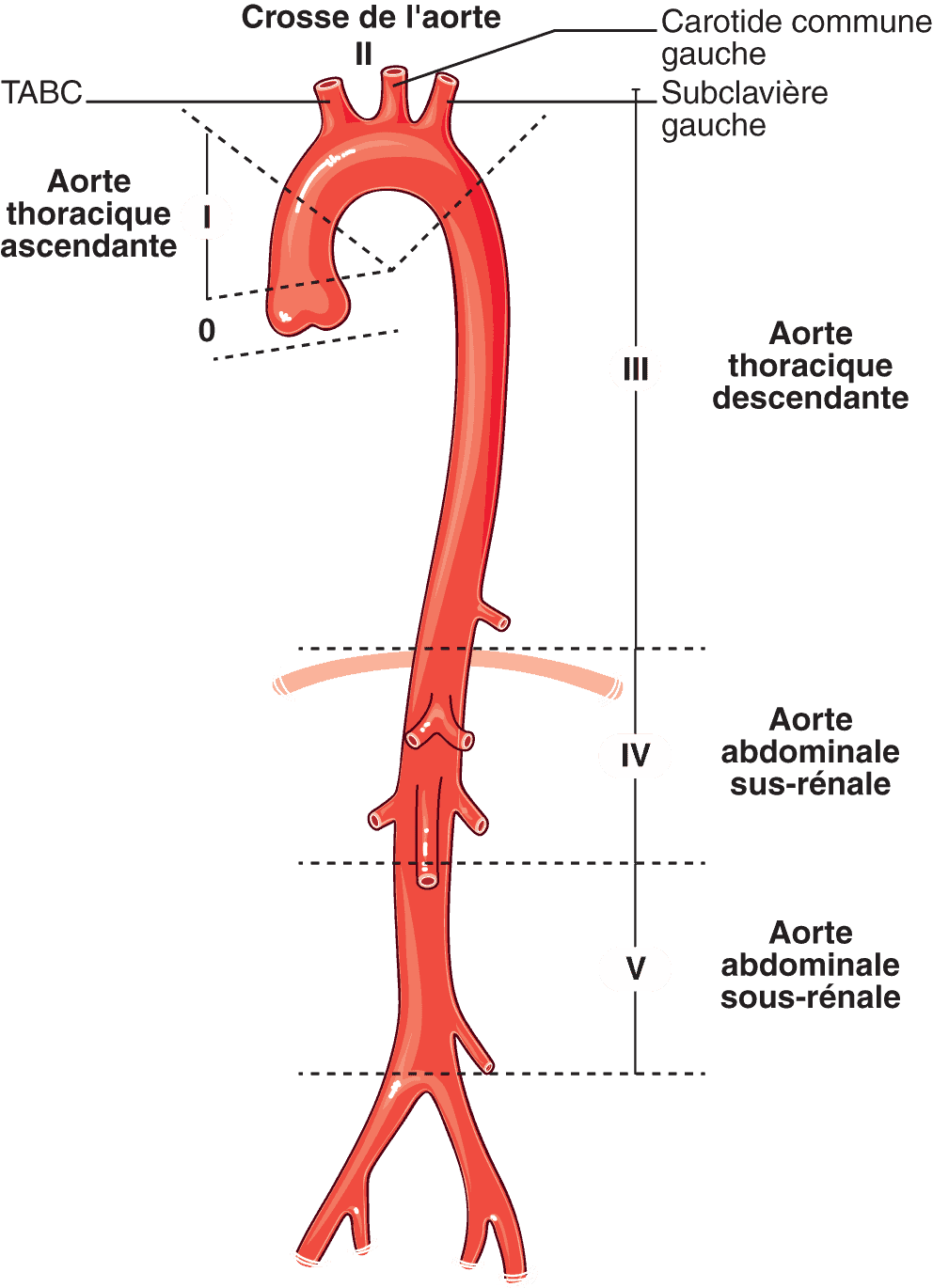
L’aorte (fig. 7.2) naît du ventricule gauche au niveau de la chambre de chasse et décrit un arc à concavité inférieure avant de descendre dans le thorax puis dans l’abdomen. Son calibre initial est d’environ 30 mm.
________________________________________________________________________________
Figure 7.2. Rappels anatomiques : aorte.
________________________________________________________________________________
Aorte thoracique
On lui décrit trois portions :
- l’aorte thoracique ascendante : elle naît de l’orifice aortique (occupée par la valve aortique) et donne principalement naissance aux artères coronaires (artère coronaire droite et tronc commun coronaire gauche se divisant en artère circonflexe et interventriculaire antérieure) au niveau des sinus de Valsalva ;
- l’arc aortique, ou crosse de l’aorte : la crosse traverse le médiastin supérieur d’avant en arrière, en se dirigeant vers l’arrière à gauche. Le tronc artériel brachiocéphalique (TABC), l’artère carotide commune gauche et l’artère subclavière gauche (ou sous-clavière) naissent directement de la face supérieure de la crosse. Le TABC se divise en arrière de l’articulation sternoclaviculaire droite, pour donner l’artère carotide commune droite et l’artère subclavière droite. Les deux artères carotides communes montent verticalement dans la région du cou et ne donnent aucune collatérale, pour se terminer en bifurcation (à hauteur de C4) où elles donnent chacune deux branches : l’artère carotide interne (destinée au cerveau et à l’œil) et l’artère carotide externe (destinée à la face et au cou) ;
- l’aorte thoracique descendante : elle suit un trajet vertical en avant du rachis thoracique jusqu’au niveau de T12 et du diaphragme où elle se prolonge en aorte abdominale. Elle donne pour principales collatérales les artères bronchiques et les artères intercostales.
Aorte abdominale
L’aorte abdominale prolonge l’aorte thoracique. C’est l’artère nourricière pour l’abdomen et de passage pour les membres inférieurs.
Elle donne de nombreuses collatérales séparées schématiquement en trois groupes :
- les artères à destinée pariétale (dont naît généralement l’artère d’Adamkiewicz qui vascularise la moelle spinale) ;
- les artères à destinée viscérale : le tronc cœliaque (en regard du disque T12-L1, donnant trois branches terminales : l’artère hépatique commune, l’artère gastrique gauche et l’artère splénique), l’artère mésentérique supérieure (qui naît au niveau de L1 au-dessus des artères rénales) et l’artère mésentérique inférieure (au niveau de L3) ;
- les artères à destinée urogénitale : les artères rénales (en général une artère rénale droite et une artère rénale gauche mais parfois deux, naissant au niveau de L1), les artères surrénaliennes moyennes et les artères génitales (artère testiculaire chez l’homme et artère ovarienne chez la femme, naissant au niveau de L2).
L’aorte abdominale se termine en bifurcation en regard du disque L4–L5 en artères iliaques communes droite et gauche.
Artères à destinée cervico-encéphalique et des membres supérieurs
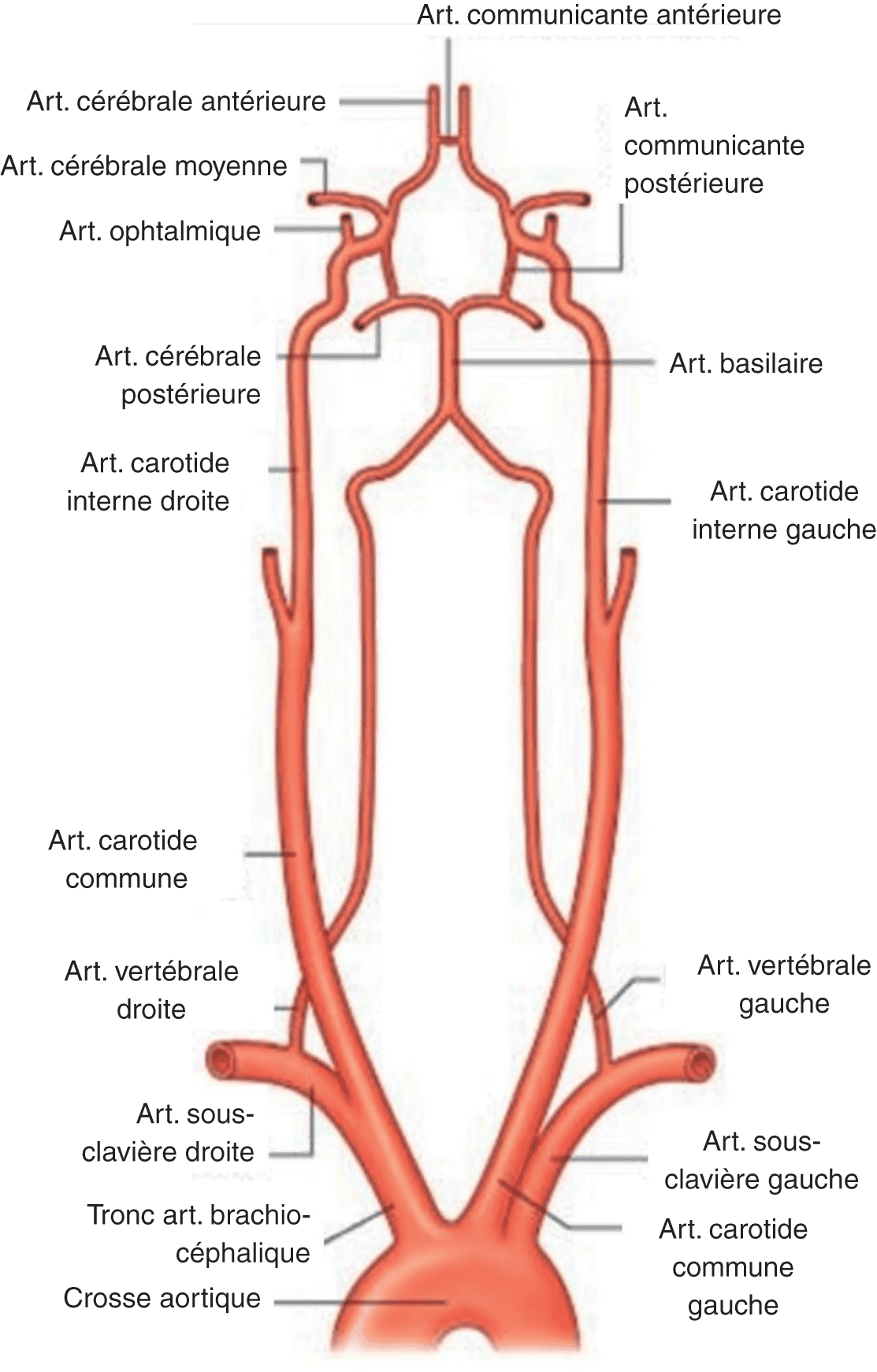
La perfusion sanguine cérébrale est assurée par les artères carotides et le système vertébro-basilaire (fig. 7.3). Les deux artères carotides forment la circulation antérieure, les deux artères vertébrales se réunissent en un tronc basilaire formant ainsi la circulation postérieure. On décrit un réseau anastomotique plus ou moins bien développé selon les individus. Il existe une anastomose entre les deux systèmes carotides via l’artère communicante antérieure ainsi qu’une anastomose entre les artères carotides et le tronc basilaire via les artères communicantes postérieures. L’ensemble de ce réseau anastomotique constitue le polygone artériel de Willis. Il existe d’autres réseaux anastomotiques, en particulier à la partie la plus distale des territoires artériels. L’ensemble de ces réseaux contribue à une protection maximale du parenchyme cérébral.
________________________________________________________________________________
Figure 7.3. Vascularisation cervico-encéphalique.
________________________________________________________________________________
Artères à destinée du petit bassin et des membres inférieurs
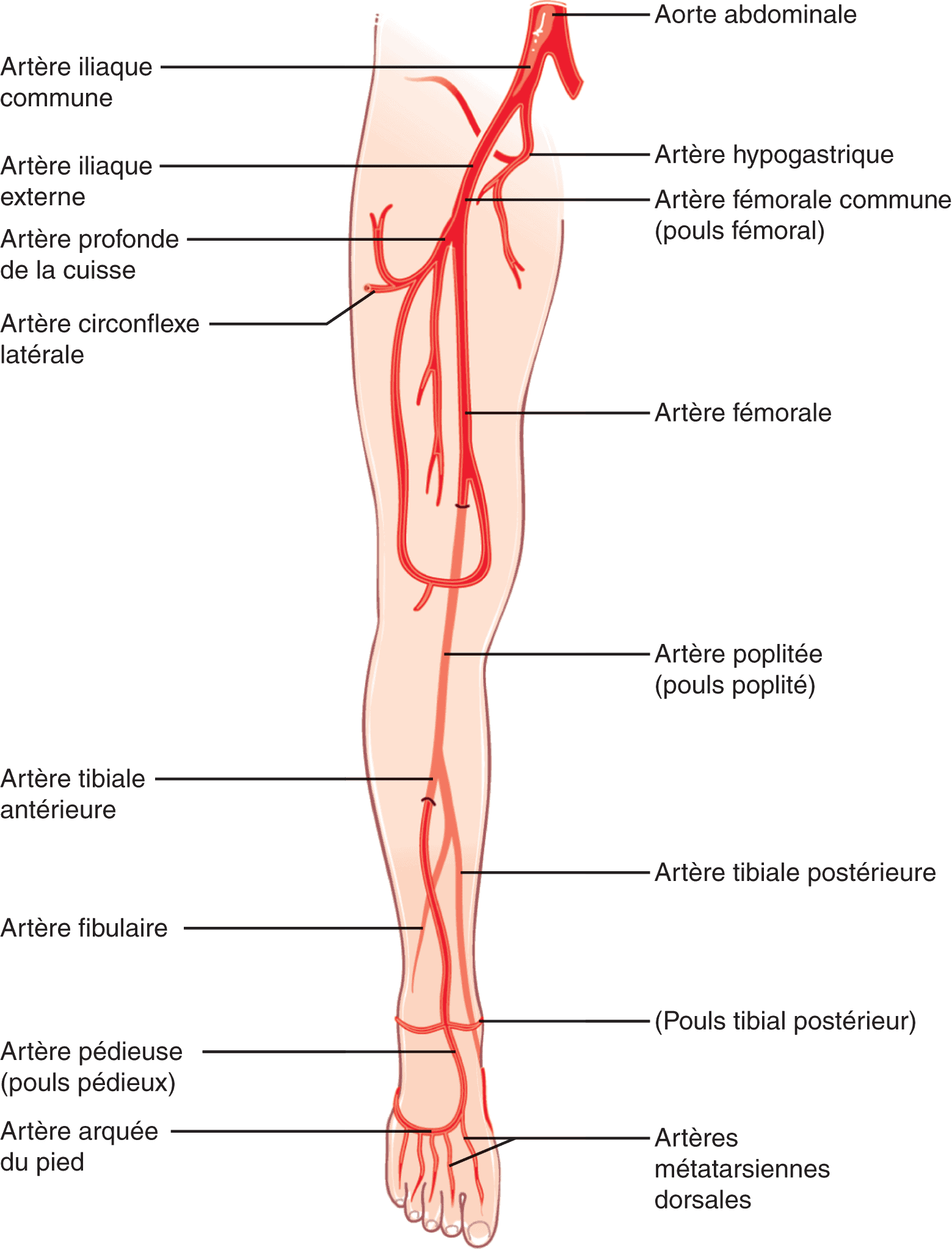
Chaque artère iliaque commune donne une artère iliaque interne, également dénommée artère hypogastrique (destinée à la vascularisation du petit bassin), et une artère iliaque externe (destinée à la vascularisation de la jambe) (fig. 7.4).
________________________________________________________________________________
Figure 7.4. Rappels anatomiques : artères à destinée du petit bassin et des membres inférieurs.
____________________________________________________________________________
L’artère iliaque externe se prolonge en artère fémorale commune au-dessous de la ligne de Scarpa.
L’artère fémorale commune se divise en deux artères principales :
- l’artère profonde de la cuisse (ou artère fémorale profonde), qui vascularise le fémur et les muscles de la cuisse. Elle a une importance clinique fondamentale car, en cas de sténose ou d’occlusion de l’artère fémorale, il peut se créer une suppléance distale de l’artère fémorale par l’artère profonde de la cuisse ;
- l’artère fémorale (ou artère fémorale superficielle), qui chemine dans la cuisse le long du canal fémoral et se prolonge en artère poplitée au-dessus du genou.
L’artère poplitée se divise en trois branches principales qui vascularisent le mollet et le pied :
- l’artère fibulaire (ou artère péronière) ;
- l’artère tibiale postérieure ;
- l’artère tibiale antérieure : celle-ci se prolonge au niveau du coup du pied en artère dorsale du pied (ou artère pédieuse).
Histologie vasculaire
Structure et fonction de la paroi vasculaire normale
L’arbre vasculaire est constitué d’artères, qui donnent naissance aux artérioles, puis aux capillaires, qui sont finalement drainés par les veinules, puis les veines. Ce sont les capillaires, la microcirculation qui sont responsables des échanges métaboliques, le reste du réseau vasculaire jouant essentiellement un rôle de transporteur.
Selon les calibres artériels, on peut distinguer les artères de grand calibre (plus de 7 mm), les artères de moyen calibre (de 2 à 7 mm), les artères de petit calibre (de 0,2 à 2 mm) et, enfin, les artérioles (de 30 à 200 μm). Les capillaires qui leur font suite ont un diamètre de 3,5 à 5,5 μm, plus petit que le diamètre des hématies, obligeant donc ces dernières à se déformer afin de passer du système artériel au système veineux. Le retour sanguin au cœur est ensuite assuré par les veinules post-capillaires (de 10 à 30 μm), qui forment des veinules collectrices de taille légèrement supérieure, puis les veines.
Histologie
La paroi des artères (fig. 7.5), comme celle des veines, est constituée de trois tuniques distinctes, qui sont, de la lumière vers la paroi externe : l’intima (tunique interne), la média (tunique moyenne) et l’adventice (tunique externe). La paroi vasculaire est constituée d’un revêtement endothélial, de tissu musculaire lisse et de tissu conjonctif. La proportion relative de la composante cellulaire musculaire lisse et de la composante de matrice conjonctive de la média permet de distinguer les artères musculaires des artères élastiques. En effet, au fur et à mesure qu’on s’éloigne de la racine de l’aorte, on observe une diminution du nombre de fibres élastiques de la paroi artérielle et son enrichissement en tissu musculaire. Il n’existe pas de limite nette entre artères élastiques et artères musculaires, mais on peut retenir que schématiquement les artères de grand calibre (aorte comme prototype) sont élastiques, tandis que les artères de moyen (coronaires épicardiques et artères rénales comme prototype) et de petit calibre (branches intraviscérales) sont musculaires. Une exception notable est l’artère mammaire interne qui est de type élastique alors qu’elle est de moyen calibre (utilisés pour les pontages aortocoronaires).
________________________________________________________________________________
Figure 7.5. Structure d’ensemble d’une aorte normale.
Intima très fine (flèche i), média (m) épaisse, adventice (a).
________________________________________________________________________________
Anatomopathologie
Athérosclérose
La plaque d’athérosclérose constitue le support lésionnel de la maladie athéroscléreuse. Elle siège dans les artères de gros et de moyen calibre : l’aorte, les premiers centimètres de ses branches à destinée viscérale, les artères des membres supérieurs jusqu’environ la moitié proximale de l’artère humérale, les artères des membres inférieurs jusqu’aux artères du pied, les artères cervicales et les artères intracrâniennes extra-encéphaliques. De la distribution des lésions athéroscléreuses dépend schématiquement l’expression viscérale prédominante de la maladie. Cependant, une plaque peut s’exprimer à distance de son siège dans un territoire viscéral bien en aval, par l’intermédiaire d’un processus embolique, correspondant à la migration d’un fragment de plaque et/ou de thrombus formé sur la plaque. À partir de la quatrième décennie, les plaques d’athérosclérose se développent et leur nombre augmente avec l’âge chez tous les individus, mais à un rythme très variable d’un individu à l’autre. Aussi la prise en charge individuelle d’un patient présentant des symptômes liés à la maladie athéroscléreuse doit-elle reconnaître la plaque d’athérosclérose coupable de la symptomatologie parmi un ensemble lésionnel de plusieurs plaques, dont la plupart sont asymptomatiques.
Aborder la maladie athéroscléreuse en parlant d’emblée de plaques d’athérosclérose, c’est se placer à une phase déjà avancée de la maladie, phase cliniquement asymptomatique ou déjà avec des manifestations cliniques, et c’est ignorer les lésions initiales de l’histoire naturelle de l’athérosclérose.
Histoire naturelle de l’athérosclérose
Grâce à des études épidémiologiques et anatomopathologiques effectuées chez des sujets jeunes (de 0 à 35 ans) décédés de causes non cardiovasculaires, un modèle d’histoire naturelle des lésions athéroscléreuses a pu être précisé, distinguant les lésions initiales des lésions avancées leur faisant suite. Ces études ont montré que les lésions initiales débutaient très tôt dans la vie, parfois observées dès la naissance, évoluaient dans le temps en termes d’extension, de site topographique préférentiel et de type de lésions. Au cours du temps, une partie des lésions initiales pourraient évoluer et prendre la forme de lésions avancées dont le prototype est la plaque d’athérosclérose, ou plaque fibrolipidique. Les lésions avancées sont toujours précédées par des lésions initiales et seulement une partie des lésions initiales aboutissent à des lésions évoluées. Les lésions aux différents stades de l’histoire naturelle de l’athérosclérose ont été classées par l’American Heart Association (AHA) et sont présentées dans le tableau 7.1.
Tableau 7.1. Définition des lésions aux différents stades de l’histoire naturelle de l’athérosclérose dans la classification de l’AHA.
| Types de lésions | Âge d’apparition habituel | Corrélations anatomocliniques | |
| Lésions précoces | Type I
Macrophages spumeux isolés |
0 à 10 ans | Absence complète de manifestations |
| Type II
Stries lipidiques : macrophages et quelques cellules musculaires lisses spumeuses |
0 à 10 ans | Aucune manifestation | |
| Type III
Stries lipidiques auxquelles se rajoute une discrète accumulation de lipides extracellulaires |
Âge intermédiaire, après 20 ans | Aucune manifestation | |
| Lésions avancées | Type IV
Athérome : formation d’un centre lipidique sans fibrose |
Après 40 ans | Manifestations cliniques possibles |
| Type V
Fibro-athérome – Va : centre lipidique avec chape fibreuse – Vb : en plus, calcifications – Vc : plaques athéroscléreuses fibreuses avec centre lipidique minuscule ou absent |
Après 40 ans | Manifestations cliniques possibles dépendant essentiellement du degré de sténose | |
| Type VI
Athérosclérose compliquée – VIa : ulcération – VIb : hématome ou hémorragie intraplaque – VIc : thrombose |
Après 40 ans | Manifestations cliniques possibles : fréquentes mais pas constantes |
Les lésions initiales sont typiquement représentées par le type II, caractérisé macroscopiquement par des stries lipidiques (fig. 7.6), consistant en l’accumulation d’un grand nombre de macrophages spumeux chargés de lipides dans l’intima des artères.
________________________________________________________________________________
Figure 7.6. Lésions de l’athérosclérose.
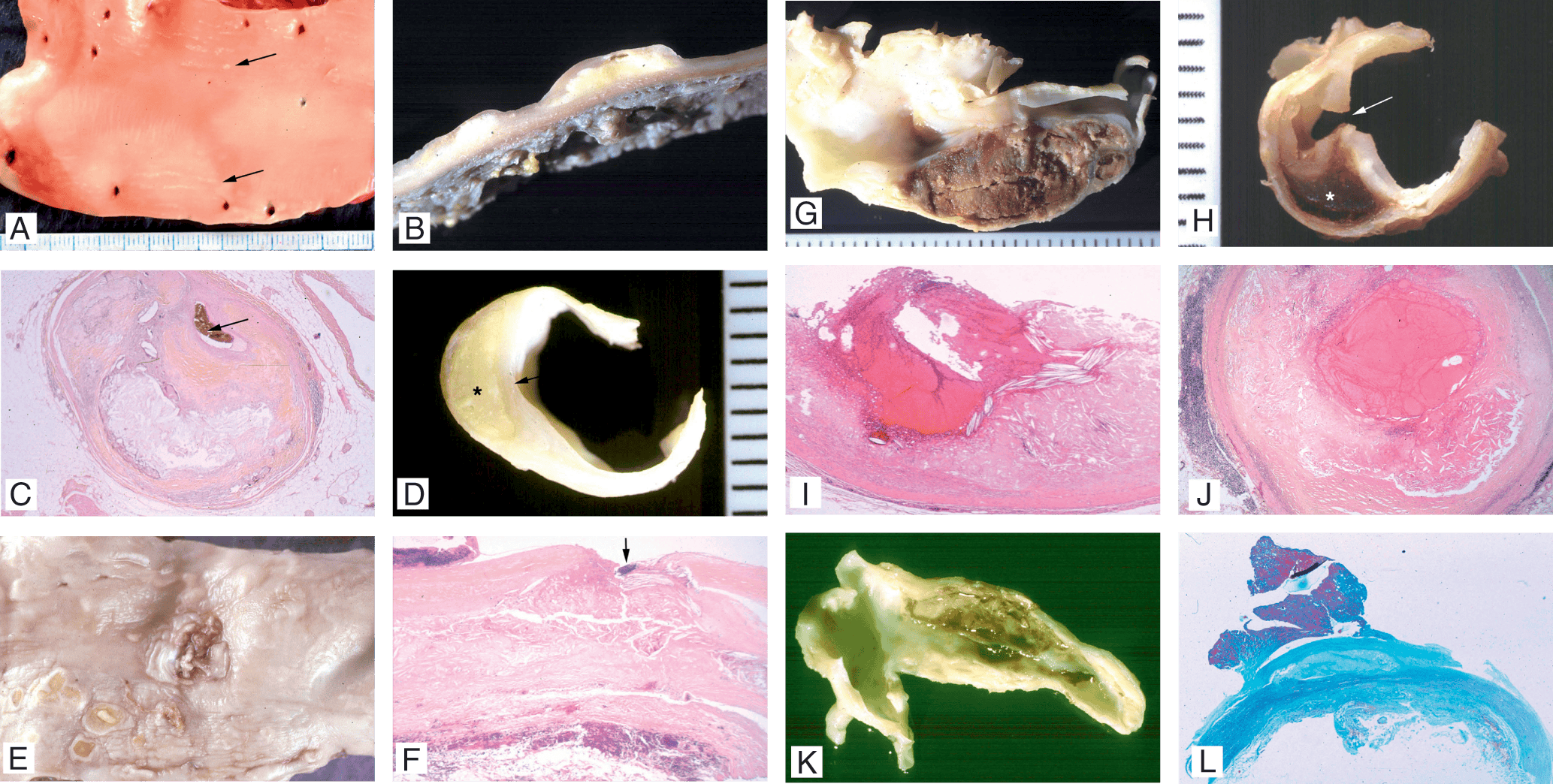
A. Aorte d’un sujet jeune ouverte longitudinalement. Présence de stries lipidiques (flèches) : il s’agit de lésions linéaires parallèlement au flux sanguin, jaunâtres, sans relief. B. Coupe d’une plaque d’athérosclérose aortique : lésions en relief constituées d’un centre lipidique jaunâtre surmonté d’une chape fibreuse. Il s’agit de la plaque fibro-lipidique non compliquée. C. Plaque d’athérosclérose sur une coronaire épicardique. Cette lésion est constituée d’un centre lipidique et d’une chape fibreuse épaisse. La lumière résiduelle est fortement sténosée (flèche). D. Plaque d’athérosclérose carotidienne. Il s’agit d’une plaque fibro-lipidique non compliquée avec un centre lipidique (étoiles) et en surface une chape fibreuse (flèche) lisse non ulcérée. E. Aorte d’un sujet âgé ouverte longitudinalement. Présence de multiples plaques d’athéroscléroses pour la plupart ulcérées apparaissant comme des cratères brunâtres. F. Coupe histologique d’une plaque athéroscléreuse aortique compliquée d’ulcération. La perte de substance (flèche) fait disparaître la chape fibreuse et expose le centre lipidique au sang circulant. G. Coupe longitudinale d’une bifurcation carotidienne. La paroi du bulbe carotidien est épaissie occupée par un volumineux hématome intraplaque. Cet hématome sténose fortement la lumière de la carotide. H. Coupe transversale d’une carotide interne. Présence d’une plaque d’athérosclérose compliquée d’une part d’ulcération (flèche) et d’autre part d’hématome intraplaque (étoile). I. Plaque d’athérosclérose carotidienne vue en histologie à faible grossissement. La plaque est ulcérée et la perte de substance est recouverte par un thrombus récent mural n’occluant pas totalement la lumière. J. Plaque d’athérosclérose sur une artère coronaire épicardique coupée transversalement. La lumière est occluse par un thrombus compliquant une plaque d’athérosclérose. K. Bifurcation carotidienne coupée longitudinalement. Sur le bulbe carotidien, il existe une plaque d’athérosclérose compliquée de thrombose murale. L. Plaque d’athérosclérose de la crosse aortique vue en histologie à faible grossissement. Il s’agit d’une plaque fibro-lipidique compliquée d’un volumineux thrombus pédiculé saillant dans la lumière aortique. Ce thrombus était la source d’embolies cérébrales.
________________________________________________________________________________
Ces lésions précoces ne s’accompagnent pas de manifestation clinique et n’ont pas de traduction en imagerie car de très faible volume et n’entraînent pas de modelage de l’artère. Dans ce modèle proposé par l’AHA, une partie de ces lésions disparaît au cours du temps (fin de la deuxième décennie et troisième décennie) et une autre partie va évoluer vers des lésions avancées.
Ce schéma d’athérogenèse est actuellement débattu car les stries lipidiques ne prédominent pas dans les territoires où se trouvent plus tard les plaques d’athérosclérose ; elles régressent au cours du vieillissement et n’ont aucun retentissement pathologique local sur le tissu artériel (pas de thrombose, pas de remodelage ni atteinte de la média). Pour certains, c’est l’épaississement intimal constitué de matrice extracellulaire et de cellules musculaires lisses migrées, sans centre nécrotique lipidique, qui peut se charger de lipides intra- et extracellulaires évoluant ainsi vers la plaque fibrolipidique.
Plaques d’athérosclérose, ou plaques fibrolipidiques (type V)
Ce type lésionnel ne résume pas toutes les lésions athéroscléreuses. C’est pourtant cette lésion qui était reconnue pendant près de 40 ans comme le type lésionnel unique décrit par l’OMS comme « une association variable de remaniements de l’intima des artères de gros et moyen calibre, consistant en une accumulation focale de lipides, de glucides complexes, de sang et de produits sanguins, de tissus fibreux et de dépôts calcaires, le tout s’accompagnant de modifications de la média ».
La plaque d’athérosclérose se développe avec l’âge et est observée habituellement à partir de 40 ans, parfois plus précocement, parfois plus tardivement selon les individus. C’est une lésion qui occupe du volume, bombant dans la lumière artérielle (fig. 7.6B), cette dernière caractéristique morphologique étant minorée par le remodelage artériel. La conséquence majeure de ce type lésionnel est son volume retentissant sur la lumière artérielle qui se sténose malgré le remodelage expansif qui accompagne la croissance de la plaque. Les lésions de type V volumineuses, sténosantes (fig. 7.6C), sont corrélées possiblement à des manifestations cliniques à l’effort.
La plaque fibrolipidique est une lésion plus ou moins étendue, plus ou moins saillante, de coloration jaunâtre sur le versant luminal de l’artère. Lorsqu’il existe plusieurs plaques dans un même territoire artériel, celles-ci sont séparées par un intervalle de paroi saine ou celles-ci peuvent confluer. La plaque est constituée d’un centre lipidique entouré de tissu fibreux, la chape fibreuse (fig. 7.6D). Le centre lipidique est constitué de cellules spumeuses (chargées de lipides), de lipides extracellulaires comprenant des aspects de cristaux de cholestérol, de cellules géantes, de macrophages et, parfois, de plages nécrotiques. La chape fibreuse qui entoure le centre lipidique est constituée de matrice extracellulaire collagène associée à des cellules musculaires lisses vasculaires migrées et à une minorité de macrophages. Ce type de plaque, quel que soit son volume, est revêtu à l’interface avec le sang par une couche continue de cellules endothéliales.
Dans la classification de l’AHA, on distingue trois sous-types :
- Va : classique plaque d’athérosclérose, ou plaque fibrolipidique ;
- Vb : caractérisée par la présence de calcifications dans la plaque ;
- Vc : caractérisée par l’absence ou la quasi-absence de centre lipidique, répondant à l’aspect de plaque fibreuse.
Quel que soit le volume de la plaque, la proportion relative de ces deux constituants, centre lipidique et chape fibreuse, est importante à considérer. En effet, il a été établi que des plaques d’athérosclérose avaient plus tendance à se compliquer que d’autres, et elles ont été individualisées sous le nom de « plaques à risque » ou « plaques vulnérables », ce risque étant celui de thrombose. Les caractéristiques morphologiques de ces plaques à risque de thrombose sont un volume proportionnellement important du centre lipidique, la finesse de la chape fibreuse séparant la lumière artérielle du centre lipidique, la présence de cellules inflammatoires au sein de la plaque. Ces caractéristiques morphologiques peuvent être observées sur des plaques quel que soit leur volume, en particulier sur des plaques peu sténosantes, donc moins mises en évidence par les techniques classiques d’imagerie vasculaire. L’équipe de Virmani a souligné l’intérêt pathologique de l’épaisseur de la chape fibreuse, distinguant ainsi des plaques à chape fibreuse épaisse (fibrous cap atheroma) et à chape fibreuse fine (thin fibrous cap atheroma) plus susceptibles de se compliquer de rupture (ulcération) et donc de se thromboser.
Plaques d’athérosclérose compliquées d’ulcération (type VIa)
Les lésions de type VI sont les lésions compliquées. La survenue de complications n’est pas strictement corrélée au volume ou au degré de sténose engendrée par la plaque : des plaques ulcérées peuvent être observées dans des sténoses modérées. Les corrélations anatomocliniques ont établi que les manifestations de repos à type d’infarctus du myocarde, d’angor instable, de mort subite sont sous la dépendance de lésions athéroscléreuses compliquées.
Le sous-type VIa, où la complication est une ulcération de la plaque, est caractérisé par une perte de substance à la surface de la chape fibreuse (fig. 7.6E). L’étendue et la profondeur de cette perte de substance sont extrêmement variables : microscopique, inaccessible aux moyens d’imagerie vasculaire, creusante mise en évidence en imagerie (fig. 7.6F). L’ulcération peut atteindre le centre lipidique qui est alors capable de migrer dans la circulation et de donner lieu à des embolies de cholestérol. Plus récemment, l’érosion, qui est une perte de substance extrêmement superficielle intéressant simplement l’endothélium et un peu de matrice extracellulaire sous-jacente, a été reconnue : elle a été mise en évidence dans les thromboses coronaires lors d’un cas de mort subite. Quelle que soit sa profondeur, l’ulcération fait perdre le revêtement endothélial thrombo-résistant et est nécessairement associée à une thrombose d’épaisseur variable.
Hémorragie ou hématome intraplaque (lésion de type VIb)
Il s’agit d’une complication fréquente, ubiquitaire, particulièrement notée dans le territoire carotidien dans le cadre des accidents vasculaires cérébraux (AVC). Il s’agit d’une collection sanguine à l’intérieur de la plaque d’athérosclérose envahissant le centre lipidique et produisant une augmentation de volume de la plaque (fig. 7.6G). L’hématome intraplaque est souvent associé à une ulcération, qui représente alors la porte d’entrée du sang qui fait issue dans la plaque via l’ulcération (fig. 7.6H). L’hémorragie intraplaque peut subir un processus d’organisation conjonctive contribuant à la croissance de la plaque. Si les traitements antithrombotiques (ex : aspirine) ont pour objectif de réduire le risque de développement de thrombose à la surface des plaques, certaines études récentes évoquent la possibilité d’un risque accru d’hématome intraplaque sous ces mêmes traitements.
Thrombose (lésion de VIc)
C’est la complication majeure de la plaque d’athérosclérose, responsable de la majorité des accidents ischémiques liés à l’athérosclérose. L’altération fonctionnelle du revêtement endothélial sur une plaque de type V ou la perte anatomique de l’endothélium lors d’une ulcération (type VIa) peuvent être responsables de thrombose, qui est la coagulation du sang localisée sur le site de la plaque qui se complique. La thrombose surmonte une ulcération (fig. 7.6I) qui correspond à un équivalent de croûte sur une plaie cutanée et donc un équivalent de processus hémostatique précicatriciel. La thrombose peut être occlusive (fig. 7.6J) obstruant les artères, essentiellement dans les territoires de moyen calibre, ou elle peut être murale, c’est-à-dire pariétale non occlusive, laissant persister un flux sanguin. Le thrombus est un matériel noirâtre (fig. 7.6K) qui peut subir une organisation conjonctive ; le thrombus organisé contribue alors à l’augmentation du volume de la plaque.
Un autre mode évolutif des plaques athéroscléreuses compliquées de thrombose est la fragmentation du thrombus. Ces fragments suivent le cours de la circulation sanguine, ce qui donne lieu à des embolies thrombotiques qui se bloquent dans les artères de moyen ou petit calibre à distance de la plaque et peuvent donner lieu à des manifestations ischémiques, notamment si la circulation est terminale et sans suppléance par la circulation collatérale. Ces dernières années, le rôle de l’athérosclérose de l’aorte thoracique ascendante et horizontale compliquée de thrombose a été mis en évidence comme source d’embolie cérébrale. L’absence de calcifications de la plaque et les caractères volumineux ou mobile du thrombus (fig. 7.6L) surmontant la plaque sont considérés comme des facteurs de risque d’une migration embolique. Plus récemment, les emboles comprenant des fragments de plaque et de thrombus ont été mis en évidence comme venant de manière prédominante au niveau de l’aorte descendante, avec une embolisation en aval pouvant être subintrant et ne se manifestant que par des défaillances au long cours (ex : insuffisance rénale).
Anévrysmes
Un anévrysme est défini comme une dilatation focalisée et permanente d’une artère d’au moins de 50 % comparativement à son diamètre normal. On note alors une perte de parallélisme des parois de l’artère. Les anévrysmes peuvent se développer sur l’ensemble de l’arbre artériel. On distingue les vrais anévrysmes des faux anévrysmes. Les vrais anévrysmes sont la conséquence d’une fragilité localisée de la paroi artérielle. Les faux anévrysmes (encore appelés pseudo-anévrysmes) sont les résultats d’un traumatisme de la paroi artérielle avec une extravasation sanguine contenue par les tissus environnants. Il faut également différencier les vrais anévrysmes des artériomégalies (dilatation diffuse de l’artère sans perte de parallélisme puisque l’artère est dilatée sur tout son trajet).
Les deux extrémités de l’anévrysme sont appelées collet inférieur et supérieur, correspondant à la jonction entre l’artère malade et saine.
Les anévrysmes sont aussi classés selon leur forme. Les anévrysmes fusiformes sont caractérisés par une dilatation symétrique de l’ensemble de la paroi. Les anévrysmes sacciformes sont caractérisés par une dilation asymétrique, ne concernant qu’une partie de la paroi artérielle.
Un anévrysme a tendance spontanément à augmenter de volume et à s’aggraver, en effet, l’artère perd progressivement sa capacité à lutter contre la distension. Pour les anévrysmes de l’aorte par exemple, la vitesse de croissance sera d’autant plus grande que le diamètre aortique est élevé.
Les anévrysmes de l’aorte abdominale sont les plus fréquents : 5 %-16 % chez l’homme et 0,7 % à 2 % chez la femme. Ils peuvent être associés à des anévrysmes iliaques communs, iliaques internes, et poplités. Les anévrysmes sont souvent confondus avec les dissections, qui sont un autre type de pathologie. La dissection est une pathologie le plus souvent aiguë, qui s’accompagne d’une séparation mécanique des tuniques de la paroi artérielle. La dissection est la conséquence d’une rupture de l’intima, qui entraîne la formation d’un nouveau chenal par effraction de sang entre l’intima et la média.
Biologie cellulaire, biochimie
La coagulation est une succession de réactions enzymatiques permettant une activation des facteurs de la coagulation afin d’aboutir, dans une dernière étape, à activer la prothrombine (facteur II) en thrombine (facteur IIa). Cette dernière active alors le fibrinogène circulant pour former un réseau de fibrine insoluble qui participera avec les plaquettes à la formation d’un thrombus beaucoup plus résistant que le clou plaquettaire issu de l’hémostase primaire (chapitre 1).
Physiologie (voir aussi chapitre 1 Physiologie, Circulation systémique)
Bases physiques de la circulation
Facteurs déterminants de la circulation
Nous pouvons distinguer trois facteurs principaux qui déterminent la circulation sanguine : le débit cardiaque et le débit sanguin.
Débit cardiaque pulsé
Le premier des trois facteurs qui influencent et déterminent la circulation sanguine est le débit cardiaque pulsé. Il se définit comme le volume de sang éjecté par le ventricule gauche dans l’aorte chaque minute, et s’exprime en litres par minute.
La valeur du débit cardiaque est en moyenne de 5 l/ min chez l’homme au repos, cette valeur est un peu plus faible chez la femme. À l’effort cette valeur peut s’élever jusqu’à 30 l/min. Il dépend de deux paramètres, la fréquence cardiaque (Fc) et le volume d’éjection systolique (VES). À noter que la vitesse du flux sanguin (en cm/s) est inversement proportionnelle à l’aire de la section transversale du vaisseau sanguin considéré pour un débit donné.
On peut également calculer l’index cardiaque, égal au quotient du débit cardiaque par la surface corporelle s’exprimant en l/min/m2.
Pression sanguine et pression artérielle (PA)
Le deuxième facteur qui influence et détermine la circulation sanguine est la pression exercée par le sang. Il nous faut ici distinguer la pression hydrostatique et la pression hydrodynamique.
Pression hydrostatique
La première loi de pression d’un fluide, énoncée par Pascal (1623–1662), établit qu’il existe une pression hydrostatique qui agit dans toutes les directions. Le sang, en tant que fluide, exerce une pression hydrostatique qui est absolument indépendante de la pression dynamique puisqu’elle est présente lorsque le sang est immobile, mais peut venir s’y ajouter selon la posture et les vaisseaux considérés. À ce titre, en position debout elle est positive pour tous les vaisseaux situés au-dessous du plan du cœur et négative pour tous ceux situés au-dessus.
Pression hydrodynamique
Un fluide qui se déplace exerce une pression supplémentaire en fonction de sa vitesse de déplacement. La pression hydrodynamique endovasculaire est une des forces qui permettent au sang de circuler dans tous les vaisseaux. Lorsqu’il s’agit de l’aorte et des artères systémiques, on parle de pression sanguine artérielle. La pression hydrodynamique est liée à l’activité du cœur, d’où son caractère dynamique. De ce fait, la pression hydrodynamique endovasculaire moyenne diminue de l’aorte aux capillaires et des capillaires jusqu’à l’atrium droit du cœur.
Résistance au débit
Le troisième facteur qui influence et détermine la circulation sanguine est la résistance R, c’est-à-dire la force qui s’oppose au débit sanguin.
Selon les travaux de Poiseuille (1797–1869), R dépend du rayon des vaisseaux sanguins r, de la viscosité du sang μ et de la longueur des vaisseaux sanguins L :
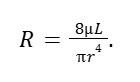
Ainsi, la résistance au débit sanguin est directement proportionnelle à la viscosité du sang et à la longueur des vaisseaux sanguins, et inversement proportionnelle à la puissance 4 du rayon moyen des vaisseaux sanguins.
Principales lois hémodynamiques
Nous allons développer deux lois, la loi de Darcy et le théorème de Bernoulli.
Loi de Darcy
Darcy (1803–1858) a établi la relation entre débit, pression et résistance. Il a montré que le débit est linéairement proportionnel à la différence de pression entre deux points Q = K (P1 – P2), avec K appelé conductance hydraulique. La résistance est l’inverse de la conductance hydraulique R = 1/K.
Dans la circulation systémique, la pression de conduction qui correspond à la différence de pression qui permet au débit de s’écouler est représentée par la pression artérielle moyenne (PAM) moins la pression veineuse centrale (PVC). Ainsi, le débit cardiaque Qc = (PAM – PVC)/RPT, où RPT est la résistance périphérique totale. Étant donné que PVC est proche de zéro, l’expression peut être simplifiée, donnant Qc = PAM/RPT, ou PAM = Qc × RPT. Par conséquent, si la résistance était fixe, la pression serait en théorie une fonction linéaire du débit et inversement.
Théorème de Bernoulli et énergie mécanique totale d’un fluide
La pression utilisée dans la formule de Darcy n’est qu’une des trois formules d’énergie mécanique affectant le débit sanguin. Les deux autres formes d’énergie sont l’énergie potentielle et l’énergie cinétique. Le théorème de Bernoulli établit que le débit est proportionnel à la différence d’énergies mécaniques totales du fluide entre ces deux mêmes points. L’énergie E correspond à la somme de l’énergie de pression, de l’énergie potentielle et de l’énergie cinétique, soit la formule E = P + pgh + pv2/2 :
- P représente l’énergie de pression (EPr) qui est égale à la pression par le volume (P × V), énergie de pression qui est uniquement prise en compte dans la loi de Darcy et a fortiori dans celle de Poiseuille ;
- pgh est l’énergie potentielle (EPo), qui est égale à la densité d’un fluide par la hauteur par l’accélération due à la pesanteur g ;
- pv2/2 représente l’énergie cinétique (Ec) qui est bien sûr l’énergie qu’une masse en mouvement possède du fait de son déplacement ;
EPr et Ec sont interconvertibles : EPr peut se convertir en Ec, et inversement. Ce qui permet de comprendre que le débit s’effectue davantage avec ΔE qu’avec uniquement ΔP.
Mode d’écoulement du sang
Le sang, lorsqu’il s’écoule, peut adopter deux types d’écoulement, l’écoulement laminaire et l’écoulement turbulent. Lorsque l’écoulement sanguin est laminaire, les différentes couches du sang se déplacent de façon tout à fait ordonnée en glissant les unes sur les autres de manière strictement parallèle. Lorsque l’écoulement sanguin est turbulent, les différentes couches de sang se déplacent de manière totalement désordonnée et les profils de vitesse deviennent complètement anarchiques. L’écoulement turbulent s’accompagnant d’une diminution de l’énergie totale du fluide. Le caractère laminaire ou turbulent de l’écoulement est fonction du nombre de Reynolds (Re), selon la loi de l’ingénieur anglais (1842–1912) du même nom qui établit que :
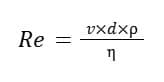
où v est la vitesse du fluide, d le diamètre du vaisseau, ρ la densité du fluide et η la viscosité du fluide. La turbulence de l’écoulement est donc favorisée par les trois premiers facteurs et limitée par la viscosité du fluide. Chez l’homme, l’écoulement sanguin dans le lit vasculaire sain est laminaire, excepté dans les ventricules et dans l’aorte.
L’écoulement sanguin peut être aussi turbulent dans certaines situations physiopathologiques affectant les vaisseaux sanguins, comme la présence d’une sténose artérielle occasionnant un rétrécissement du calibre du vaisseau. Le passage d’un écoulement laminaire à un écoulement turbulent modifie la relation débit-pression. Le débit n’augmente plus selon une fonction linéaire avec la pression, mais seulement avec la racine carrée de la pression, puisqu’un écoulement turbulent s’accompagne d’une diminution de l’énergie mécanique totale : à débit identique, ΔP amont-aval est plus important, ou, à ΔP identique, le débit assuré est moindre.
Débit dans les différents territoires
Un débit correspond à un volume de fluide par unité de temps. L’adaptation séparée des différents débits d’organe permet de fournir une réponse adaptée propre à chaque organe, en fonction de ses besoins et, pour certains, d’assurer le maintien de la pression artérielle. La loi de Poiseuille est donc applicable au système circulatoire, notamment dans les systèmes à haute pression, bien que le sang ne soit pas un liquide visqueux et que le flux ne soit pas laminaire. Par ailleurs, le débit moyen est égal au produit de la vitesse moyenne et de section du vaisseau considéré (πr2).
Veines et circulation pulmonaire
Les territoires veineux sont des territoires à basse pression, basses résistances et faibles vitesses de circulation avec quelques différences selon les territoires considérés. Le débit de l’ensemble des veines est égal à celui du cœur. Le retour veineux est possible grâce à la pression dynamique et à l’activité du ventricule gauche, mais aussi à l’activité des muscles, des valvules veineuses, du cœur droit et du diaphragme, via les mouvements respiratoires. Le système pulmonaire est un système où règnent une pression faible et constante et des résistances faibles. Quand le débit augmente, les résistances diminuent. Il s’agit d’une circulation fonctionnelle, dont le débit moyen est équivalent à celui du cœur.
En cas de faible augmentation de pression, le nombre des capillaires ouverts augmente et ceci de façon passive. L’hypoxie entraîne par ailleurs une vasoconstriction permettant une adaptation entre la ventilation et la perfusion.
Microcirculation
Le système microcirculatoire est un système à basse pression (environ 35–25 mm Hg). Il est composé d’artérioles, de capillaires et de veinules. C’est un système de basses résistances, faibles vitesses de circulation et où le régime d’écoulement est non pulsatile. Ce réseau est complexe et a de nombreuses anastomoses. Il assure les échanges : diffusion passive pour les gaz et les ions en fonction de leur concentration de part et d’autre de la paroi vasculaire, filtration-réabsorption pour l’eau en fonction des valeurs de pression hydrostatique et de pression oncotique à l’entrée et à la sortie des capillaires, diffusion pour les molécules liposolubles, traversée de pores pour les molécules non liposolubles. Le contrôle vasomoteur sympathique n’est actif que sur l’artériole afférente. Le débit du système microcirculatoire est égal à celui du cœur. Ce système assure aussi la thermorégulation grâce aux anastomoses artérioveineuses.
Artères
Coronaires
Le cœur est toujours en activité et 80 % de la perfusion coronaire s’effectue pendant la diastole (débit assuré pendant la diastole par la coronaire gauche, débit continu à renforcement diastolique pour la coronaire droite). L’extraction en O2 est permanente et supérieure à 60 %. En cas d’effort, le seul moyen d’augmenter l’apport en O2 est d’augmenter le débit coronaire. Cela est possible grâce à une autorégulation par vasorelaxation induite par les métabolites (acidose, hypercapnie, hypoxie et surtout augmentation de l’ADP). Le cœur est capable d’utiliser d’autres substrats, comme les acides gras, le glucose, les lactates. Le débit coronaire n’intervient pas dans l’homéostasie de la PA.
Territoires artériels musculaires
Au repos, les résistances des territoires musculaires sont élevées et diminuent en cas d’effort. L’apport nutritif, l’élimination des déchets et les calories sont assurés par une vasorelaxation induite par les métabolites. Les débits musculaires participent au maintien de la pression artérielle grâce au baroréflexe.
Cerveau
N’ayant pas de réserve énergétique, le cerveau doit recevoir un apport constant en O2 et en glucose. Le débit sanguin cérébral est en moyenne de 50 ml/min /100 g de cerveau chez l’adulte. Ce débit est régulé grâce aux capacités vasomotrices (vasodilatation et vasoconstriction) des artères cérébrales. Ces possibilités de variation des résistances vasculaires permettent ainsi de constituer une véritable réserve sanguine rapidement disponible. Outre cette réserve hémodynamique, il est possible d’améliorer les possibilités d’extraction de l’oxygène du sang. En effet, à l’état basal l’extraction de l’oxygène n’est pas maximale et peut donc être portée à 100 % en cas de besoin.
L’infarctus cérébral est la résultante de la diminution puis de l’arrêt de la perfusion du tissu cérébral ainsi que du dépassement des capacités des systèmes de suppléance. À l’échelon individuel, la gravité de l’expression clinique d’une occlusion artérielle sera donc fortement dépendante d’une part de la qualité des réseaux anastomotiques présents et d’autre part des capacités d’autorégulation du débit sanguin cérébral. Le débit est constant pour une pression artérielle systémique allant de 60 à 180 mm Hg grâce à l’autorégulation qui persiste après désafférentation : quand la pression artérielle augmente, les résistances des artères cérébrales augmentent, ce qui permet au débit de rester stable, et inversement.
Ces mécanismes de protection sont mis en œuvre dès que le débit sanguin cérébral est inférieur à 50 ml/min/100 g de cerveau. Si celui-ci atteint des valeurs de 20 ml/min/100 g de cerveau, le métabolisme cellulaire est alors altéré, ce qui se traduit par la survenue de symptômes neurologiques. Entre 15 et 10 ml/min/100 g de cerveau, la zone d’oligémie maximale tolérée est atteinte. On parle alors de zone de pénombre ischémique. En revanche, si cet état se prolonge plus de quelques dizaines de minutes, on passe au stade de nécrose tissulaire. Cette nécrose irréversible survient aussi lorsque le débit sanguin cérébral est maintenu plus de 3 minutes à moins de 10 ml/min/100 g de cerveau.
La zone dite de pénombre ischémique est importante à considérer en thérapeutique, non pas en termes de localisation mais plutôt en termes de fenêtre temporelle où les lésions ischémiques pourraient être réversibles. La plupart des auteurs s’accordent actuellement pour un délai maximum d’environ 3 heures.
Territoire splanchnique (vascularisation digestive)
À l’état de repos, le système splanchnique a un métabolisme élevé et consomme 50 % de l’O2 total. En cas d’ingestion alimentaire, l’ADP provoque une vasodilatation entraînant une augmentation du débit de la veine porte et une diminution du débit de l’artère hépatique. Le débit étant également régulé par le système sympathique, le système splanchnique intervient dans la régulation de la pression artérielle.
En cas d’effort musculaire, la baisse des résistances musculaires est contrebalancée par une vasoconstriction splanchnique.
En cas d’hémorragie, la chute de la pression artérielle est limitée par une vasoconstriction splanchnique.
Reins
Les reins sont les organes les plus vascularisés. Il s’agit d’un territoire à basses résistances qui est, à l’exception des capillaires, sous la dépendance du système sympathique. Néanmoins, le débit rénal participe peu à l’homéostasie de la pression artérielle. Le débit rénal s’autorégule : quand la pression artérielle rénale augmente, les résistances rénales augmentent et le débit rénal reste constant. Cette autorégulation est indépendante du système sympathique et du métabolisme rénal.
Circulation dans un système à haute pression
La pression artérielle permet l’écoulement du sang du cœur vers la périphérie et de la périphérie vers le cœur. Elle dépend de l’éjection systolique du ventricule gauche, des modifications systolodiastoliques liées à l’activité cardiaque et des résistances périphériques. Elle doit se maintenir à des valeurs suffisamment élevées et stables pour permettre le fonctionnement des organes. Elle est soumise à un système de régulation précis et permanent. La pression intravasculaire diminue progressivement de la sortie du ventricule gauche (de la naissance de l’aorte) jusqu’à l’atrium droit (encore appelé oreillette droite)
Pression artérielle
Voir chapitre 2.1, Physiologie : la pression artérielle systémique et sa régulation.
Sémiologie vasculaire
Interrogatoire du patient
Comme pour d’autres maladies, l’interrogatoire du patient vasculaire est le premier temps de l’examen clinique.
Afin d’être à l’écoute du patient, il apparaît important d’interroger d’abord le patient sur ses motifs de consultation en recueillant en particulier ses symptômes. Les antécédents et facteurs de risque cardiovasculaire seront à recueillir dans un second temps, ce qui permettra d’ailleurs de moduler la probabilité clinique de l’origine cardiovasculaire des symptômes (probabilité prétest, essentielle à évaluer avant d’intégrer les résultats post-test, après les explorations paracliniques).
L’analyse des symptômes vasculaires doit être précise. En cas de douleur, il faudra préciser le type de douleur, la topographie, l’intensité et le mode évolutif. En pathologie vasculaire, les circonstances d’apparition de la douleur sont le plus souvent informatives (par exemple, la claudication intermittente artérielle apparaît à la marche).
En règle générale, l’artériopathie se manifeste par une souffrance tissulaire d’aval, alors que la maladie veineuse se manifeste par des symptômes en amont.
Il est important d’interroger le patient sur ses symptômes au repos mais aussi à l’effort (angor d’effort, claudication et périmètre de marche). Il est également important de l’interroger sur son mode de vie : personne âgée grabataire, patient sédentaire, patient actif, sportif car cela va changer l’interprétation des symptômes décrits.
Les antécédents, particulièrement les antécédents cardiaques et vasculaires périphériques, sont à rechercher, y compris des antécédents évocateurs d’accidents ischémiques transitoires, voire d’accidents ischémiques cérébraux passés inaperçus (sans oublier les symptômes ophtalmiques).
Il faudra rechercher les facteurs de risque d’athérosclérose : âge, sexe masculin, hypertension artérielle, dyslipidémie (hypercholestérolémie et baisse du HDL-cholestérol), tabagisme, diabète, sédentarité, surpoids ou obésité, syndrome métabolique.
Le recueil des antécédents familiaux est également précieux, car les maladies vasculaires présentent souvent un risque familial. C’est le cas de la maladie athéroscléreuse, où un antécédent de maladie coronaire chez un parent du premier degré de moins de 55 ans de sexe masculin ou de moins de 65 ans de sexe féminin augmente le risque cardiovasculaire. Les antécédents d’AVC ou d’artériopathie des membres inférieurs sont également à recueillir.
Il faut aussi recueillir les traitements pris par le patient pouvant renseigner sur ses antécédents (antihypertenseur, diurétiques, statines, antithrombotiques…)
Examen physique
Il commence par le relevé de la pression artérielle aux deux bras avec recherche d’une éventuelle asymétrie tensionnelle, de la fréquence cardiaque et des données morphométriques (taille et poids permettant de calculer l’indice de masse corporelle, mesure du tour de taille).
L’inspection appréciera l’aspect global du membre : recherche de pâleur, de cyanose, de livedo, de dermite ocre, recherche de l’existence de troubles trophiques, d’ulcères ainsi que leur localisation.
L’examen du réseau veineux superficiel s’effectue d’abord en décubitus, puis le sujet debout.
La palpation doit être bilatérale et comparative. Elle doit rechercher une asymétrie de température entre les membres.
La recherche des pouls périphériques est un temps essentiel de l’examen clinique : aussi bien aux membres supérieurs (pouls axillaire, huméral, radial et ulnaire) qu’aux membres inférieurs (pouls fémoral, poplité, tibial postérieur et pédieux), mais également pouls temporal ou carotide, etc. L’existence d’une asymétrie de perception de pouls, voire l’abolition d’un pouls, témoigne le plus souvent de lésions artérielles d’amont.
On recherchera l’existence d’une masse battante et extensive faisant suspecter la présence d’une lésion anévrysmale, particulièrement de l’aorte abdominale (palpation abdominale) ou de l’artère poplitée (aux creux poplités).
L’auscultation recherchera la perception d’un souffle qui traduit une modification de l’écoulement du flux dans le vaisseau.
Un examen neurologique doit également être réalisé (déficit moteur ou sensitif, troubles visuels ou phasiques).
Examens complémentaires
Prise des pressions systoliques à la cheville et calcul des index de pression systolique (IPS)
Ces mesures doivent faire partie de l’examen clinique de routine et systématique de tout patient athéromateux.
La technique consiste à :
- mesurer la pression artérielle au niveau huméral, aux deux bras ;
- à l’aide d’un stylo Doppler continu, repérer l’artère pédieuse (sur le dos du pied), puis l’artère tibiale postérieure (en rétromalléolaire interne) ;
- positionner le brassard à pression artérielle à la cheville du patient et gonfler jusqu’à 30 mm Hg au-dessus de la pression humérale, ce qui abolit normalement le flux des artères pédieuse et tibiale postérieure. On dégonfle alors le brassard et la réapparition du flux détermine la pression systolique de l’artère mesurée.
Les limites de cette technique sont qu’en cas de médiacalcose (maladie calcifiante de la média, différente de l’athérosclérose, survenant principalement chez les sujets âgés diabétiques ou insuffisants rénaux), les artères sont incompressibles et, dans ce cas, ne peuvent être évaluées par la prise des pressions systoliques distales.
L’index de pression systolique (IPS) correspond au rapport entre la pression systolique de cheville sur la pression systolique humérale (fig. 7.7). Les valeurs normales se situent entre 1 et 1,4. Au-dessus de 1,4, on suspecte la médiacalcose. Un index de pression systolique < 0,90 définit l’existence d’une artériopathie oblitérante des membres inférieurs, dont nous détaillons la classification ci-dessous. Un IPS entre 0,90 et 1,0 est considéré comme limite.
________________________________________________________________________________
Figure. 7.7. Index de pression systolique.

________________________________________________________________________________
Mesure de la pression artérielle systolique digitale
Cette technique utilise l’effet Doppler à partir d’un faisceau laser et permet, grâce aux capteurs placés au niveau de la pulpe d’un doigt ou d’un orteil, de mesurer la pression artérielle systolique digitale. Au niveau des orteils, la pression est normalement supérieure à 60 mmHg.
Mesure de la pression transcutanée en oxygène
La mesure de la pression transcutanée en oxygène (TCPO2) fournit une appréciation chiffrée de l’oxygénation tissulaire grâce à une électrode polarographique placée sur la peau de l’avant-pied. Contrairement à la mesure des pressions systoliques à la cheville, la TCPO2 est réalisable en cas de médiacalcose. Ses valeurs normales sont de 70 mm Hg environ. Cette mesure permet d’évaluer la compensation métabolique de l’artériopathie.
Capillaroscopie
Cette technique consiste à visualiser au microscope optique la microcirculation superficielle. La capillaroscopie péri-inguéale permet la visualisation des capillaires du lit de l’ongle et de caractériser les perturbations microcirculatoires des acrosyndromes vasculaires (fig. 7.8A). Sa principale utilité réside dans la microangiopathie sclérodermique, où on observe des dilatations importantes et multiples des capillaires (mégacapillaires) associées à une diminution hétérogène de la densité capillaire et une désorganisation de l’arrangement des boucles (fig. 7.8B).
________________________________________________________________________________
Figure 7.8. Exemples de capillaroscopies.
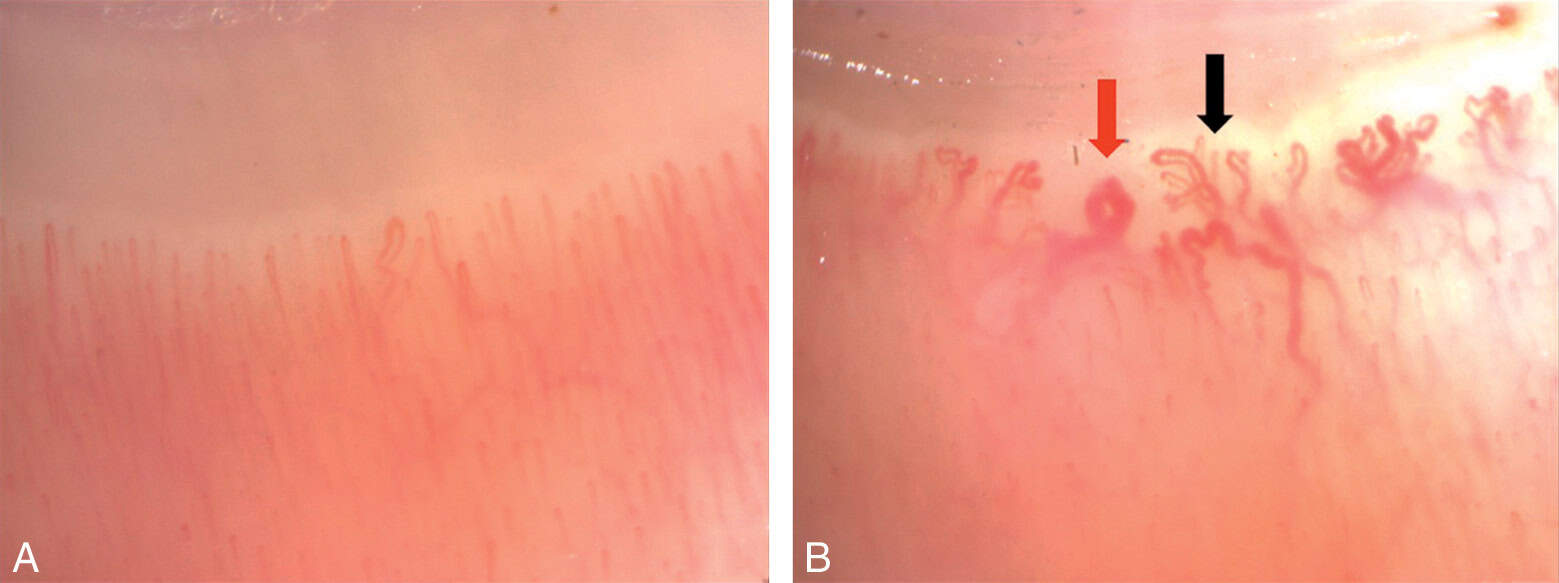
Capillaroscopie normale. B. Capillaroscopie pathologique avec des mégacapillaires (flèche rouge) et des capillaires en buissons (flèche noire).
________________________________________________________________________________
Échographie vasculaire couplée au Doppler
Réalisée par des sondes de fréquence variable, en fonction de la profondeur des vaisseaux étudiés, l’écho-Doppler permet une étude morphologique (plaques athéromateuses, sténoses, anévrysmes, recherche d’une circulation collatérale…) et hémodynamique (études des flux et donc du retentissement des sténoses sur la circulation) des axes artériels et veineux de la région du cou, des membres supérieurs, de l’aorte abdominale et de ses branches, et des artères et veines des membres inférieurs. On peut également utiliser l’écho-Doppler pour explorer les vaisseaux intracrâniens.
L’écho-Doppler permet, avec une bonne fiabilité, et par un opérateur expérimenté, une étude non invasive de la vascularisation.
Angio-scanner et angiographie par résonance magnétique nucléaire (ARM)
Ces techniques d’imagerie sont de plus en plus utilisées pour l’exploration morphologique des vaisseaux du corps.
Le scanner spiralé est très performant pour l’analyse de la lumière vasculaire, mais cet examen n’est pas réalisé en première intention en raison de son caractère irradiant et de la nécessité d’injecter un produit de contraste iodé.
L’ARM est également très performante et a l’intérêt de ne pas nécessiter l’injection de produit de contraste iodé, mais elle reste une exploration coûteuse et moins accessible. L’ARM ne visualise pas les calcifications artérielles mais elle permet de mieux visualiser les artères de la jambe.
Ces deux examens sont réalisés le plus souvent en seconde intention, après que l’imagerie par ultrasons retrouve des lésions nécessitant une intervention. Elles ont l’intérêt de présenter l’arbre artériel dans son ensemble, ce qui rend la décision et la stratégie d’intervention (par exemple revascularisation par angioplastie ou par pontage) plus aisée.
Artériographie et phlébographie
Ces examens restent les examens de référence dans l’exploration morphologique des réseaux artériels et veineux, mais sont en pratique très peu indiqués, sauf lors de la réalisation d’un geste endovasculaire sous contrôle radioscopique. Ils permettent une analyse précise de l’ensemble des axes vasculaires. Toutefois, ils restent des examens invasifs, nécessitant également l’injection de produit de contraste, avec un risque de plus en plus faible mais toujours présent de complications du cathétérisme au point de ponction (hématome, pseudoanévrysme artériel, fistule artérioveineuse, dissection artérielle, embolie périphérique, etc.). L’injection de produit de contraste iodé peut également entraîner une insuffisance rénale.
L’artériographie est le plus souvent réalisée immédiatement avant un geste de revascularisation percutanée ou chirurgicale. La phlébographie n’est réalisée qu’exceptionnellement, dans le cadre d’études cliniques.
Principales présentations cliniques
Anévrysmes artériels
Anévrysme de l’aorte abdominale
Diagnostic
L’anévrysme artériel correspond à une dilatation localisée et permanente d’un segment d’une artère, avec une perte de parallélisme des parois. Les anévrysmes de l’aorte abdominale sont les plus fréquents de tous les anévrysmes artériels (environ 60 % d’entre eux), puis viennent les anévrysmes des artères poplitées et de l’aorte thoracique.
Le diamètre moyen d’une aorte chez un adulte se situe entre 1,4 et 2 cm. On parle d’anévrysme de l’aorte abdominale au-delà de 3,5 cm chez l’homme et de 3 cm chez la femme. La principale cause des anévrysmes de l’aorte abdominale est l’athérosclérose. Des étiologies infectieuses, génétiques (maladie de Marfan) ou inflammatoires sont plus rares.
Les circonstances de découverte d’un anévrysme de l’aorte abdominale sont majoritairement fortuites puisque, sauf en cas de complication, l’anévrysme de l’aorte abdominale est le plus souvent asymptomatique. L’examen clinique devra rechercher une masse battante abdominale, pulsatile, expansive et non douloureuse, médiane ou légèrement latéralisée à gauche. Habituellement, l’anévrysme se situe au niveau de l’aorte abdominale sous-rénale et on apprécie sa localisation par le signe clinique de De Bakey (possibilité de glisser le tranchant de la main entre le pôle supérieur de la masse et l’auvent costal).
On recherchera l’existence d’un anévrysme poplité associé — association fréquente entre anévrysme de l’aorte abdominale et anévrysme poplité, présente dans environ 25 % des cas — en palpant les pouls poplités, apparaissant sous la forme d’une masse battante et expansive.
Les examens complémentaires utiles sont, en premier lieu, l’écho-Doppler de l’aorte abdominale, qui est un examen simple, peu coûteux et non invasif, très utile au dépistage et au suivi d’un anévrysme de l’aorte abdominale. Il permet de mesurer de façon fiable et facile le diamètre maximal de l’anévrysme, son extension en hauteur et son siège par rapport aux artères rénales.
L’angioscanner abdominal (fig. 7.9) est le meilleur examen complémentaire pour évaluer l’anatomie de l’anévrysme : sa taille précise, son extension en hauteur, ses rapports avec les artères rénales (collet de l’anévrysme). Il est nécessaire en préopératoire pour déterminer la stratégie thérapeutique (chirurgie ouverte ou endovasculaire). Il sera remplacé par une angio-IRM en cas d’allergie à l’iode ou d’insuffisance rénale chronique sévère.
________________________________________________________________________________
Figure 7.9. Angioscanner visualisant un anévrysme de l’aorte abdominale.

A. Reconstruction scanographique 3D. B. Coupe sagittale.
________________________________________________________________________________
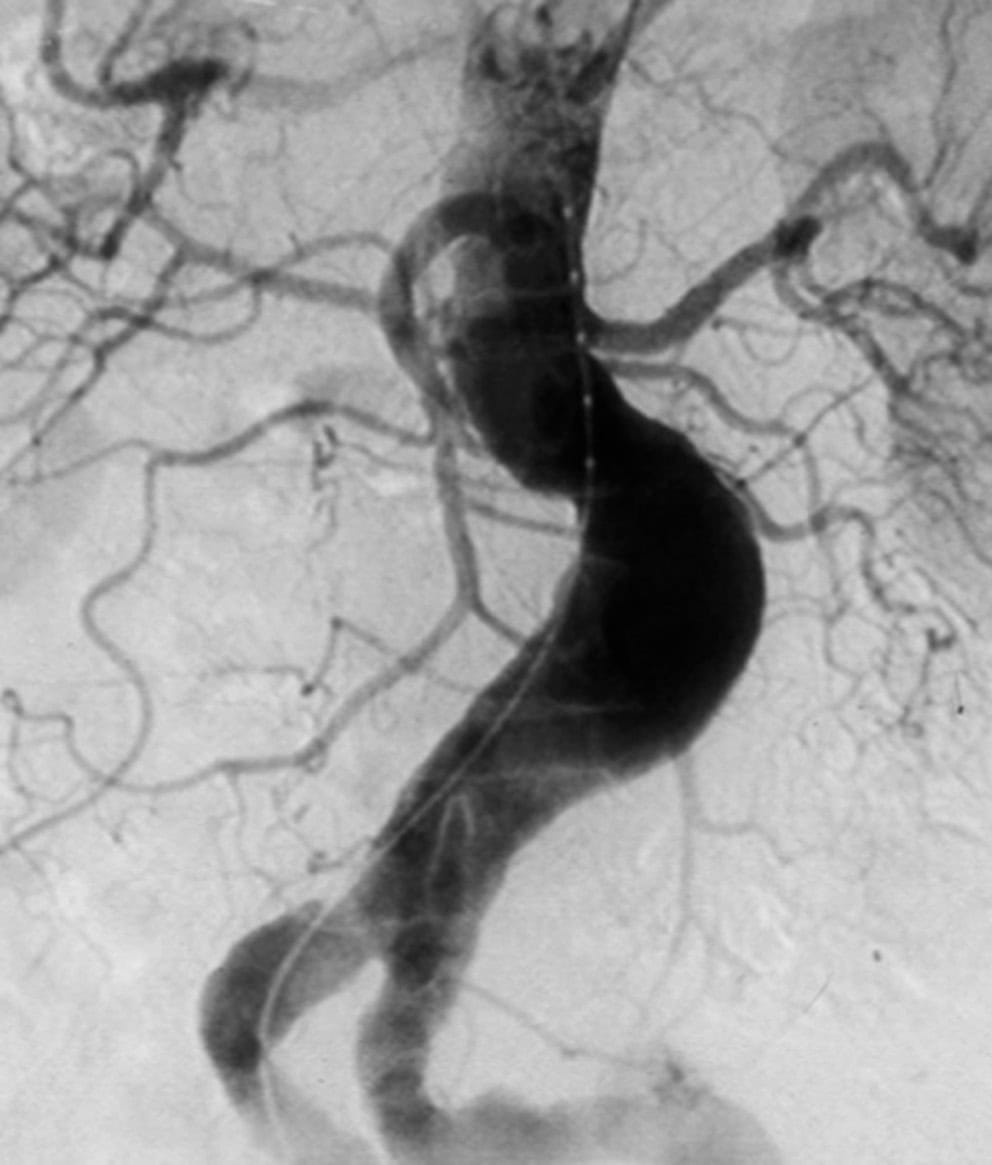
L’aorto-artériographie (fig. 7.10) n’a plus d’indication avant la cure d’un anévrysme de l’aorte abdominale, car elle ne permet pas d’évaluer de façon fiable le diamètre de l’anévrysme – en effet, seul le chenal circulant est opacifié et l’éventuel thrombus mural ne peut pas être visualisé.
________________________________________________________________________________
Figure 7.10. Aorto-artériographie d’un anévrysme de l’aorte abdominale.
________________________________________________________________________________
Évolution naturelle et complications
Les anévrysmes de l’aorte abdominale ont pour évolution naturelle d’augmenter de taille progressivement et ceux d’autant plus que le diamètre de l’anévrysme est important. Le tabagisme et l’HTA sont des facteurs favorisants. On préconise un suivi, initialement à six mois du diagnostic (pour vérifier l’absence de progression trop rapide de l’anévrysme) puis annuel, par écho-Doppler aortique, avec mesure du diamètre antéropostérieur de l’anévrysme.
Le risque réside essentiellement dans la rupture qui est, lorsqu’elle survient, dramatique, car elle engendre une mortalité immédiate et opératoire très élevée. La rupture est le plus souvent rétropéritonéale entraînant des douleurs abdominales et lombaires. On estime que le risque de rupture est proportionnel au diamètre de l’anévrysme et des études ont montré que les anévrysmes de plus de 5 cm de diamètre présentaient 22 % de risques de rupture dans les deux années qui suivent, ce pourquoi ce seuil est retenu comme indication d’intervention en l’absence de contre-indication.
Les autres complications potentielles sont la compression d’un organe de voisinage par l’anévrysme (intestin grêle, voies urinaires) ou la survenue d’embolies distales liées à une thrombose au sein de l’anévrysme (ischémie de membre).
Traitement de l’anévrysme de l’aorte abdominale
Outre le contrôle strict des facteurs de risque d’athérosclérose et la trithérapie classique préconisée dans l’athérome (antiagrégants plaquettaires, statines et IEC ou ARA II), une exclusion de l’anévrysme est indiquée lorsqu’il mesure plus de 5 cm ou lorsque sa progression est supérieure à 0,5 cm en six mois sur deux imageries de même modalité. Nous disposons de deux techniques :
- le traitement chirurgical qui consiste en une mise à plat de l’anévrysme, suivie d’une greffe par matériel synthétique (pontage prothétique), avec réimplantation des collatérales intéressées. Cette chirurgie nécessite un clampage aortique et présente une mortalité de l’ordre de 4 % lorsqu’elle est programmée, la mortalité étant bien entendu beaucoup plus élevée lorsque la chirurgie est réalisée en urgence dans les cas d’anévrysmes rompus ;
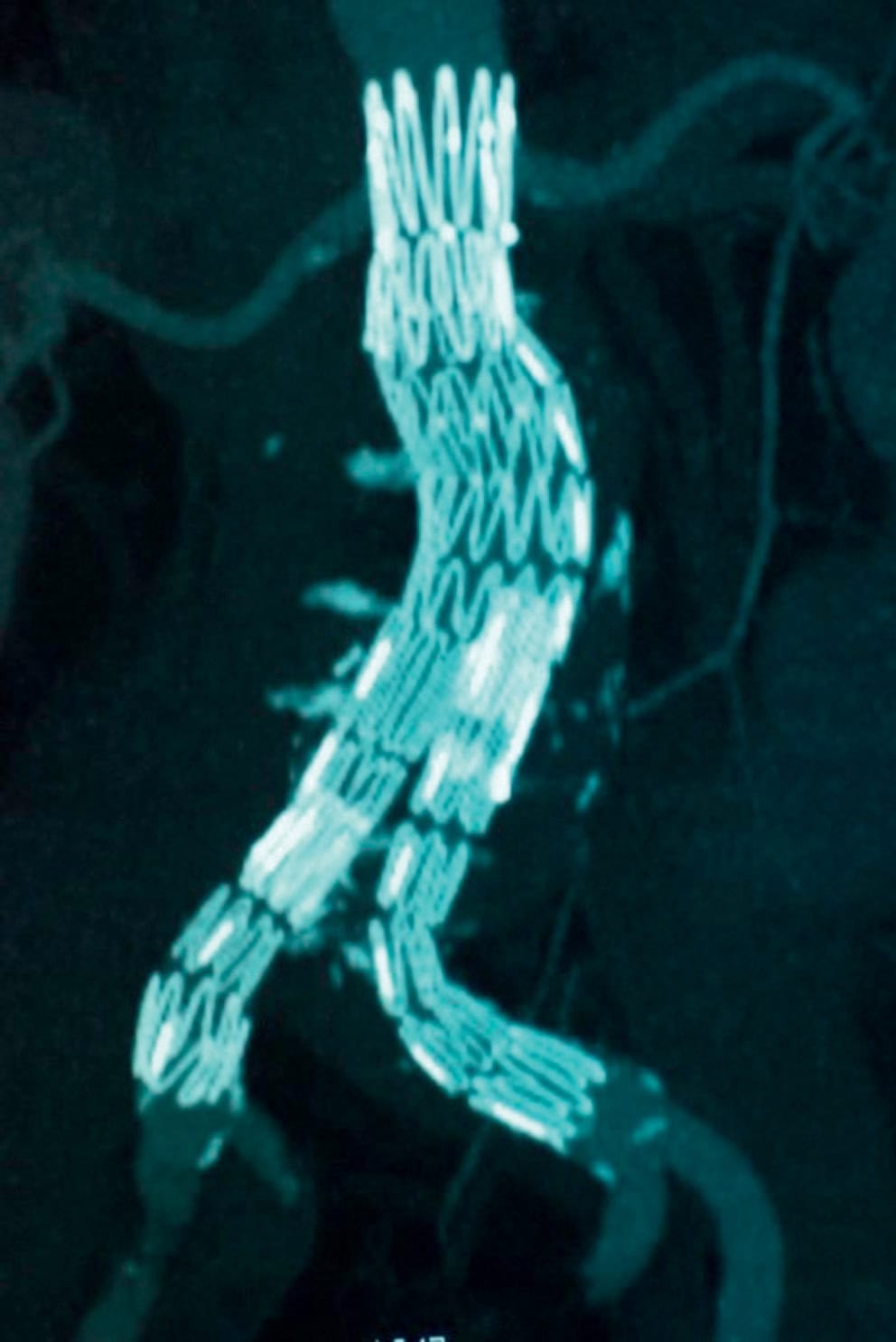
- les traitements endovasculaires : la pose d’une endoprothèse couverte constitue une alternative à la chirurgie, notamment en cas de contre-indications au clampage aortique ou à l’anesthésie générale. Elle consiste en la mise en place d’une endoprothèse aorto-bi-iliaque (fig. 7.11) par abord fémoral, et quelques fois aorto-aortique, ne nécessitant pas de clampage aortique. L’endoprothèse a l’avantage de permettre une hospitalisation courte. Toutefois, elle nécessite des conditions anatomiques propices et une surveillance dans le temps car il y a des risques d’endofuites qui peuvent engendrer la progression du sac anévrysmal.
________________________________________________________________________________
Figure 7.11. Endoprothèse aorto-bi-iliaque
________________________________________________________________________________
Autres localisations anévrysmales
En théorie les anévrysmes peuvent survenir au niveau de toutes les artères mais certaines localisations sont plus fréquentes : il s’agit des artères cérébrales, ainsi que des artères iliaques et poplitées, ou des artères viscérales (ex. artères rénale ou splénique). Elles ont souvent une évolution asymptomatique, mais peuvent être source de complications parfois catastrophiques, notamment du fait d’une rupture (par exemple d’une artère cérébrale, responsable d’accident vasculaire hémorragique) ou par embolisation du matériel thrombotique se développant en son sein (par exemple les artères poplitées, pouvant être responsable d’ischémie aiguë du membre de cause embolique, ou bien d’ischémie critique par micro-embols répétés et à bas bruit, jusqu’à la désertification de l’arbre artériel).
En dehors de l’aorte abdominale, la plupart des anévrysmes artériels ne sont pas accessibles à l’examen clinique sauf quand ils sont volumineux. Les anévrysmes poplités font exception : on perçoit facilement une masse palpable, battante dans le creux poplité.
Dissection de l’aorte thoracique
Mécanisme
La dissection aortique correspond à un clivage longitudinal de la paroi aortique, suite à une déchirure de la paroi, le plus souvent au sein de la média, ou parfois intimale, intimale, créant ainsi un orifice d’entrée entraînant un passage de sang entre l’aorte vers un faux chenal qui est une cavité intrapariétale plus ou moins étendue, aussi appelée l’hématome disséquant. Le faux chenal communique habituellement par une ou plusieurs déchirures intimales avec la lumière de l’aorte, qui constitue l’orifice d’entrée associé ou non à des orifices de réentrée. Parfois, le faux chenal se thrombose, ce qui est de meilleur pronostic, car le risque de la dissection aortique est essentiellement la rupture aortique au niveau de la partie externe de la média, qui est amincie et fragilisée par la dissection. Cette rupture peut apparaître immédiatement au moment de la dissection ou être secondaire lorsque l’artère disséquée se dilate progressivement avec le temps.
Causes
Les causes de dissection aortique sont :
- l’athérosclérose, et particulièrement dans ses facteurs de risque l’hypertension artérielle non contrôlée ;
- les anomalies anatomiques de la média : maladie de Marfan, maladie d’Ehlers-Danlos, maladie annulo-ectasiante de l’aorte et autres maladies proches intéressant le tissu élastique.
- Les causes iatrogènes (cardiologie interventionnelle) ou traumatique. Plus récemment, les quinolones, une classe antibiotique, ont été imputées à la survenue de dissection aortique.
Classification
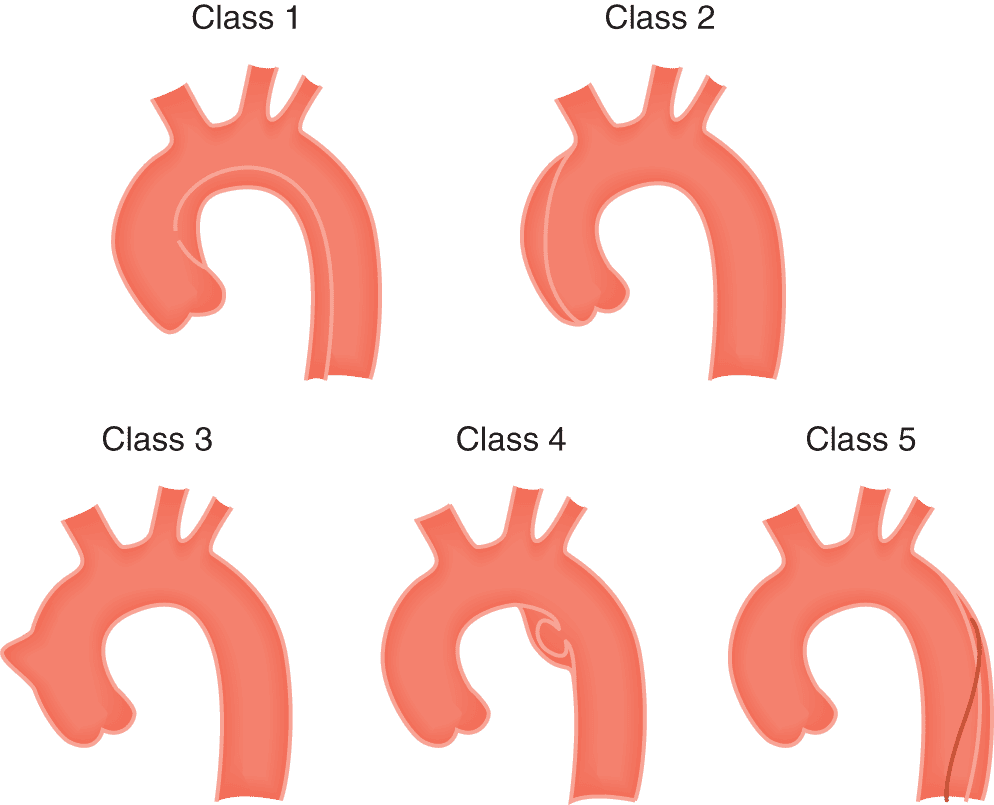
On classifie les dissections aortiques en fonction de l’implication ou non de l’aorte ascendante : la classification de Stanford distingue le type A, qui concerne les dissections touchant l’aorte ascendante, et le type B, qui concerne toutes les autres dissections où l’aorte ascendante n’est pas impliquée. Il existe aussi la classification de De Bakey (fig. 7.12).
________________________________________________________________________________
Figure 7.12. Classification des dissections aortiques.

Source : Cohen A, Berthelot-Garcias E, Douna F. Urgences cardiovasculaires et situations critiques en cardiologie. Paris : Elsevier-Masson ; 2010.
________________________________________________________________________________
La dissection de type A est l’atteinte la plus sévère, avec une mortalité de l’ordre de 50 % durant les premières 48 heures si aucune intervention n’est proposée. En effet, la dissection aortique peut de compliquer de :
- rupture avec tamponnade cardiaque car cette portion est couverte par le péricarde ;
- prolongement de la dissection vers les artères coronaires, se compliquant d’ischémie ou infarctus myocardique ;
- de prolongement vers la structure valvulaire aortique, responsable d’une insuffisance valvulaire plus ou moins sévère.
Au-delà, de prolongement vers la crosse aortique et l’aorte descendante, pouvant toucher toutes les collatérales, et notamment les artères à destinée encéphalique.
Qu’il s’agisse d’une dissection de type B, ou d’une dissection de type A se prolongeant au-delà du tronc artériel brachiocéphalique, l’ensemble des organes (cerveau, moelle épinière, les intestins, les reins) peuvent présenter un bas débit avec des phénomènes ischémiques graves, responsables d’un syndrome de malperfusion. Ceci peut aussi toucher les membres supérieurs et/ou inférieurs, responsables d’ischémie de membre.
À côté de la dissection aortique classique, trois autres présentations voisines sont à rapporter (fig. 7.13) :
- l’hématome intramural : la paroi aortique est clivée par un hématome, le plus souvent du fait d’une hémorragie intraparoi, nourrie par les vasa-vasorum de la paroi aortique ;
- l’ulcère pénétrant de l’aorte, de nos jours le plus souvent secondaire à des lésions athéromateuses évoluées ;
- la rupture sous intimale, spontanée, ou secondaire à un traumatisme (ex : cisaillement de la paroi aortique secondaire un accident de voiture).
________________________________________________________________________________
Figure 7.13. Différentes présentations de syndrome aortique aigu.
Source : Erbel R, Aboyans V, Boileau C, Bossone E, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014 Nov 1;35(41):2873-926.
________________________________________________________________________________
L’ensemble de ces présentations sont généralement de gravité équivalente à la dissection aortique classique, et constituent avec cette dernière le syndrome aortique aigu.
Diagnostic
Le diagnostic est évoqué devant une scène clinique évocatrice : douleur thoracique, très intense, migratrice, débutant dans le thorax puis transfixiante dans le dos puis descendant vers les membres inférieurs, associée à des signes d’hypoperfusion périphérique variables avec la topographie. Il peut également y avoir des symptômes neurologiques si la dissection s’étend aux carotides. La brutalité de l’installation des symptômes, l’absence d’anomalies ECG évoquant une ischémie myocardique (sauf si dissection coronaire), l’absence d’orientation radiologique ou biologique vers un syndrome coronaire aigu font évoquer le diagnostic et demander un examen d’imagerie en fonction du contexte et de la disponibilité : échocardiographie transthoracique et surtout transœsophagienne (voile intimal pathognomonique), scanner aortique injecté (en l’absence d’insuffisance rénale), voire IRM, rarement en urgence cependant.
Actuellement l’examen complémentaire de référence est l’angioscanner aortique.
Complications potentielles
On parle de dissection aiguë si elle évolue depuis moins de deux semaines, subaiguë si elle évolue entre quinze jours et moins de trois mois, et chronique si elle évolue au-delà de ce délai.
Les complications potentielles d’une dissection aortique sont :
- l’extension de la dissection dans l’aorte et dans ses branches (ischémie coronaire, hypo perfusion d’organes digestifs, AVC, insuffisance rénale aiguë) ;
- insuffisance aortique ;
- la rupture aortique entraînant le décès ;
- la compression par l’hématome disséquant soit des structures adjacentes, soit de la lumière artérielle avec risque de thrombose et d’embolie distale.
Stratégie thérapeutique (fig. 7.14)
Schématiquement, on retiendra que les dissections de type A (aorte ascendante) nécessitent une prise en charge chirurgicale et les dissections de type B peuvent bénéficier uniquement d’un traitement médical en cas de bon contrôle de la pression artérielle, disparition des douleurs et avec un suivi rapproché.
________________________________________________________________________________
Figure 7.14. Prise en charge d’un patient présentant une dissection aortique.

Source : d’après Cohen A, Berthelot-Garcias E, Douna F. Urgences cardiovasculaires et situations critiques en cardiologie. Paris : Elsevier-Masson ; 2010.
________________________________________________________________________________
Le traitement de la dissection aortique de type B est médical hors complication, il repose sur un contrôle tensionnel strict (anticalciques, bêtabloquants), antalgie.
La dissection aortique non opérée constitue classiquement une contre-indication aux traitements anticoagulants.
En cas de syndrome de malperfusion, ou en absence d’un contrôle de la douleur malgré le retour à des antalgiques puissants et le contrôle de la tension, ou en cas de signes de fissuration, un traitement endovasculaire par implantation de stent aortique peut être proposé.
Au long cours, l’aorte horizontale ou descendante peut rester disséquée. Une surveillance par imagerie (habituellement annuelle) s’assurera de l’absence d’évolution anévrysmale, cette dernière pouvant être également une indication pour un traitement endovasculaire.
Artériopathie oblitérante des membres inférieurs
L’artériopathie oblitérante des membres inférieurs (AOMI) correspond à une atteinte artérielle obstructive au niveau des artères des membres inférieurs, la plupart du temps consécutive à l’athérosclérose. Elle peut atteindre tout le réseau artériel, de l’aorte terminale et sa bifurcation jusqu’aux artères du pied.
C’est une pathologie extrêmement fréquente, avec une prévalence de plus de 10 % au-delà de 65 ans. Elle semble toucher autant les femmes que les hommes. Elle témoigne aussi d’une atteinte athéroscléreuse dans d’autres territoires qu’il faudra rechercher, particulièrement au niveau coronaire et cérébral.
Classification
On distingue plusieurs stades à l’AOMI.
La classification de Leriche et Fontaine distingue quatre grands stades :
- stade I : absence d’ischémie, abolition d’un pouls distal ; (patient asymptomatique)
- stade II : ischémie d’effort avec claudication intermittente, on divise le stade II en II faible et fort selon que le périmètre de marche est inférieur ou supérieur à 150 m
- stade III : ischémie de repos avec douleurs de décubitus ;
- stade IV : ischémie de repos avec troubles trophiques (ulcères, gangrènes).
Les stades III et IV représentent l’ischémie critique.
Les récentes recommandations françaises et européennes ont tendance à classifier l’AOMI selon qu’elle soit asymptomatique, au stade de la claudication intermittente, ou au stade de l’ischémie critique.
Diagnostic clinique : la claudication intermittente
Il s’agit d’une douleur ou d’une crampe, typiquement du mollet, apparaissant à la marche, de caractère intense, obligeant le patient à s’arrêter. Cette douleur cède rapidement à l’arrêt de l’effort et elle réapparaît pour la même distance en cas de reprise de la marche, ce qui définit un périmètre de marche.
La localisation de la douleur permet d’évoquer le territoire où se situe l’obstacle artériel : une claudication de la plante du pied évoque une atteinte des artères du pied ou de la jambe, une claudication du mollet témoigne d’une atteinte fémorale superficielle ou poplitée, une claudication de la cuisse témoigne d’une atteinte iliaque externe ou fémorale commune, une claudication fessière témoigne d’une atteinte iliaque primitive ou hypogastrique.
À côté de cette présentation typique de claudication intermittente, d’autres formes moins typiques peuvent exister, avec notamment l’absence de nécessité d’arrêt de la marche. Enfin, cette symptomatologie d’effort peut être masquée par d’autres comorbidités empêchant le patient de marcher suffisamment pour présenter sa forme typique (douleurs ostéo-articulaires intriquées, présence de neuropathies avec perte de sensibilité à la douleur, présence de toute autre maladie limitant la marche comme une insuffisance cardiaque sévère).
Le syndrome de Leriche correspond à une obstruction de l’aorte sous-rénale et des artères iliaques primitives, et se traduit par une claudication haute et bilatérale, associée à une dysfonction érectile chez l’homme, et parfois à une atrophie des muscles des membres inférieurs.
Il faudra éliminer les diagnostics différentiels (claudication médullaire qui est indolore et où les pouls sont présents ; syndrome du canal lombaire étroit ; claudication d’origine rhumatologique, etc.).
Examens complémentaires
La mesure de l’IPS est la première étape diagnostique. Un IPS < 0,90 confirme la suspicion clinique de claudication intermittente. En cas d’IPS > 0,90 avec une forte suspicion clinique, une épreuve de marche sur tapis roulant est intéressante, tant pour déterminer objectivement le périmètre de marche (distance parcourue avant que le patient soit obligé d’arrêter pour cause de douleur) que pour mesurer à nouveau les pressions de cheville après cette épreuve de sensibilisation.
Le diagnostic clinique est confirmé par l’échographie-Doppler vasculaire qui localise les lésions et précise le degré de sévérité et le retentissement d’aval. Si une revascularisation est envisagée, le bilan ultrasonore est complété par un angioscanner et/ou une angiographie par résonance magnétique qui participent au bilan lésionnel et à l’orientation thérapeutique.
Traitement
Le traitement de l’AOMI au stade de la claudication intermittente doit être essentiellement médical, avec contrôle strict des facteurs de risque d’athérome, trithérapie vasculoprotectrice (antiagrégants plaquettaires type aspirine ou clopidogrel, statines, IEC ou ARA II).
On encourage le patient à réaliser des exercices de marche réguliers car ceci améliore le périmètre de marche du claudicant. Le patient peut bénéficier d’une rééducation en centre spécialisé.
Au stade de la claudication, il faut insister sur la prévention de l’apparition de troubles trophiques au niveau des pieds, car l’apparition d’une plaie peut faire évoluer le patient vers une ischémie critique.
Les moyens chirurgicaux et endovasculaires de revascularisation au stade de la claudication intermittente sont en règle générale réservés aux patients ayant un paramètre de marche limité et entravant la vie normale, présentant des lésions proximales, non améliorées après trois mois de traitement médical optimal et de réadaptation à la marche.
Ischémie critique de membre
Définition
Sa définition est à la fois clinique et hémodynamique :
- association de douleurs ischémiques de décubitus (douleurs intenses, insomniantes, obligeant le patient à dormir la jambe pendante hors du lit) et d’une pression systolique inférieure ou égale à 50 mm Hg à la cheville et/ou inférieure ou égale à 30 mm Hg à l’orteil ;
- ou par la présence d’une ulcération ou gangrène du pied ou des orteils, évoluant depuis plus de quinze jours, avec une pression systolique inférieure ou égale à 70 mm Hg à la cheville et/ou inférieure ou égale à 50 mm Hg à l’orteil.
Cette situation clinique comporte un risque d’amputation de membre très élevé (35 % à six mois) ainsi qu’un pronostic général très défavorable (20 % de mortalité à six mois).
La sévérité (et le risque d’amputation) dépend de quatre paramètres :
- le degré d’ischémie ;
- la présence de lésions (ulcères, gangrènes, etc.) ;
- la présence d’infection ;
- l’état général du patient : le plus souvent il s’agit de patients âgés, avec un état général altéré (dénutrition) et de nombreuses comorbidités (diabète, insuffisance rénale, insuffisance cardiaque, etc.).
Conduite à tenir
Le traitement est une urgence médico-chirurgicale relative (prise en charge optimale dans les jours suivants le diagnostic).
Il consiste en un traitement médical optimal et une revascularisation urgente du membre ischémique autant que possible.
Après avoir fait le bilan lésionnel par écho-Doppler artériel des membres inférieurs, associé éventuellement à un angioscanner ou une angio-IRM, voire une artériographie des membres inférieurs, on discutera les possibilités de revascularisation qui peuvent être :
- soit par chirurgie conventionnelle : endartériectomie (concernant particulièrement le trépied fémoral) ou pontage (utilisant soit du matériel veineux du patient, soit une prothèse, ou encore des allogreffes artérielles ou veineuses) ;
- soit endovasculaire (angioplastie de sténose, recanalisation d’occlusion artérielle, avec possibilité de pose de stent comme sur les artères coronaires).
- Cas échéant, et en absence de toute possibilité de revascularisation, une amputation peut être proposée pour éliminer les tissus nécrosés et infectés, mettant en danger le patient. Le niveau d’amputation dépendra de l’étendue de l’ischémie (clinique, aidée par la mesure de TcPO2 cutanée), en essayant toujours de « sauver » un niveau articulaire. Par exemple, le taux de succès de déambulation après mise en place d’une prothèse sera meilleur si l’amputation est au-dessous du genou plutôt qu’au-dessus de celui-ci.
Quels que soient la décision et traitement interventionnel, le traitement médical, prenant en charge la douleur, l’infection, les comorbidités et la dénutrition reste essentielle.
On portera une attention particulière à la protection du membre ischémié et à la réalisation de bons soins locaux en cas d’ulcération ou de gangrène.
Ischémie aiguë des membres
L’ischémie aiguë d’un membre est secondaire à une interruption brutale du flux artériel responsable d’une hypoxie tissulaire abrupte pouvant aboutir à la nécrose tissulaire, voire à la perte d’un segment ou la totalité d’un membre. L’ischémie aiguë est bien plus fréquente au niveau des membres inférieurs mais peut aussi toucher un membre supérieur, essentiellement par phénomène embolique (cf. infra). Quel que soit le membre atteint, il s’agit d’une urgence médico-chirurgicale. Les premiers tissus pouvant nécroser de manière irréversible sont les nerfs, souffrant d’hypoxie dans les 2 heures, suivis des muscles, dans les 6-8 heures, responsables de lyse cellulaire (rhabdomyolyse) ayant des conséquences métaboliques importantes (hyperkaliémie par relargage du potassium intracellulaire dans la circulation), et acidose secondaire à la production d’acide lactique en mode anaérobie. L’anoxie musculaire entraîne une vasodilatation capillaire elle-même responsable d’œdème et d’une augmentation de la pression interstitielle entraînant une stase de la circulation veineuse et lymphatique, avec un phénomène d’auto-aggravation de l’œdème et de l’hypoxie : Les muscles des membres étant dans des loges aponévrotiques inextensibles, le développement de l’œdème peut être responsable d’une compression des tissus avec arrêt total de circulation, définissant le syndrome des loges. Dans ce cas, seule une aponévrotomie de décharge permet de libérer le tissu musculaire, permettant ainsi de restaurer la circulation capillaire. Enfin, la nécrose cutanée apparaît à partir de la 24e heure.
Diagnostic
Le diagnostic est essentiellement clinique, et ne doit pas être inutilement différé par des explorations autres que celles nécessaires pour une intervention urgente.
Le principal signe fonctionnel est la douleur d’apparition brutale (parfois en quelques heures dans la forme subaiguë), intense à type de broiement, avec impotence fonctionnelle du membre. La sévérité des manifestations dépend du niveau d’occlusion artérielle (signes plus évocateurs en cas d’occlusion proximale) et surtout selon le développement préalable de collatéralité en cas d’artériopathie : une occlusion sur un réseau sain, dénué de collatérales, sera paradoxalement plus brutal et symptomatique.
À l’examen physique (toujours comparatif par rapport l’autre membre), le membre est froid, livide (blanc). La palpation des masses musculaires est douloureuse. Les pouls sont abolis en aval de l’occlusion.
L’examen vasculaire est complété par un examen neurologique : anesthésie et paralysie (notamment impossibilité de relever le pied par l’atteinte du nerf fibulaire).
À partir de ces éléments, le niveau de sévérité de l’ischémie peut être gradué (tableau 7.2).
Tableau 7.2. Niveau de sévérité de l’ischémie aiguë, d’après Rutherford, proposées dans les recommandations 2018 de la société européenne de cardiologie.
| Grade | Déficit sensitif | Déficit moteur | Pronostic |
| I | Absent | Absent | Pas de menace immédiate, urgence relative |
| IIa | Absent ou limité aux orteils | Absent | Récupérable si prise en charge |
| IIb | Présent au-delà des orteils | Modéré | Récupération possible si prise en charge immédiate |
| III | Anesthésie importante | Importante, paralysie | Perte de tissus et déficit séquellaire inévitables |
Source : Aboyans V, Ricco JB, Bartelink MLEL, et al. ; ESC Scientific Document Group. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018 ;39:763-816.
________________________________________________________________________________
La topographie de l’occlusion peut être généralement estimée par la localisation de la froideur du membre et l’abolition des pouls en aval. À titre d’exemple, l’occlusion du tiers inférieur de l’artère fémorale superficielle se présente par la persistance d’un pouls fémoral, mais l’abolition des pouls poplité, tibial postérieur et pédieux homolatéral, avec un membre froid à partir du niveau du genou. Dans le cas le plus grave, l’occlusion de la bifurcation aortique est responsable d’une ischémie bilatérale sévère associée à une paralysie sensitivomotrice. Les signes généraux sont alors souvent au premier plan, allant jusqu’au collapsus cardiovasculaire.
L’examen clinique de l’ischémie aiguë est toujours complété par une auscultation cardiaque et ECG à la recherche d’arythmie, et une palpation abdominale à la recherche d’un anévrysme aortique.
Diagnostic paraclinique
Le diagnostic d’ischémie aiguë des membres inférieurs est clinique et l’équipe chirurgicale et d’anesthésie doit être alertée au plus tôt. Aucune exploration ne doit retarder l’intervention notamment en cas d’atteinte neurologique (Grade II). Une échographie-Doppler peut être réalisée sans perte de temps si et seulement si les conditions locales et la sévérité du tableau clinique le permettent (notamment stade I, en absence d’atteinte neurologique).
L’artériographie est le plus souvent réalisée au bloc opératoire pour orienter le geste thérapeutique, permettant de localiser l’oblitération, de caractériser l’aspect de cette occlusion (athérome, anévrysme, dissection, etc.) et surtout d’apprécier le réseau artériel d’aval, important pour la prise en charge chirurgicale, notamment en cas de thrombose de réalisation de pontage vasculaire. En cas d’embolie, elle permet aussi de révéler d’autres emboles (homo et/ou controlatéraux) asymptomatiques.
Sur le plan étiologique, deux causes s’opposent. Dès la première phase de prise en charge, il est important d’obtenir un faisceau d’arguments en faveur de l’une des 2, thrombose artérielle in situ ou embolie sur artères saines.
Thrombose artérielle in situ
Ce tableau survient le plus souvent un sujet âgé avec des facteurs de risque cardiovasculaires voire un tableau préexistant d’AOMI (pouvant être aussi recherché sur l’autre membre). La douleur d’intensité moyenne de survenue progressive ou rapide (grâce au développement préalable de collatéralité). Les étiologies sont avant tout l’AOMI, mais peuvent aussi être en rapport avec une artériopathie non-athéromateuse (inflammatoire, radique, etc.), un anévrysme poplité thrombosé, un kyste adventitiel, une dissection aorto-iliaque, voire iatrogénique : cathétérisme, thrombopénie à l’héparine, ergotisme.
Embolie sur artères saines
Elle survient classiquement chez un sujet jeune sans antécédent vasculaire connu (mais pouvant avoir une cardiopathie connue). La douleur brutale, aiguë et sévère (absence de collatérales). Elle peut suivre des épisodes de palpitations (arythmie cardiaque). Les principales causes d’embolie sont d’origine cardiaque (troubles du rythme et notamment la fibrillation atriale +++), un foramen ovale perméable et anévrysme du septum interauriculaire, un infarctus du myocarde, avec notamment un faux-anévrysme de paroi, une endocardite infectieuse, les valvulopathies et prothèses valvulaires, les tumeurs cardiaques (myxome de l’oreillette), une dyskinésie ou anévrysme ventriculaire gauche. Les autres sources extra-cardiaques d’embolie sont : l’athérome aortique, les anévrysmes (aortiques, iliaques, poplitées), les tumeurs aortiques, et les pièges vasculaires.
Ces dex présentations cliniques ne sont pas toujours aussi distinctes : une embolie peut survenir sur des artères déjà affectées par l’AOMI. Inversement une thrombose in situ peut survenir à partir d’une rupture d’une plaque initialement non-occlusive chez un sujet sans aucun signe préalable d’AOMI.
Le bilan étiologique est réalisé après la revascularisation et inclut :
- un bilan cardiaque : Holter ECG (24 heures au minimum, 72 heures idéalement et au-delà, jusqu’à l’implantation d’un Holter implantable en cas de bilan étiologique négatif), échocardiographie transthoracique voire transœsophagienne ;
- un bilan artériel : écho-Doppler artériel de l’aorte et des artères des membres inférieurs, voire angioscanner ou artériographie.
Traitement
L’étape diagnostique doit être la plus rapide possible afin d’instaurer rapidement le traitement selon la sévérité.
Le traitement médical comporte un anticoagulant et des antalgiques, une oxygénothérapie par voie nasale, et l’équilibration de l’état hémodynamique si nécessaire (remplissage macromoléculaire). Les soins locaux immédiats sont importants, et ce même au-delà de la revascularisation (protection mousse ou coton, position légèrement déclive, éviction de tout frottement ou traumatisme cutané).
La revascularisation doit toujours être tentée, en privilégiant les solutions chirurgicales, avec notamment une embolectomie par sonde de Fogarty sous contrôle angiographique. La thrombolyse intra-artérielle (in situ) et la thrombo-aspiration peuvent être utilisées en cas d’ischémie subaiguë. Dans tous les cas, en présence de sténose résiduelle, un geste d’angioplastie, voire de pontage, peut compléter la revascularisation.
En cas de revascularisation tardive, le geste est généralement systématiquement complété par une aponévrotomie de décompression, le plus souvent sur la loge antéro-externe de jambe, (d’autres régions y compris le pied peuvent être décomprimées si besoin) permettant d’éviter le syndrome des loges.
Enfin, si l’ischémie est dépassée, une amputation d’emblée peut être envisagée.
À plus long terme, le traitement étiologique d’une cause embolique est à envisager (par exemple anticoagulation à long terme en cas d’arythmie par fibrillation atriale). Dans le cas d’une origine thrombotique, un traitement antiagrégant plaquettaire et un bon contrôle des facteurs de risque cardiovasculaire est indispensable (cf. cours prévention cardiovasculaire).
Ischémie mésentérique
L’ischémie mésentérique est la conséquence d’une incapacité de la circulation mésentérique à perfuser les organes digestifs. Elle peut être occlusive ou non occlusive, aiguë ou chronique. Sa prise en charge est souvent multidisciplinaire.
Les ischémies mésentériques sont le plus souvent artérielles et rarement veineuses. Les ischémies mésentériques occlusives sont d’étiologie embolique (artérielle) et thrombotique (artérielle ou veineuse). Les ischémies mésentériques non occlusives sont soit liées à un bas débit soit à une compression extrinsèque (compression du tronc cœliaque par un ligament arqué).
Ischémie mésentérique aiguë (IMA)
L’ischémie mésentérique aiguë est une urgence vitale, dont la prise en charge est multidisciplinaire. L’étiologie la plus fréquente est l’embolie artérielle. Les autres causes sont la thrombose artérielle, la dissection aortique ou la dissection localisée d’une artère digestive, la thrombose veineuse mésentérique et l’ischémie mésentérique non obstructive. Son pronostic reste sombre avec une mortalité élevée (50 – 95 %).
Le diagnostic clinique repose sur la présence de douleurs abdominales soudaines à type de crampe, souvent accompagnées d’une agitation. Les douleurs sont initialement péri-ombilicales puis en fosse iliaque droite. À la phase d’infarctus mésentérique (fig. 7.15), les douleurs deviennent profondes et lancinantes. Un hyperpéristaltisme avec selles précoces ou ténesme, peut être présent à un stade précoce. Les signes physiques sont pauvres au stade initial. Au stade précoce réversible, les douleurs abdominales sont très importantes et l’examen clinique est pauvre. Le stade tardif correspond à l’infarctus mésentérique : les douleurs abdominales sont importantes et s’accompagnent d’une occlusion intestinale puis d’un état de choc.
________________________________________________________________________________
Figure 7.15. Coupe sagittale d’angio-TDM, embole à l’origine de l’artère mésentérique supérieure (flèche)
________________________________________________________________________________
L’examen complémentaire de première intention en urgence est l’angio-TDM abdominal (fig. 7.16) qui a une sensibilité et une spécificité supérieure à 90 %. Le bilan lésionnel recherche des lésions artérielles (occlusion et sténose) et des signes de souffrance intestinale (épaississement pariétal, rehaussement de la muqueuse, pneumatose, dilatation, aéroportie). L’angio-TDM est indispensable en préopératoire pour déterminer la stratégie thérapeutique. Les anomalies biologiques (hémoconcentration, hyperleucocytose, acidose métabolique à trou anionique augmenté par hyperleucocytose, augmentation des lactates, parfois augmentation des enzymes hépatiques, de l’amylase, des LDH et des CPK) manquent de sensibilité et de spécificité.
________________________________________________________________________________
Figure 7.16. Infarctus mésentérique avec nécrose des anses grêles.
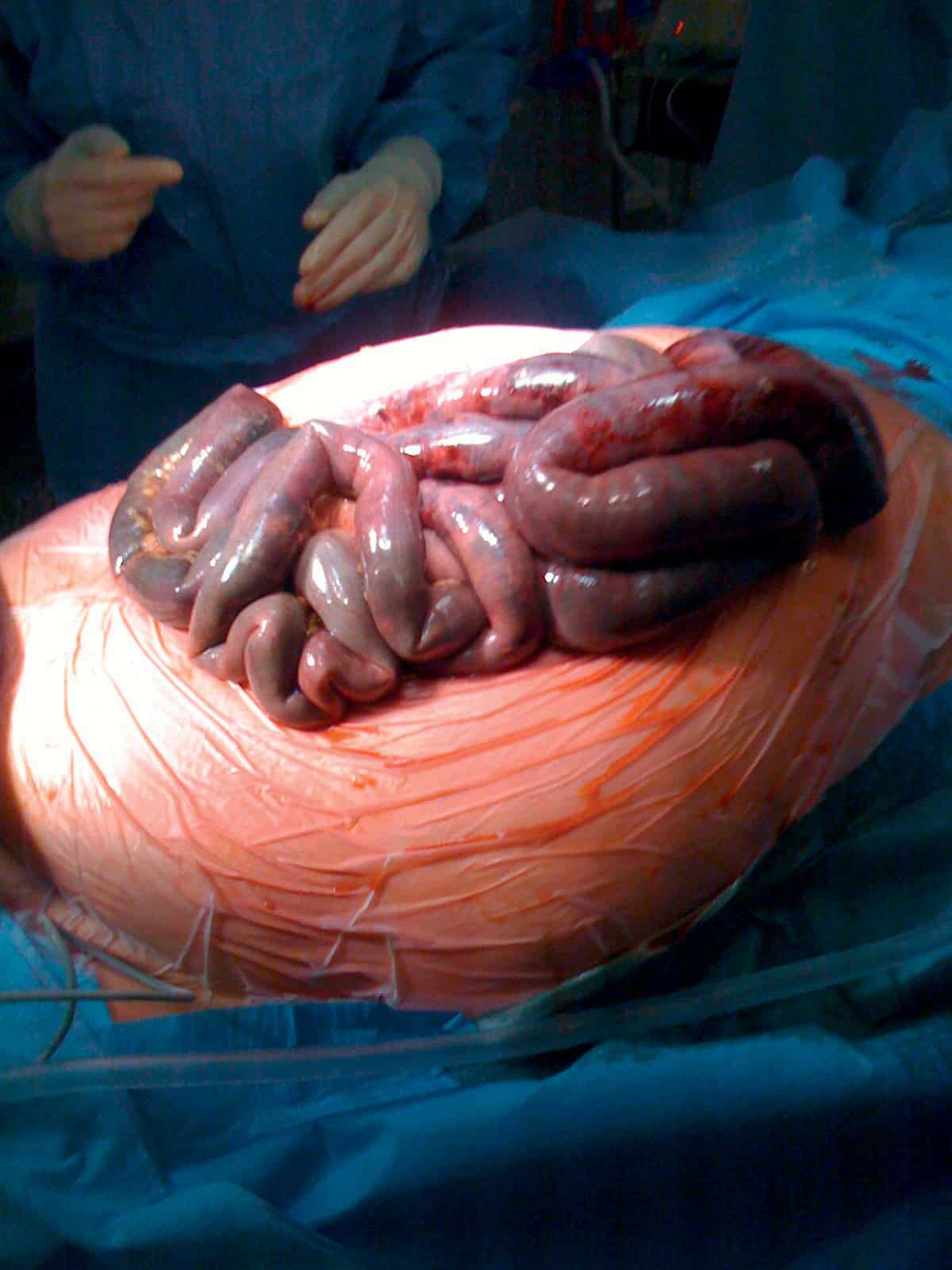
________________________________________________________________________________
Le traitement (fig. 7.17) repose essentiellement sur une prise en charge chirurgicale multidisciplinaire (temps vasculaire et temps digestif) en urgence. L’objectif du traitement est de restaurer la perméabilité d’une ou plusieurs artères digestives et d’évaluer la viabilité des organes digestifs. Une laparotomie ou une laparoscopie exploratrice permet le bilan lésionnel des organes digestifs. En fonction de l’atteinte des organes digestifs, une revascularisation artérielle peut être proposée. Il peut s’agir d’une chirurgie conventionnelle avec thromboembolectomie artérielle ou pontage (en évitant d’utiliser du matériel prothétique). Le traitement endovasculaire peut aussi être proposé au cours de la laparotomie, il s’agira d’une angioplastie transluminale de l’artère mésentérique supérieure. Le traitement des lésions organes digestifs consiste en une exérèse des zones nécrotiques, une mise en stomie et une intervention second look qui est préconisé à 24 heures pour refaire un bilan lésionnel à distance après revascularisation. Les IMA par thromboses veineuses sont traitées par héparinothérapie, un temps chirurgical digestif peut être associé.
________________________________________________________________________________
Figure 7.17. Arbre décisionnel pour la prise en charge de l’ischémie mésentérique aiguë.
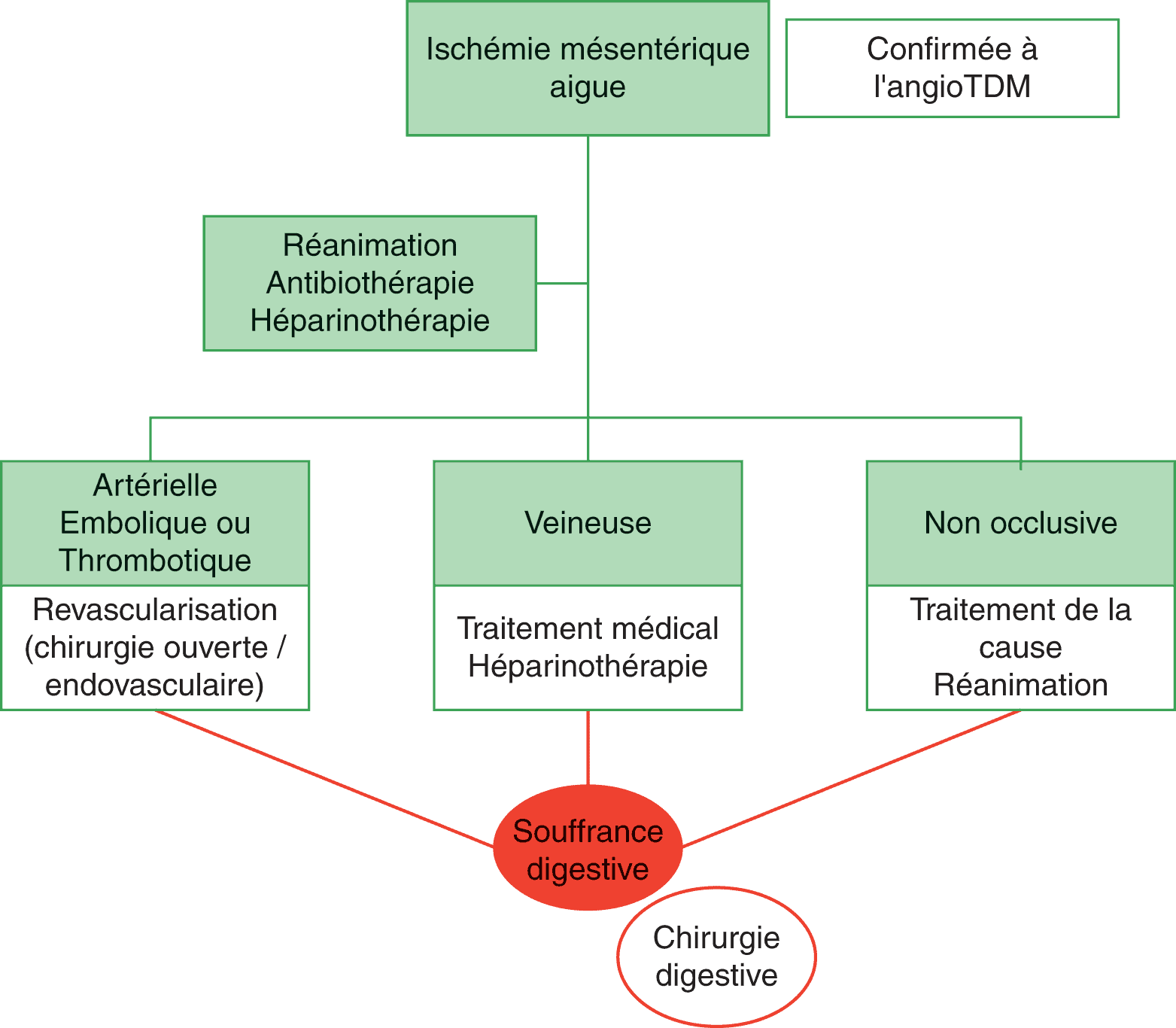
________________________________________________________________________________
Ischémie mésentérique chronique (IMC)
Ce stade peut précéder l’IMA thrombotique. Elle touche essentiellement le patient âgé et témoigne d’une maladie athéromateuse évoluée et diffuse.
L’athérosclérose est la principale étiologie (95 %). Les autres causes sont plus rares : dysplasie fibromusculaire, dissection isolée d’une artère digestive, syndrome du ligament arqué avec compression du tronc cœliaque. Une sténose artérielle digestive devient symptomatique lorsqu’elle concerne deux des trois artères digestives. L’occlusion des trois artères digestives peut être asymptomatique grâce au développement des collatérales.
Le diagnostic clinique est caractérisé par la présence d’un angor intestinal correspondant à une claudication intermittente digestive. Elle est caractérisée par des douleurs épigastriques postprandiales précoces (15 à 30 minutes après le repas, pendant 1 à 3 heures), une restriction alimentaire volontaire par crainte de s’alimenter et un amaigrissement. Il peut quelquefois s’accompagner d’une diarrhée, de nausées ou de vomissement, et d’une constipation. Rarement, l’IMC peut se manifester par un syndrome de malabsorption. Les symptômes atypiques gastroduodénaux (ulcères ischémiques, gastroparésie ischémique), hépatobiliaires (cholécystite gangréneuse alithiasique, cytolyse hépatique), ou coliques (colopathie, colite ulcéreuse chronique) sont plus rares.
Les principaux examens complémentaires sont l’écho-Doppler et l’angio-TDM. L’écho-Doppler est l’examen diagnostique de premier choix. Il permet l’analyse morphologique et hémodynamique du réseau artériel digestif. Il permet d’identifier les sténoses et occlusions des artères qui participent à la vascularisation des organes digestifs (tronc cœliaque, artères mésentériques, artères iliaques). L’angio-TDM permet l’exploration complète de la cavité abdominale, des réseaux artériels (fig. 7.18), et d’éliminer les autres causes de douleurs abdominales. L’angiographie n’est actuellement plus indiquée en première intention. L’angio-IRM peut être réalisée en cas d’allergie au produit de contraste ou d’insuffisance rénale.
________________________________________________________________________________
Figure 7.18. Coupe sagittale d’angio-TDM.
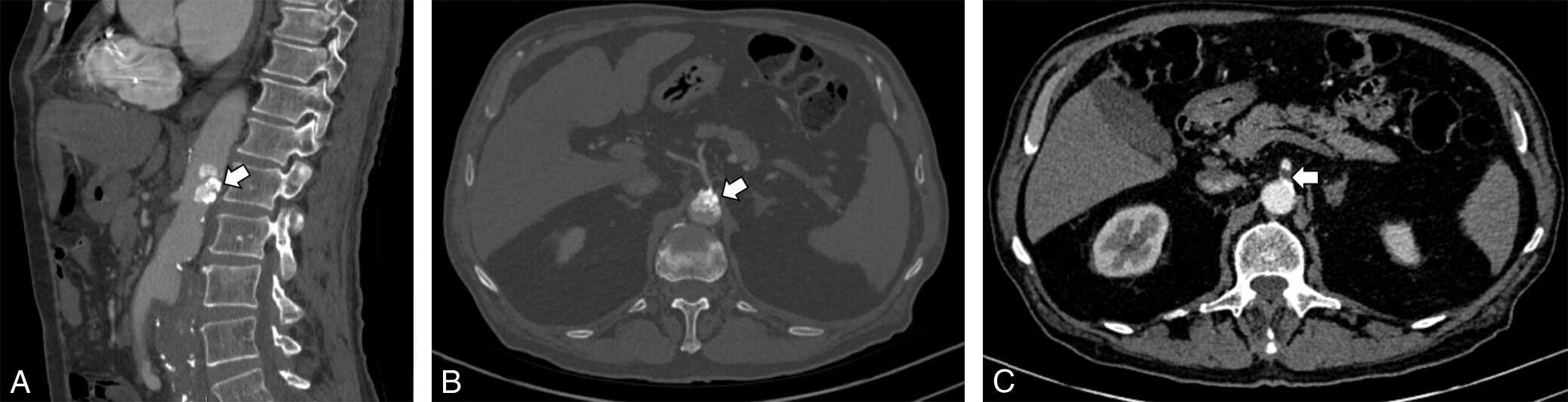
A. Bourgeon coralliforme calcifié de l’aorte abdominale (flèche) ; B. Coupe axiale d’angio-TDM, bourgeon coralliforme obstruant l’origine du tronc cœliaque (flèche) ; C. Coupe axiale d’angio-TDM. Thrombus obstruant l’origine de l’artère mésentérique supérieure (flèche).
________________________________________________________________________________
Le traitement a montré son efficacité sur les symptômes de l’IMC et sur la prévention de l’infarctus mésentérique. Il repose sur une revascularisation des lésions artérielles symptomatiques, le plus souvent par voie endovasculaire (angioplastie transluminale et stenting). En cas d’échec ou de non-faisabilité du traitement endovasculaire, le traitement chirurgical par endartériectomie ou par pontage est indiqué.
________________________________________________________________________________
Points importants
- Les maladies cardiovasculaires sont la première cause de décès en France et parmi elles, les accidents vasculaires cérébraux sont la deuxième cause après les accidents coronaires.
- L’aorte thoracique comprend trois portions : aorte ascendante, crosse de l’aorte (arc aortique ou aorte horizontale) et aorte thoracique descendante.
- L’aorte abdominale prolonge l’aorte thoracique et donne des collatérales, artères à destinée pariétale, à destinée viscérale et à destinée urogénitale.
- Selon les calibres artériels, on distingue des artères de grand calibre, supérieur à 7 mm, les artères de moyen calibre, 2 à 7 mm, et les artères de petit calibre 0,2 à 2 mm.
- Les artérioles ont un calibre de 200 à 300 μm.
- Les capillaires ont un diamètre de 3,5 à 5,5 microns.
- La plaque d’athérosclérose siège dans les artères de gros et de moyen calibre, aorte, premier centimètre des branches à destinée viscérale, artères des membres supérieurs jusqu’à la moitié proximale de l’artère humérale, artères des membres inférieurs jusqu’aux artères du pied, artères cervicales et artères intracrâniennes extra-encéphaliques.
- Conformément à la description de l’American Heart Association, différents stades de l’athérosclérose sont décrits :
- lésions précoces d’athérosclérose (types I à III) correspondant à la présence de macrophages spumeux isolés (type I), et à la présence de stries lipidiques (types II et III) ;
- lésions avancées d’athérosclérose (types IV à VI) : type IV, athérome avec formation d’un centre lipidique sans fibrose ; type V, fibro-athérome avec présence d’une chape fibreuse, plus ou moins apparition secondaire de calcifications ; type VI, athérosclérose compliquée d’ulcérations, et ultérieurement d’hématome ou d’hémorragie intraplaques et enfin de thrombose.
- L’écoulement du sang peut correspondre à un écoulement laminaire ou à un écoulement turbulent.
- Le système microcirculatoire est un système à base pression, il est composé d’artérioles, de capillaires et de veinules, système à basse résistance qui assure les échanges.
- Le débit sanguin cérébral est en moyenne de 50 ml/min/100 g de cerveau chez l’adulte.
- La prise des pressions systoliques à la cheville et le calcul des index de pression systolique font partie de tout examen vasculaire.
- Lors d’un examen vasculaire, on peut y associer, en fonction du contexte, la mesure de la pression artérielle systolique digitale, de la pression transcutanée en oxygène (Tcpo2) et dans certaines situations la capillaroscopie.
- L’échographie vasculaire couplée au Doppler est la technique de référence non invasive permettant de caractériser la géométrie, la morphologie et l’hémodynamique vasculaire.
- L’angioscanner et l’angiographie par résonance magnétique sont les techniques de référence pour étudier la lumière vasculaire ainsi que la paroi vasculaire.
- La place de l’artériographie et de la phlébographie est en nette décroissance depuis le développement de l’imagerie par scanner et IRM.
- L’anévrysme artériel correspond à une dilatation localisée et permanente d’un segment artériel avec perte de parallélisme des parois.
- L’anévrysme de l’aorte abdominale est la localisation anévrysmale la plus fréquente. Sa découverte est le plus souvent fortuite.
- L’anévrysme de l’aorte abdominale est défini comme un diamètre supérieur à 3,5 cm chez l’homme et 3 cm chez la femme. La principale cause de cette localisation anévrysmale est l’athérosclérose.
- Le risque d’évolution spontanée de l’anévrysme de l’aorte abdominale est la rupture d’où l’importance d’un diagnostic précoce et de leur correction, lorsque le diamètre est supérieur à 5 cm.
- Le traitement de l’anévrysme abdominal peut être chirurgical ou endovasculaire (endoprothèse couverte).
- La dissection aortique correspond à un clivage longitudinal de la paroi aortique, consécutif à une déchirure de la média, plus rarement de l’intima, à l’origine du développement d’un vrai et d’un faux chenal.
- La principale cause de la dissection aortique est l’athérosclérose, suivie des anomalies anatomiques de la média et plus rarement des causes iatrogènes (cathétérisme artériel lors des actes de cardiologie interventionnelle).
- La classification de Stanford distingue le type A, dissection de l’aorte ascendante du type B, intéressant les autres segments de l’aorte thoracique.
- À côté de la dissection aortique classique sont décrits l’hématome intramural, l’ulcère pénétrant de l’aorte et la rupture sous-intimale.
- Les dissections de type A, intéressant l’aorte ascendante, sont une indication chirurgicale formelle ; les dissections de type B bénéficient d’un traitement médical et d’un contrôle de la pression artérielle. Le suivi des dissections de type B permet de déterminer l’indication opératoire éventuelle.
- L’artériopathie oblitérante des membres inférieurs correspond à une atteinte artérielle obstructive des artères des membres inférieurs, le plus souvent consécutive à l’athérosclérose.
- La classification de Leriche et Fontaine en quatre stades doit être utilisée, les stades III, ischémie de repos avec douleur de décubitus et IV ischémie de repos avec troubles trophiques caractérisant l’ischémie critique.
- La claudication intermittente est une douleur ou une crampe typiquement localisée au mollet, apparaissant à la marche, de caractère plus ou moins intense, obligeant le patient à s’arrêter. La douleur cède alors à l’arrêt de l’effort et réapparaît à la même distance en cas de reprise de la marche, définissant un périmètre de marche.
- Le syndrome de Leriche correspond à une obstruction de l’aorte sous rénale et des artères iliaques primitives.
- Le traitement de l’artériopathie oblitérante des membres inférieurs repose sur le contrôle des facteurs de risque d’athérome, sur l’association d’antiagrégants plaquettaires, statines et inhibiteurs de l’enzyme de conversion ou antagonistes des récepteurs de l’angiotensine.
- Les indications chirurgicales ou du traitement endovasculaire dépendent du retentissement fonctionnel et de l’état artériel.
- L’ischémie critique des membres répond à une définition clinique, l’association de douleurs ischémiques de décubitus, d’une baisse de la pression systolique à la cheville et/ou à l’orteil, ou de la présence d’une ulcération ou gangrène du pied ou des orteils évoluant depuis plus de 15 jours, avec retentissement sur les pressions systoliques d’aval.
- Le traitement d’une ischémie critique de membres est une urgence médico chirurgicale.
- L’ischémie aiguë d’un membre est secondaire à une interruption brutale du flux artériel responsable d’une hypoxie tissulaire abrupte pouvant aboutir à une nécrose cellulaire, voire à la perte d’un segment ou de la totalité d’un membre.
- Le diagnostic d’ischémie aiguë des membres inférieurs est clinique. Deux causes s’opposent, la thrombose artérielle in situ et l’embolie sur artère saine, avec des associations possibles entre les deux.
- En cas d’ischémie aiguë des membres, la revascularisation doit toujours être tentée, en privilégiant les solutions chirurgicales.
- D’autres localisations de l’ischémie sont possibles telles l’ischémie mésentérique aiguë ou chronique, dont l’athérosclérose est la principale cause.
- L’ischémie mésentérique aiguë est une urgence vitale dont la prise en charge est multidisciplinaire et dont la cause la plus fréquente est l’embolie artérielle.
________________________________________________________________________________
7.2 Pathologie vasculaire cérébrale : principales présentations cliniques
Auteurs : J. Capron et A. Cohen
Les accidents vasculaires cérébraux (AVC) constituent l’un des principaux problèmes de santé publique dans les pays industrialisés. Ils représentent la troisième cause de mortalité après la maladie coronaire et les cancers et sont la première cause de handicap chez l’adulte.
L’incidence des AVC en France est estimée entre 2 et 3 pour 1 000 habitants/an (environ 100 000 à 150 000 nouveaux cas par an), la prévalence étant quant à elle estimée entre 4 et 6 pour 1 000 habitants. L’incidence et la prévalence des AVC sont en diminution constante, du fait de la meilleure prise en charge des facteurs de risque vasculaire.
On distingue les AVC ischémiques : infarctus cérébral ou AVC ischémique constitué, et accident ischémique transitoire (AIT) (encadré) ; et les hématomes cérébraux ou AVC hémorragiques.
La définition de l’AVC est clinique : il s’agit d’un déficit neurologique de survenue brusque. Les symptômes d’AIT les plus fréquents sont résumés tableau 7.1. Le déficit peut être transitoire et généralement inférieur à 1 heure (AIT) ou persistant. En cas de déficit persistant, seule l’imagerie permettra de distinguer un infarctus cérébral d’un hématome.
Les causes de l’AIT sont les mêmes que celles de l’infarctus cérébral, avec un risque élevé de récidive ischémique notamment sous forme d’infarctus cérébral dans les premiers jours. Il s’agit donc d’une urgence thérapeutique et diagnostique. En cas de déficit neurologique transitoire, on distinguera l’AIT (IRM avec séquence de diffusion normale) de l’infarctus cérébral avec déficit rapidement régressif (ischémie sur la séquence de diffusion).
________________________________________________________________________________
Accidents ischémiques transitoires (AIT)
Définition
Épisode bref de dysfonction neurologique par ischémie focale cérébrale ou rétinienne, dont les symptômes cliniques durent typiquement moins d’une heure, sans preuve d’infarctus aigu (IRM de diffusion normale).
Diagnostic étiologique
Voir encadré plus bas « Diagnostic étiologique des AIC et AIT »
Évolution
- 30 % des AIC sont précédés d’AIT
- 10 % des AIT présenteront un AIC dans le mois qui suit avec un risque maximal dans les jours suivant l’AIT (10 – 20 % à 1 an)
- Mortalité × 3 par rapport à la population générale après un AIT
Conduite à tenir
- Hospitalisation en urgence idéalement en unité de soins intensifs neurovasculaires
- Monitoring cardiotensionnel et ECG – oxymétrie –
Traitement antithrombotique
- Antiagrégant plaquettaire (aspirine, 160-300 mg en IVD puis 75 mg/jour)
- Traitement anticoagulant
- à doses curatives : uniquement en cas de cardiopathie à haut risque emboligène (FA, thrombus des cavités gauches, prothèse mécanique valvulaire)
Traitements symptomatiques
- Contrôle tensionnel
- Correction des facteurs de risque (tabac, dyslipidémie)
- Réadaptation et éducation thérapeutique
________________________________________________________________________________
Les signes d’AVC les plus fréquents sont espace + :
- hémiplégie (notamment à prédominance brachio-faciale)
- aphasie
- hémianopsie latérale homonyme
- anesthésie hémicorporelle
- héminégligence
- cécité monoculaire (souvent transitoire)/AIT rétinien
L’AVC est une affection trompeuse et parfois les signes sont aspécifiques ou peu invalidants : notamment diplopie, dysarthrie, instabilité, déficit moteur ou sensitif isolé d’un membre, confusion. La survenue brutale est un argument fort pour une origine vasculaire.
Pathologie ischémique cérébrale (AVC ischémiques)
On différencie les accidents ischémiques transitoires (AIT) des infarctus cérébraux ou accidents ischémiques constitués (AIC). L’interrogatoire du patient et de son entourage est capital. Cet interrogatoire s’attache à rechercher les arguments en faveur de la survenue brutale de signes neurologiques focaux en rapport avec l’atteinte d’un territoire artériel cérébral, d’en déterminer l’heure précise de début et par conséquent la durée. Si celle-ci est supérieure à 24 heures, sauf éléments contraires à l’imagerie, il s’agit d’un AIC, c’est-à-dire d’un infarctus cérébral. En revanche, si les signes neurologiques régressent en moins de 24 heures, sous réserve de l’imagerie cérébrale, le diagnostic retenu sera alors celui d’AIT. L’interrogatoire doit par ailleurs préciser au mieux le mode de survenue. Celui-ci est le plus souvent brutal mais peut aussi se faire par à-coups dans le cas d’occlusion artérielle progressive. La symptomatologie neurologique peut parfois survenir ou varier selon la position du patient ou encore selon les modifications de pression artérielle évoquant ainsi un mécanisme hémodynamique sur une sténose. Plus rarement, l’installation des symptômes peut être progressive sur quelques heures, comme cela est parfois constaté dans certaines occlusions du tronc basilaire.
La survenue brutale de signes neurologiques focaux impose donc une prise en charge urgente, si possible en milieu spécialisé, afin d’abord de préciser le diagnostic lésionnel et étiologique ainsi que de permettre la mise en route de traitements adaptés et d’éviter dans la mesure du possible l’aggravation ou la récidive précoce. L’AIT ne doit pas être considéré comme bénin, il constitue une urgence diagnostique et thérapeutique car le risque de récidive sous la forme d’infarctus cérébral est élevé.
Examens complémentaires
Diagnostic lésionnel cérébral en phase aiguë
Il s’agit d’une urgence absolue avec une admission directe en radiologie si le patient est pris en charge à domicile. L’examen de référence est un scanner sans injection puis angioscanner, une IRM est pratiquée si elle ne diffère pas la prise en charge.
Le scanner cérébral sans injection est normal pour l’AVC ischémique (ou signes précoces : effacement du ruban cortical et des ganglions de la base) ou montre une hyperdensité spontanée pour l’AVC hémorragique. L’angioscanner pourra mettre en évidence une occlusion artérielle responsable de l’AVC en cas d’ischémie, ou une malformation vasculaire responsable de l’AVC en cas d’hémorragie.
L’IRM cérébrale met en évidence un hypersignal diffusion avec restriction du coefficient apparent de diffusion (signant un œdème cytotoxique) en cas d’AVC ischémique ou un hyposignal en séquence de susceptibilité magnétique (T2* ou SWAN ou SWI selon les appareils) en cas d’AVC hémorragique. La séquence vasculaire en temps de vol non injectée (TOF pour time of flight) pourra mettre en évidence une occlusion artérielle pour l’AVC ischémique mais elle est moins rentable que l’angioscanner pour mettre en évidence une malformation vasculaire en cas d’AVC hémorragique.
On cherchera d’autres anomalies : notamment des séquelles d’AVC (hypodensité au scanner ou hypersignal FLAIR respectant un territoire vasculaire), une contre-indication à la thrombolyse (hématome sous-dural ou séquelle hémorragique visible en susceptibilité magnétique IRM) ou un diagnostic différentiel (tumeur cérébrale responsable d’épilepsie).
L’apport principal de l’IRM sur le scanner est de confirmer le diagnostic d’AVC en phase aiguë avec la positivité de la séquence de diffusion alors que le scanner permet seulement d’écarter un AVC hémorragique. Une IRM normale plaide en faveur de diagnostics différentiels, notamment épilepsie, aura migraineuse ou hypoglycémie profonde.
Diagnostic étiologique
Les trois causes principales d’AVC sont l’embolie d’origine cardiaque, l’athérosclérose des troncs supra-aortiques ou intracrâniens et la lacune.
La principale cause d’embolie cardiaque est la FA, raison pour laquelle on pratiquera un ECG précoce et un enregistrement télémétrique pendant toute la durée de l’hospitalisation (minimum 72 heures) ainsi qu’un Holter-ECG en externe, voire un Holter implantable en cas de négativité du bilan étiologique cardiaque. L’échographie cardiaque transthoracique (ETT) et transœsophagienne (ETO) cherchera un thrombus des cavités gauches, une végétation d’endocardite, infectieuse ou non, une cardiopathie ischémique avec asynergie segmentaire, une dysfonction systolique VG sévère, une tumeur valvulaire, un athérome aortique et un foramen ovale perméable (épreuve de contraste), avec ou sans anévrisme du septum interauriculaire.
L’athérosclérose des troncs supra-aortiques ou intracrâniens sera mise en évidence par un écho-Doppler, un angioscanner ou une ARM. Il est indispensable d’explorer les vaisseaux cervicaux et intracrâniens avec un caractère particulièrement opérateur dépendant de l’écho-Doppler transcrânien.
L’AVC ischémique lacunaire est défini par une ischémie profonde de diamètre inférieur à 15 mm associée à d’autres signes d’artériopathie hypertensive que sont la leucopathie vasculaire et les microsaignements profonds visibles en IRM avec une histoire d’hypertension chronique.
________________________________________________________________________________
Diagnostic étiologique des AIC et AIT
Macro-angiopathie (30 %)
- Athérosclérose des troncs supra-aortiques ou des artères intracrâniennes (mécanismes : thromboemboliques par fragmentation d’un thrombus avec rupture de plaque et occlusion d’une artère distale ; thrombotique par occlusion artérielle au contact de la plaque ; hémodynamique)
- Dissection des artères cervico-encéphaliques
Maladie des petites artères cérébrales (infarctus lacunaires) (20 %)
- Lipo-hyalinose des artères perforantes (20 %), petits infarctus profonds de < 15 mm de diamètre liés à l’occlusion d’une artériole profonde sur artériopathie locale (lipohyalinose)
Cardiopathies emboligènes (20 %)
- À haut risque : FA (cause la plus fréquente), thrombose des cavités gauches, tumeurs, endocardites, athérosclérose aortique, valvulpathie mitrale sténosante, prothèse mécanique ; etc.
- À faible risque : anévrisme du septum interatrial, foramen ovale perméable, etc.
- Flutter atrial
Autres causes (5 %)
- Hémopathies, SAPL, CIVD, etc.
- Maladies métaboliques (drépanocytose, maladie de Fabry, mitochondriopathies)
________________________________________________________________________________
Examens biologiques
- Standard en urgence : glycémie (diagnostic différentiel : hypoglycémie), hémogramme, hémostase, CRP, troponine, ionogramme sanguin avec créatinine, bilan hépatique.
- Standard à jeun : glycémie, bilan lipidique, T4-TSH.
- Si fièvre : Hémocultures (endocardite avec embole septique).
- Spécifiques (AIC cryptogénique, sujet jeune) : bilan infectieux (syphilis, VIH, VHC, VHB), recherche de SAPL (antiphospholipide, anticardiolipine, anti-bêta2GP1, anticoagulant circulant), bilan auto-immun (FAN, anti-DNA, FAN soluble, ANCA, cryoglobuline, complément), recherche d’hémopathie (électrophorèse des protéines, bêta2microglobuline), recherche de mutation JAK2.
- À discuter : recherche de thrombophilie (antithrombine III, protéine C, protéine S, résistance à la protéine C activée/facteur V Leiden, anti-prothrombine) et la réalisation d’une ponction lombaire (notamment si céphalées ou point d’appel inflammatoire ou infectieux).
Conduite à tenir
Prise en charge initiale d’un AVC ischémique
- Hospitalisation en urgence idéalement en unité de soins intensifs neurovasculaires
- Monitoring cardiotensionnel et ECG – oxymétrie –
- Alitement strict initial à 30° (risque d’hypoperfusion cérébrale en cas de sténose serrée des troncs artériels supra-aortiques ou intracrâniens)
Thrombolyse intraveineuse
- < 4 h 30 suivant l’installation des 1ers signes d’AIC
- En l’absence de contre-indications = sévérité de l’AVC (troubles de la vigilance)/taille massive de l’infarctus (IRM)/niveau de pression artérielle
- rt-PA = ALTEPLASE (Actilyse®) 0,9 mg/kg en une heure en IVSE, assuré par un médecin spécialisé en neurovasculaire
- Nécessite de traiter l’HTA dès que PA > 185/110 mmHg
- S’accompagne d’un risque élevé d’hémorragie cérébrale et systémique (gastrique)
Thrombectomie
Une thrombectomie en neuroradiologie interventionnelle est proposée dans les 6 heures suivant l’installation des symptômes. Ce délai peut être étendu à 24 heures selon des critères de perfusion cérébrale (techniques non détaillées ici). La thrombectomie s’applique aux infarctus cérébraux avec occlusion artérielle. Elle est combinée à la thrombolyse sauf contre-indication à celle-ci (notamment traitement anticoagulant ou risque d’hémorragie systémique). L’efficacité est bien supérieure à celle de la thrombolyse seule.
Antiagrégant plaquettaire (aspirine, 160-300 mg en IVD)
- Si patient thrombolysé : uniquement après un délai de 24 heures et après s’être assuré de l’absence de transformation hémorragique au scanner
- Si patient non thrombolysé (hors délai ou contre-indication) : le plus précocement possible
Traitement anticoagulant
- À doses préventives par HBPM (alitement) : débuté 24 heures après la thrombolyse
- À doses curatives : il ne s’agit pas d’un traitement de l’AVC en phase aiguë. On l’initiera en cas de cardiopathie à haut risque emboligène (ACFA, thrombus des cavités gauches, prothèse mécanique valvulaire), le délai d’instauration dépend du volume de l’AVC (de 1 à 14 jours).
Traitements symptomatiques
- Contrôle tensionnel en tolérant une hypertension adaptative qui peut aller jusqu’à 220/120 mmHg (sauf si thrombolyse : 185/110 mmHg).
- Éviter l’hypotension qui aboutirait à une majoration des lésions ischémiques.
- Position à plat stricte les 24 premières heures.
- Correction de l’hypocanie, de l’hyperthermie, de l’hyperglycémie, de l’anémie.
- Correction des facteurs de risque (tabac) prescription systématique d’une statine
- Réadaptation et éducation thérapeutique.
Pathologie hémorragique cérébrale (AVC hémorragiques)
Les AVC hémorragiques sont des hématomes cérébraux spontanés. Il peut être difficile de faire la différence avec un hématome post-traumatique car un hématome spontané peut être responsable d’une chute avec traumatisme crânien. Dans le doute, on appliquera la même prise en charge que pour un hématome spontané.
Étiologie
L’hypertension artérielle chronique est responsable de la grande majorité des hématomes cérébraux. Le mécanisme est une rupture d’artérioles fragilisées par une microangiopathie hypertensive chronique. Ces hématomes sont de siège profond et sont associés à des signes de retentissement chronique de l’hypertension au niveau cérébral (microsaignements profonds, leucoaraïose/leucopathie hypertensive) ou systémiques (notamment cardiopathie ou rétinopathie hypertensive) chez un patient de plus de 50 ans présentant une hypertension ancienne. Si ces critères ne sont pas remplis il faudra pratiquer une artériographie cérébrale à la recherche d’une malformation vasculaire sous-jacente (malformation artérioveineuse ou fistule artérioveineuse notamment) et on fera toujours une IRM de contrôle à distance à la recherche d’un saignement sur une tumeur cérébrale notamment métastatique ou un cavernome.
L’angiopathie amyloïde cérébrale est responsable de 10 à 20 % des hématomes cérébraux. Il s’agit d’une maladie des artères cérébrales superficielles/lobaires par dépôt de protéines bêta-amyloïde dans la paroi du vaisseau (à la différence de la maladie d’Alzheimer où elle est dans le neurone). Le saignement est toujours de siège lobaire hémisphérique. Ces saignements deviennent plus fréquents avec le vieillissement de la population et la prescription plus répandue d’anticoagulants chez les sujets âgés (à juste titre) avec des saignements liés à l’hypertension moins fréquents du fait d’une meilleure prise en charge de l’HTA chronique.
Les autres causes principales sont :
- les troubles de la coagulation notamment la prise d’anticoagulants : on ne se limitera jamais à ce diagnostic et le bilan est le même que si ce trouble n’existait pas ;
- l’endocardite infectieuse avec hématome par rupture d’anévrisme mycotique ;
- la thrombophlébite cérébrale ;
- autres : notamment artérite cérébrale (vascularite cérébrale primitive notamment), causes toxiques (cocaïne notamment)
Sémiologie clinique
Interrogatoire
- Facteurs de risque vasculaire (HTA en particulier, traitement anticoagulant).
- Aucun signe clinique ne permet de distinguer un AVC ischémique d’un AVC hémorragique, on pourra retenir que l’AVC hémorragique est souvent plus grave avec un déficit important, des troubles de la vigilance, une épilepsie et des céphalées.
Diagnostic par imagerie cérébrale
TDM cérébrale sans injection
- Deux signes positifs d’hématome :
-
- hyperdensité spontanée homogène ;
- absence de systématisation à un territoire artériel.
- Signes associés à rechercher :
-
- hémorragie méningée et/ou ventriculaire associée ;
- œdème périlésionnel : hypodensité mal limitée périphérique de l’hématome (dont il faut évaluer l’importance) ;
- effet de masse = déformation ± déviation des structures médianes ;
- hydrocéphalie aiguë (si hématome sous-tentoriel cérébelleux ou en cas d’inondation ventriculaire).
IRM avec séquence FLAIR et T2* ± ARM
- Séquences de susceptibilité magnétique (T2* ou SWI ou SWAN) : séquences de référence pour diagnostiquer l’hématome en IRM. Arguments pour une microangiopathie hypertensive (microsaignements profonds) ou angiopathie amyloïde (microsaignements lobaires et sidérose corticale superficielle).
- FLAIR = hypersignal d’apparition précoce.
- ARM si possible pour établir un diagnostic étiologique + lésions associées (malformation artérioveineuse).
Évolution
- Mortalité à 1 mois : 30 %.
- Signes de gravité :
-
- engagement cérébral ;
- inondation ventriculaire ;
- hydrocéphalie aiguë.
Conduite à tenir
Prise en charge initiale
- Hospitalisation en urgence idéalement en unité de soins intensifs neurovasculaires.
- Monitoring cardiotensionnel et ECG – oxymétrie.
- Redresser le patient notamment en cas de signes d’hypertension intracrânienne.
- Traitement antihypertenseur avec un objectif tensionnel inférieur à 140 mmHg pour la PAS.
Interruption de tout traitement antithrombotique
Traitement neurochirurgical (rare)
- Hématome cérébelleux avec hydrocéphalie pour dérivation ventriculaire externe en urgence et volet occipital.
- Évacuation de l’hématome en cas de volumineux hématome lobaire chez un sujet jeune.
- Malformation vasculaire (traitement souvent neuro-interventionnel).
Traitements symptomatiques
- Contrôle tensionnel.
- Correction de l’hypocapnie, de l’hyperthermie, de l’hyperglycémie, de l’anémie.
- Antagonisation par PPSB et Vitamine K si traitement par AVK (et mesures spécifiques si traitement par anticoagulants oraux directs).
- Réadaptation et éducation thérapeutique.
Thrombose veineuse cérébrale (TVC)
Définition
Il s’agit d’une thrombose des sinus veineux (< 2 % des AVC).
Diagnostic clinique
- Installation aiguë ou progressive sur quelques semaines.
- Syndrome d’hypertension intracrânienne (HTIC) : en priorité céphalées matinales et de décubitus (isolées dans 25 % des TVC), paralysie du VI (diplopie dans le regard externe), éclipses visuelles, nausées et vomissements, troubles de la vigilance si sévère.
- Déficit neurologique focal (hématome lobaire ou ischémie secondaire à la thrombophlébite).
- Crises épileptiques (rares mais évocatrices) :
-
- le plus souvent à début partiel ± secondairement généralisées ;
- typiquement symptomatologie motrice et hémicorporelle à bascule.
- Topographies selon les signes neurologiques focaux (inconstants et variables).
Diagnostic en imagerie cérébrale
- IRM cérébrale injectée au gadolinium avec angio-IRM veineuse : signes positifs par visualisation du sinus thrombosé.
- IRM :
-
- sans injection = hyper-T1 + Hyper -T2 révélateurs de la veine thrombosée mais hypo -T2* ;
- avec injection = « signe du delta » (si sinus) ou « signe de la corde » (si veine corticale).
- Angio-IRM veineuse :
-
- absence de flux dans le sinus occlus ;
- signes de gravité du retentissement sur le parenchyme cérébral ;
- œdème cérébral vasogénique (HTIC) : Effet de masse (effacement des sillons corticaux et déviation des ventricules) ;
- infarctus veineux non systématisé à un territoire artériel : hypersignal cérébral en diffusion ou T2/FLAIR ;
- remaniement hémorragique : hyposignal en séquence de susceptibilité magnétique (T2* ou SWI ou SWAN) au sein de la zone d’infarctus.
- Effet de masse :
-
- hydrocéphalie aiguë ;
- signes en faveur d’une étiologie : tumeur cérébrale comprimant un sinus (méningiome).
Diagnostic étiologique
Causes générales
- Postopératoire neurochirurgical
- Grossesse et post-partum
- Contraception orale (surtout en association au tabac)
- Affections hématologiques
- Troubles de l’hémostase congénitaux (déficit en protéine C – protéine S – antithrombine III) ou acquis (anticoagulant circulant – CIVD – cryoglobulinémie)
- Hypotension du LCR (notamment syndrome post-ponction lombaire)
- Infections (septicémies – endocardite)
- Cancers et chimiothérapies
- Maladies inflammatoires (Behçet)
- Déshydratation extracellulaire sévère
- Cirrhose
Causes locales
- Infections de voisinage (ou simple inflammation) : otite – mastoïdite – sinusite – infection buccodentaire
- Infections intracrânienne : abcès – empyème sous-dural – méningite
- Traumatisme crânien = ouvert ou fermé – avec ou sans fracture
- Intervention neurochirurgicale
- Malformation vasculaire : fistule dure-mérienne
- Cathétérisme jugulaire
Conduite à tenir
Prise en charge initiale
- Hospitalisation en urgence idéalement en unité de soins intensifs neurovasculaires
- Monitoring cardiotensionnel et ECG – oxymétrie –
- Traitement symptomatique : antalgiques, anti-épileptiques si crise
- Ponction lombaire systématique à la recherche d’une thrombophlébite septique, avec mesure de pression (quantification de l’HTIC et recherche d’hypotension du LCR qui est une cause de TVC). L’évacuation de LCR permet souvent de soulager les céphalées de l’HTIC.
Traitement anticoagulant
- Efficace, selon la sévérité, on utilisera une HNF IVSE ou une HBPM sous-cutanée, relais oral par AVK ou AOD.
- Durée minimale de 6 mois, et plus selon l’existence d’une thrombophilie.
Traitement étiologique
Traitements symptomatiques
- Contrôle tensionnel
- Correction des facteurs de risque (tabac, pilule microdosée)
- Réadaptation et éducation thérapeutique
________________________________________________________________________________
Points importants
- L’incidence des AVC est estimée entre deux et trois pour 1 000 habitants en France. La prévalence est estimée entre quatre et six pour 1 000 habitants.
- On distingue les AVC ischémiques, infarctus cérébral ou AVC ischémique constitué, les accidents ischémiques transitoires et les hématomes cérébraux ou AVC hémorragique.
- La définition d’un AVC est clinique, déficit neurologique de survenue brusque.
- Les signes d’AVC ischémique les plus fréquents sont l’hémiplégie, notamment à prédominance brachiofaciale, l’aphasie, l’hémianopsie latérale homonyme, l’anesthésie hémicorporelle, l’héminégligence et la cécité monoculaire le plus souvent transitoire.
- L’accident ischémique transitoire est un épisode bref de dysfonction neurologique par ischémie focale, cérébrale ou rétinienne dont les symptômes cliniques durent typiquement moins d’une heure, sans preuve d’infarctus aigu, avec une IRM de diffusion normale.
- Les causes d’AIT ou d’AIC sont la macro-angiopathie (30 %), la maladie des petites artères cérébrales ou infarctus lacunaire (20 %), les cardiopathies emboligènes, dominées par la fibrillation atriale (20 %).
- Les autres causes (5 %) sont beaucoup plus rares, hémopathie, SAPL, maladies métaboliques…
- Le traitement d’un accident ischémique cérébral (AIC) repose sur la thrombolyse intraveineuse précoce (< 4 h 30 suivant l’installation des premiers signes d’AIC), complété d’une thrombectomie (< 6 h 00 suivant l’installation des premiers signes d’AIC) s’il y a une occlusion d’une grosse artère (carotide interne, cérébrale moyenne proximale, tronc basilaire).
- Dans tous les cas, un antiagrégant plaquettaire est prescrit au décours d’un AIC/AIT de façon systématique et indéfinie.
- Les anticoagulants au décours d’un AIC/AIT sont indiqués en cas de cause cardio-embolique, fibrillation atriale, prothèse mécanique valvulaire…
- La thrombose veineuse cérébrale, d’installation aiguë ou progressive sur quelques semaines, est caractérisée par un syndrome d’hypertension artérielle intracrânienne, un déficit neurologique focal avec un risque de convulsion. Le diagnostic repose sur l’imagerie cérébrale, IRM et angio-IRM veineuse.
________________________________________________________________________________
7.3 Maladie thromboembolique veineuse
Auteur : Guy Meyer†
Si la maladie thromboembolique veineuse (MTEV) ne résume pas à elle seule les affections du système veineux ni l’ensemble de la pathologie vasculaire pulmonaire, elle représente de loin la maladie veineuse la plus grave. Ce chapitre sera donc essentiellement consacré à la MTEV et à ses deux principales manifestations : la thrombose veineuse profonde (TVP) et l’embolie pulmonaire (EP) et à leurs conséquences : syndrome post-thrombotique et hypertension pulmonaire thromboembolique chronique.
Épidémiologie
Incidence
Sauf indication contraire, les chiffres donnés ci-dessous concernent les EP et les TVP des membres inférieurs. Les thromboses veineuses superficielles, les thromboses des membres supérieurs et les thromboses viscérales, ne sont pas prises en compte.
L’incidence de la MTEV est de l’ordre de 160 cas pour 100 000 habitants en France (répartis entre un tiers d’EP et deux tiers de TVP). Ces chiffres sont stables ces vingt dernières années. L’incidence augmente très sensiblement avec l’âge. La MTEV est exceptionnelle chez l’enfant ; le nombre de cas annuels est de l’ordre de 40 pour 100 000 entre 20 et 40 ans et atteint près de 800 pour 100 000 après 75 ans. L’incidence est à peu près identique chez l’homme et chez la femme ; celle des thromboses veineuses superficielles est de l’ordre de 60 pour 100 000.
Facteurs de risque et circonstances déclenchantes
Facteurs de risque cliniques
Près de 50 % des cas de MTEV surviennent de façon spontanée, sans facteur de risque clairement identifié (MTEV idiopathique ou non provoquée). Les autres sont provoqués potentiellement par un ou plusieurs des principaux facteurs de risque (tableau 7.3).
Tableau 7.3. Facteurs de risques cliniques de maladie thromboembolique veineuse.
| Facteur de risque | Pourcentage des cas de MTEV |
| Chirurgie | 20 % |
| Cancer | 18 % |
| Traumatisme | 12 % |
| Immobilisation | 10 % |
| Grossesse, post-partum | 2 % |
| Contraception | 1 % |
| Autre | 3 % |
| Aucun facteur clinique identifiable | 50 % |
MTEV : maladie thromboembolique veineuse
La chirurgie multiplie le risque par 20 ; les interventions qui comportent le risque le plus élevé sont les interventions de chirurgie orthopédique majeure de la hanche et du genou et la chirurgie du petit bassin, notamment carcinologique. La présence d’un cancer multiplie le risque de MTEV par six. Les cancers du pancréas, de l’estomac, du système nerveux central et du poumon comportent les risques les plus élevés ; le risque est également plus élevé dans les formes métastatiques et pendant les premiers mois après la découverte du cancer (cancer actif). Une thrombose peut même constituer la première manifestation d’un cancer jusque-là méconnu. Les traitements du cancer : chirurgie, chimiothérapie et radiothérapie (ainsi que les cathéters veineux centraux) favorisent également les thromboses. Les traumatismes des membres inférieurs et les polytraumatismes favorisent les thromboses, même en l’absence d’intervention chirurgicale. Toute source d’immobilisation : alitement de plus de 72 heures, paralysie ou immobilisation plâtrée d’un membre inférieur, favorise la MTEV. Pendant la grossesse, le risque de MTEV est multiplié par 3 ; la moitié des épisodes survient pendant la grossesse elle-même, l’autre moitié pendant le post-partum (principalement avant la sixième semaine du post-partum). La contraception œstroprogestative multiplie également le risque par 3. Les épisodes de MTEV étaient particulièrement fréquents avec les pilules de 3e génération (doublement du risque par rapport aux secondes générations) ; ils sont beaucoup plus rares avec les contraceptifs purement progestatifs et sont également favorisés par le traitement hormonal substitutif de la ménopause quand il est administré par voie orale.
Les facteurs de risque cardiovasculaire classiques : tabac, hypertension artérielle, hypercholestérolémie, diabète, ont un rôle mineur voire incertain.
D’autres facteurs de risque chroniques ont été identifiés, il s’agit de l’insuffisance cardiaque, de l’obésité, des maladies inflammatoires chroniques intestinales (MICI), du syndrome néphrotique, de la maladie de Behçet et de certains médicaments : thalidomide et lenalidomide, employés dans le myélome, L-asparaginase employée dans les leucémies lymphoblastiques, certains psychotropes. Les voyages aériens de plus de six heures augmentent également le risque de MTEV, mais le risque absolu est faible (moins de 1 cas par million de passagers). Enfin, la relation varices – MTEV n’est pas claire.
Facteurs de risque biologiques
Ces facteurs de risque, souvent rassemblés sous le vocable de thrombophilie comportent des particularités constitutionnelles et des anomalies acquises (tableau 7.4).
Tableau 7.4. Principales thrombophilies biologiques.
| Thrombophilies biologiques | Taux dans la population générale | Taux chez les patients atteints de MTEV |
| Déficit en antithrombine | 0,02 % | 1 % |
| Déficit en protéine C | 0,2 % | 3 % |
| Déficit en protéine S | 0,2 % | 2 % |
| Mutation Leiden du facteur V | 5 % | 20 % |
| Mutation Leiden du facteur II | 2 % | 6 % |
| Syndrome des antiphospholipides | NA | 10 % |
| Taux élevé de facteur VIII | 11 % | 25 % |
| Groupe sanguin non O | 67 % | 71 % |
Ces facteurs de risque biologiques peuvent constituer le seul facteur de risque en l’absence de circonstance ou de facteur de risque clinique, ils peuvent également se combiner à un facteur de risque clinique dont ils augmentent le risque.
Finalement, environ 30 % des épisodes de MTEV surviennent sans aucun facteur favorisant ni clinique ni biologique (MTEV idiopathique sans thrombophilie associée).
Anatomie (voir aussi chapitre 1)
L’anatomie veineuse suit habituellement l’anatomie artérielle. On distingue le système cave supérieur qui draine les membres supérieurs, la face et l’encéphale et le système cave inférieur qui draine les membres inférieurs et les organes du petit bassin. Les veines digestives se drainent dans la veine porte, et les veines sus-hépatiques se drainent dans la veine cave supérieure (fig. 7.19).
________________________________________________________________________________
Figure 7.19. Système cave inférieur et supérieur.
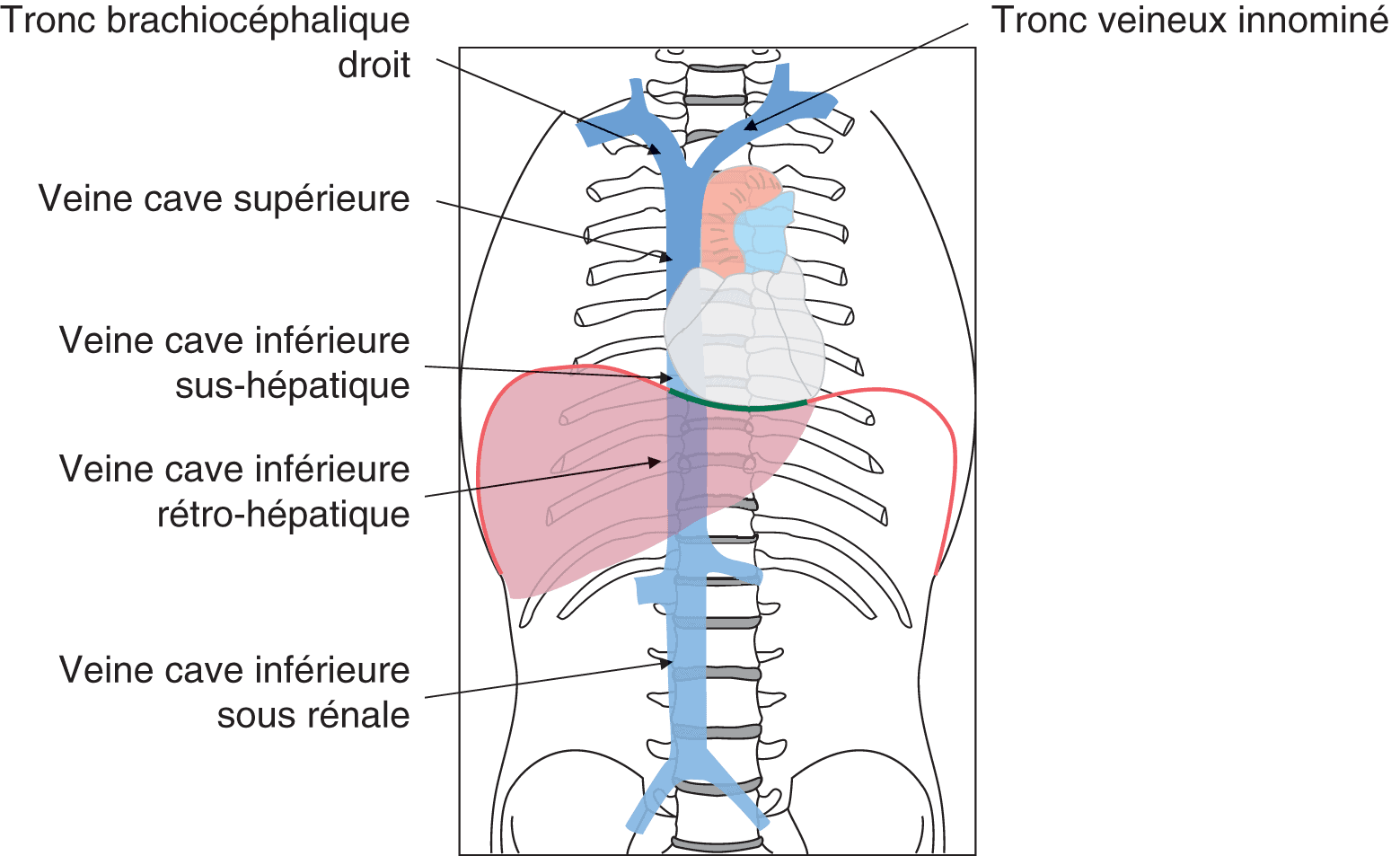
________________________________________________________________________________
Les deux veines caves se jettent dans l’atrium droit. Les veines superficielles des membres communiquent avec les veines profondes par l’intermédiaire de veines perforantes. Dans les membres inférieurs, le réseau veineux superficiel, qui siège dans le tissu conjonctif sous-cutané comprend deux veines principales qui sont habituellement visibles sous la peau (fig. 7.20) :
- la veine grande saphène (ou saphène interne), qui chemine le long de la face interne de jambe et de cuisse, pour se jeter dans la veine fémorale en formant une crosse ;
- la veine petite saphène (ou saphène externe), qui chemine le long de la face postérieure du mollet pour se jeter dans la veine poplitée.
________________________________________________________________________________
Figure 7.20. Réseau veineux profond et superficiel du membre inférieur.
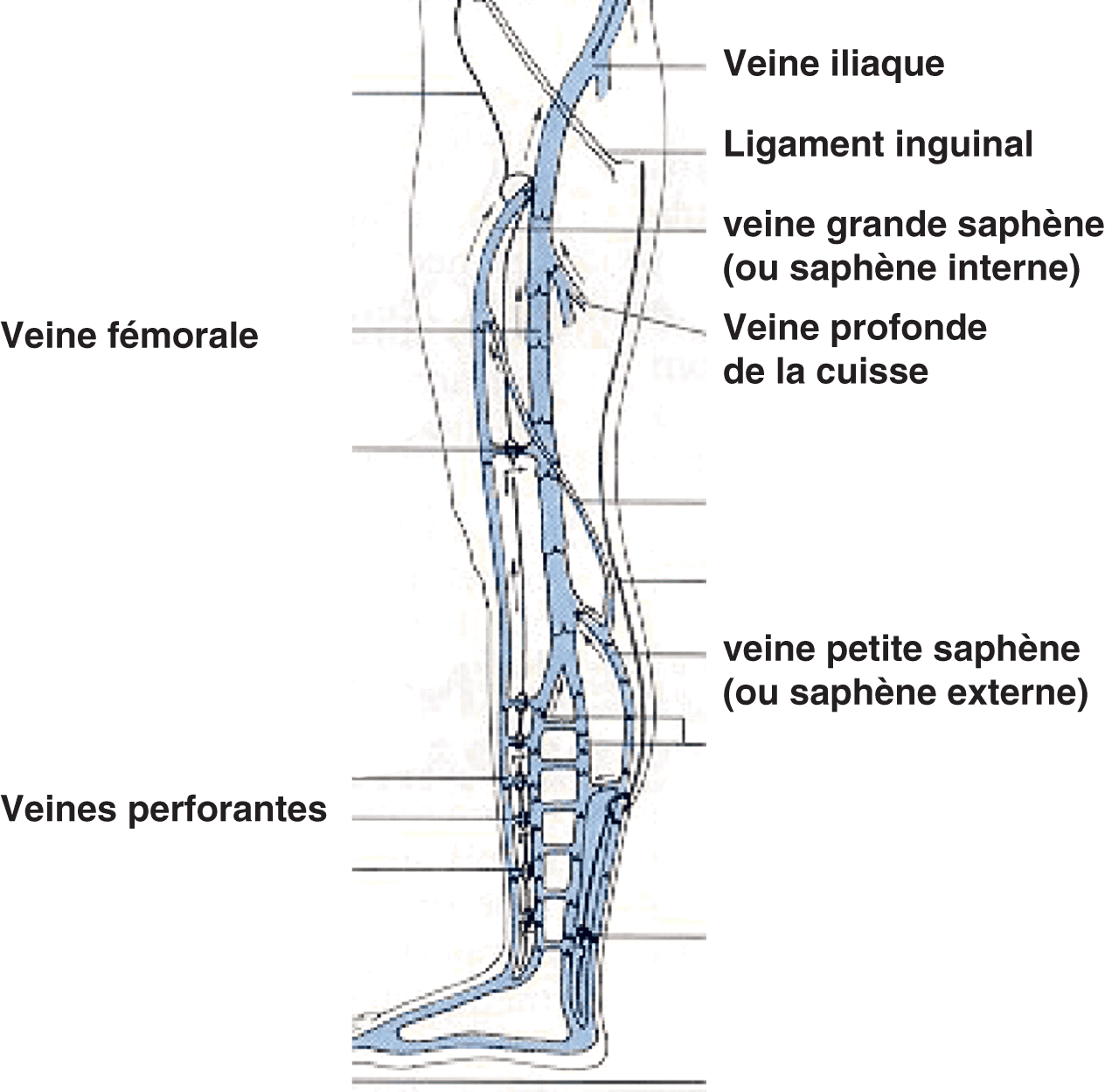
________________________________________________________________________________
Le réseau veineux profond est constitué par les veines satellites des artères de la jambe. Il existe, le plus souvent, deux veines pour une artère au niveau distal (sous-poplité) et parfois deux veines poplitées. Les veines musculaires comportent les veines jumelles (ou gastrocnémiennes), et les veines soléaires (fig. 7.20).
Toujours dans les membres inférieurs, les veines musculaires, tibiales et péronières constituent les veines distales ; les veines poplitée, fémorale, fémorale commune et iliaque constituent les veines proximales (fig. 7.20).
Les veines sont munies de valvules qui sont des replis endothéliaux en forme de coupes qui se remplissent par leur face supérieure. Lorsqu’elles sont remplies, elles ferment la lumière de la veine et empêchent un reflux sanguin en distalité. Elles jouent un rôle important car elles permettent le retour sanguin, chaque pas permettant de créer une chasse veineuse vers le haut. C’est souvent au niveau des valvules que se forment les thrombus initiaux.
Histologie
La paroi veineuse est composée de trois tuniques, comme celle des artères : l’intima, la média et l’adventice.
L’intima, qui comprend l’endothélium bordé par une membrane basale, est la tunique la plus interne de la veine, elle est en contact avec le sang et ses composantes.
La media est composée de cellules musculaires lisses et de matériel élastique ; elle permet la distension et la contraction de la paroi veineuse. Les cellules musculaires lisses sont toutefois moins nombreuses dans la paroi veineuse que dans la paroi artérielle, ce qui limite la contraction mais facilite la distension des veines.
L’adventice est, comme dans les artères, la tunique externe des veines. Elle est composée de tissu conjonctif.
Biologie
La coagulation qui est décrite dans le chapitre 1 ne sera pas détaillée ici. En revanche, nous détaillerons le rôle des inhibiteurs de la coagulation et de la fibrinolyse qui jouent un rôle important dans la physiopathologie de la MTEV.
Inhibiteurs de la coagulation
Afin de limiter l’extension et le déclenchement intempestif d’une thrombose veineuse il existe des inhibiteurs de la coagulation (fig. 7.21). Les plus importants sont l’antithrombine et le système thrombomoduline-protéine C-protéine S. Ces protéines régulent la coagulation intravasculaire en agissant sur différentes étapes spécifiques de la coagulation.
________________________________________________________________________________
Figure 7.21. Inhibiteurs naturels de l’hémostase : antithrombine, Protéine C et Protéine S. F : facteur.

________________________________________________________________________________
L’antithrombine (AT) inactive principalement la thrombine et le facteur Xa. En présence d’héparine, l’inactivation de ces facteurs est augmentée plus de 1 000 fois. La fixation de l’héparine à l’AT modifie le site actif de l’AT, le rendant plus apte à être clivé par les protéines activées de la coagulation qui vont alors être piégées et inhibées par l’AT. Physiologiquement, c’est le sulfate d’héparan, à la surface de l’endothélium, qui joue ce rôle d’activateur de l’AT. Les complexes thrombine-AT formés (ou TAT) peuvent être dosés dans la circulation et servir de marqueurs de la coagulation, au même titre que le fibrinopeptide A (FpA) ou les fragments 1 + 2 (F1 + 2) de la prothrombine.
La protéine C et la protéine S sont des protéines vitamine K-dépendantes. La protéine C nécessite, pour être activée, la fixation de la thrombine sur un récepteur situé sur la surface de l’endothélium : la thrombomoduline. La fixation de la thrombine à la thrombomoduline permet à cette dernière de perdre son activité pro-coagulante et d’acquérir une activité anticoagulante par le biais de l’activation de la protéine C. La protéine C activée inhibe deux facteurs de la coagulation, les facteurs Va et VIIIa. La dégradation enzymatique de ces deux cofacteurs par la protéine C ralentit de façon importante le processus de coagulation : il en résulte l’effet anticoagulant de la protéine C activée.
Pour être active, la protéine C nécessite elle-même un cofacteur : la protéine S qui existe sous deux formes dans le plasma : une forme libre, seule active, et une forme inactive liée à la C4b-binding protein (C4b-bp). Normalement, 40 % de la protéine S est sous forme libre et 60 % sous forme liée. La C4b-bp étant une protéine de l’inflammation, il peut en résulter une augmentation de la fraction liée de la protéine S.
Les déficits en antithrombine, protéine C et protéine S ont une transmission autosomique dominante et sont principalement liés à la survenue de thromboses veineuses. Leur rôle dans la thrombose artérielle n’a pas été démontré.
Fibrinolyse et ses inhibiteurs
Outre le système de la coagulation, le sang contient un système enzymatique responsable de la lyse du thrombus formé, qui agit par lyse de la fibrine ou fibrinolyse. Ce système est en équilibre avec celui de la coagulation, de façon à maintenir la fluidité du sang.
Le système fibrinolytique comprend un zymogène, le plasminogène, qui peut être converti en enzyme active, la plasmine, par deux activateurs du plasminogène différents ; l’activateur tissulaire du plasminogène (tPA) et l’urokinase.
Le plasminogène humain est une glycoprotéine, il est converti en plasmine par clivage enzymatique. Outre son rôle dans la fibrinolyse, la plasmine joue également un rôle important dans la migration cellulaire et le remodelage tissulaire.
L’activateur tissulaire du plasminogène ou tPA et, à une moindre échelle, la pro-urokinase (scu-PA) sont deux sérine-protéases qui activent le plasminogène préférentiellement à la surface de la fibrine. La plasmine fixée à la fibrine est protégée de son inhibition rapide par l’α2-antiplasmine et permet ainsi la dégradation locale de la fibrine. Le PAI-1 est une autre protéine plasmatique qui, en inhibant le tPA et l’urokinase, contribue à diminuer la fibrinolyse. La plasmine protéolyse la fibrine en produits de dégradation solubles.
La fibrinolyse joue un rôle majeur après la formation d’une EP ou d’une TVP. C’est elle qui permet la reperméabilisation des vaisseaux thrombosés, et parfois la restitution complète d’une veine périphérique thrombosée (environ 30 % des cas) et des artères pulmonaires dans l’EP (50 % des cas).
Physiologie et physiopathologie
Physiopathologie de l’EP
L’EP provient de la migration d’un thrombus veineux périphérique dans l’arbre artériel pulmonaire. Les thromboses locales sont exceptionnelles. Une fois logé dans une artère pulmonaire dont le calibre est inférieur au sien, le thrombus se bloque et ne peut gagner la circulation systémique. La seule possibilité pour cela est le passage du thrombus de l’oreillette droite vers l’oreillette gauche par un foramen ovale perméable ; on parle alors d’embolie paradoxale qui peut gagner notamment les territoires vasculaires cérébraux et y créer un accident vasculaire cérébral.
L’EP a des conséquences respiratoires souvent modérées et peut avoir des conséquences circulatoires qui en font toute la gravité. Elle constitue donc beaucoup plus souvent une insuffisance circulatoire qu’une insuffisance respiratoire.
Conséquences respiratoires
L’obstruction de la circulation pulmonaire est à l’origine d’un effet espace mort défini par des territoires ventilés qui sont peu ou pas perfusés. Une partie du poumon (siège de l’embolie) n’est plus vascularisée mais est toujours ventilée. Une telle zone ne participera donc pas aux échanges gazeux. Cet espace mort se traduit donc par une augmentation des différences artériolo-alvéolaires en CO2 d’où une baisse de la fraction expirée en CO2. L’effet espace mort a un retentissement assez faible sur la PaO2 qui n’est abaissée qu’en raison de la redistribution du débit sanguin pulmonaire dans le reste du parenchyme où les rapports ventilation/perfusion sont alors abaissés si le débit cardiaque reste normal.
La diminution de la pression partielle en CO2 dans les alvéoles non perfusées et la libération locale d’agents humoraux est responsable d’un collapsus alvéolaire régional, si bien que, dans un second temps, une partie du poumon sera toujours peu perfusée mais encore moins ventilée diminuant les rapports ventilation/perfusion. Cet effet shunt est le principal responsable de l’hypoxie observée dans l’EP. L’augmentation de la ventilation alvéolaire qui en résulte est responsable de l’hypocapnie.
L’obstruction de la circulation fonctionnelle est également à l’origine de l’ouverture des shunts physiologiques entre circulation bronchique et circulation artérielle pulmonaire. L’issue de la circulation bronchique à haute pression dans le lit capillaire pulmonaire est responsable d’une hémorragie alvéolaire (et d’une zone de shunt à rapport ventilation/perfusion = 0) qui se manifeste par une hémoptysie. Ces infarctus sont essentiellement la conséquence des EP distales responsables d’une occlusion complète d’une petite branche artérielle pulmonaire.
L’hypoxémie peut également résulter d’un shunt intracardiaque sur un foramen ovale perméable ; l’augmentation de pression dans l’oreillette droite favorisant le passage direct du sang veineux dans l’oreillette gauche.
Enfin, dans les formes graves compliquées d’une baisse du débit cardiaque, la baisse de la saturation veineuse mêlée en oxygène (SvO2) peut également expliquer une partie de l’hypoxémie.
________________________________________________________________________________
Mécanismes de l’hypoxémie dans l’EP
- Inégalité des rapports ventilation/ perfusion avec zones d’effet shunt.
- Zones de shunt dans les territoires d’infarctus pulmonaire.
- Shunt intracardiaque par ouverture d’un foramen ovale (en cas d’hyperpression auriculaire droite).
- Baisse de la SvO2 en raison du bas débit cardiaque (dans les formes graves).
________________________________________________________________________________
Conséquences hémodynamiques
L’EP diminue la surface de section de l’arbre artériel pulmonaire qui augmente de façon exponentielle avec les divisions artérielles pulmonaires. La somme des surfaces de section des 19 artères segmentaires étant par exemple nettement supérieure à celle du tronc de l’artère pulmonaire. Ainsi, l’obstruction d’une ou deux artères segmentaires n’a habituellement aucune conséquence hémodynamique mesurable, alors qu’une obstruction plus proximale entraîne habituellement une augmentation de la post-charge ventriculaire droite. Les résistances pulmonaires n’augmentent pas ou peu pour des obstructions vasculaires de moins de 50 % ; en revanche, elles augmentent exponentiellement pour la moindre aggravation de l’obstruction au-delà de cette valeur (fig. 7.22)
________________________________________________________________________________
Figure 7.22. Relation hyperbolique entre résistances pulmonaires totales et obstruction vasculaire pulmonaire mesurée par le score de Miller au cours de l’embolie pulmonaire aiguë.
________________________________________________________________________________
La pression artérielle pulmonaire moyenne normale est de l’ordre de 12 mmHg, la masse musculaire du ventricule droit est ainsi beaucoup plus faible que celle du ventricule gauche et n’est pas en mesure de maintenir le débit cardiaque face à une augmentation brutale et massive de la post-charge. En présence d’une obstruction vasculaire pulmonaire > 50 %, le débit cardiaque est maintenu par une augmentation de la fréquence cardiaque et le maintien du volume d’éjection systolique ventriculaire droit par une augmentation du volume télédiastolique du ventricule droit. Ces adaptations ont plusieurs conséquences (fig. 7.23) :
________________________________________________________________________________
Figure 7.23. Mécanismes physiopathologiques à l’origine de l’insuffisance circulatoire aiguë au cours de l’embolie pulmonaire aiguë.
VD : ventricule droit ; VG : ventricule gauche ; VES : volume d’éjection systolique.
________________________________________________________________________________
La pression pulmonaire augmente, facilitant le flux sanguin pulmonaire malgré l’obstruction.
Le ventricule droit ne peut toutefois maintenir son volume d’éjection au-delà d’une certaine valeur de post-charge, d’où une diminution du débit ventriculaire droit à l’origine d’une baisse de la pré-charge ventriculaire gauche.
La dilatation des cavités droites, à l’origine d’un bombement septal paradoxal vers la gauche, réduit également la précharge ventriculaire gauche, par un phénomène appelé interdépendance ventriculaire.
La baisse de la précharge ventriculaire gauche est à l’origine d’une baisse du débit cardiaque.
La tachycardie et la dilatation ventriculaire droite, responsable d’une augmentation de la tension pariétale ventriculaire droite augmentent la consommation d’oxygène ventriculaire droite.
L’augmentation de tension pariétale ventriculaire droite réduit le débit coronaire droit.
L’augmentation de la consommation en oxygène du ventricule droit et la baisse du transport en oxygène (résultant de l’hypoxémie, de la baisse du débit cardiaque et du débit coronaire droit) sont à l’origine d’une ischémie ventriculaire droite.
L’ischémie ventriculaire droite entraîne une baisse de la contractilité réduisant encore le débit ventriculaire droit.
La baisse de pression systémique, élément terminal, vient encore aggraver ces phénomènes. Le décès survient par insuffisance circulatoire aiguë.
Physiopathologie du syndrome post-thrombotique
Le syndrome post-thrombotique associe à des degrés divers douleurs, œdème, développement de varices et de varicosités, amincissement cutané, survenue d’une dermite ocre, voire des ulcérations cutanées (ulcères veineux). La TVP peut laisser deux séquelles : une obstruction veineuse résiduelle par fibrinolyse incomplète du thrombus veineux, bien plus fréquente que dans la circulation pulmonaire, et une incontinence valvulaire à l’origine d’un reflux sanguin. Ces deux séquelles aboutissent à une augmentation de la pression veineuse et veinulaire qui entraîne une augmentation de la perméabilité capillaire d’où l’apparition d’un œdème. Une réaction inflammatoire apparaît suite aux altérations de l’endothélium, avec libération des médiateurs de l’inflammation. Des dépôts de fibrine se forment dans le tissu interstitiel autour des microvaisseaux, altérant les échanges d’oxygène avec les tissus. S’installent alors les troubles trophiques, dans un délai allant de quelques mois à plusieurs années.
Physiopathologie de l’hypertension pulmonaire thromboembolique chronique
L’hypertension pulmonaire thromboembolique chronique (HTP-TEC) est liée à la persistance et l’organisation fibreuse de caillots fibrino-cruoriques après une ou plusieurs EP. Deux mécanismes s’associent pour expliquer l’augmentation permanente des pressions et des résistances au sein du lit vasculaire pulmonaire : l’obstruction anatomique plus ou proximale des artères pulmonaires par du matériel fibrino-cruorique devenu fibreux et adhérent aux artères pulmonaires et le remodelage de la microcirculation pulmonaire à l’origine de l’épaississement de la paroi des artérioles pulmonaires musculaires.
Après une EP, l’évolution naturelle se fait vers la résorption des caillots sous l’action de la fibrinolyse physiologique. Toutefois, des séquelles perfusionnelles scintigraphiques sont présentes chez 30 à 50 % des patients 1 an après une EP. Chez certains patients la résorption des caillots ne se produit pas et l’évolution se fait vers une organisation fibreuse des caillots dans les artères pulmonaires. Les raisons en sont mal comprises et plusieurs hypothèses physiopathologiques ont été émises. Les thrombophilies constitutionnelles connues ne sont pas plus fréquentes chez les patients avec séquelles post-EP ou HTP-TEC. Une élévation du facteur VIII et la présence d’anticoagulant lupique ou d’anticorps anticardiolipine sont plus fréquemment retrouvées chez les malades avec une HTP-TEC mais ces anomalies sont également associées au risque de récidive thromboembolique. Ce défaut de résorption des caillots pourrait être lié à une résistance des polymères de fibrine à la fibrinolyse physiologique induite par la plasmine. Plus récemment, le concept d’angiogenèse déficiente a été proposé pour expliquer la persistance de caillots. Il repose sur le rôle potentiel de la néovascularisation, sous la dépendance de cellules progénitrices endothéliales et de facteurs pro-angiogéniques (VEGF ou bFGF), dans la résolution des thrombus veineux. Ainsi, ce défaut de résorption des caillots cause une obstruction définitive et irréversible du lit artériel pulmonaire produisant un obstacle à l’éjection du ventricule droit. De plus, un remodelage progressif de la microcirculation artérielle pulmonaire, se développe au sein des territoires non occlus dans lesquels est redistribuée la perfusion pulmonaire.
Enfin, l’implication de mécanismes inflammatoires dans la physiopathologie de l’HTP-TEC est soutenue par : (i) la présence d’infiltrats inflammatoires au sein des pièces d’endartérectomie pulmonaire, (ii) la prévalence élevée de pathologies inflammatoires et/ou infectieuses chroniques se compliquant d’HTP-TEC (dérivations ventriculo-atriales, pacemaker infecté, splénectomie…), et (iii) des taux circulants de cytokines pro-inflammatoires ou de chimiokines chez les patients avec une HTP-TEC.
Sémiologie
Sémiologie de la TVP
Les thromboses veineuses profondes des membres inférieurs se manifestent par des douleurs qui peuvent être isolées ou associées à un œdème du membre inférieur siège de la thrombose. Elles peuvent être peu symptomatiques, la douleur étant limitée à une sensation de crampe ; voire totalement asymptomatiques. L’inflammation peut être prépondérante, le membre est alors chaud et érythémateux. Attention, une thrombose iliaque peut provoquer des douleurs inguinales ou fessières parfois prises à tort pour des douleurs neurologiques (cruralgie ou sciatique), surtout quand il n’y a pas d’œdème associé. L’examen clinique peut être normal, ou constater un érythème, un œdème, une circulation veineuse collatérale superficielle. La palpation peut être douloureuse de même que la dorsiflexion du pied (ce signe peu sensible et peu spécifique est appelé signe de Homans). À ce tableau peut s’associer le développement d’une circulation veineuse superficielle bien visible par mise en charge d’une circulation vicariante. Ces symptômes sont le plus souvent unilatéraux et cette caractéristique doit faire évoquer prioritairement une TVP.
Les formes occlusives proximales peuvent être responsables d’un œdème massif, d’une augmentation de la pression sous les aponévroses et d’une ischémie de jambe par compression artérielle. Le membre est alors blanc froid et douloureux, on parle de « phlegmasia alba dolens » ; il s’agit d’une urgence thérapeutique. L’hyperpression et l’obstruction proximale peuvent également abolir le retour veineux ce qui donne au membre inférieur un aspect cyanique, on parle alors de « phlegmasia cerulea dolens », cet aspect peut conduire à une ischémie sévère, source de gangrène et d’amputation.
Au membre supérieur, les thromboses se manifestent également par un œdème, souvent associé à une circulation collatérale sous-cutanée. L’œdème peut également se propager aux creux sus-claviculaires, au cou et à la face en cas de thrombose sous-clavière ou de thrombose cave supérieure. Les thromboses veineuses des membres supérieurs peuvent également être totalement asymptomatiques.
Sémiologie de l’EP
Symptômes
La symptomatologie de l’EP est beaucoup plus diverse que celle de la TVP. Tout comme la TVP, l’EP peut être totalement asymptomatique. Les symptômes les plus fréquents, indiqués dans le tableau 7.5 ne sont ni sensibles ni spécifiques du diagnostic d’EP et sont de fréquents motifs de consultation, notamment aux urgences.
Tableau 7.5. Principaux symptômes au cours de l’EP.
| Symptôme | Fréquence |
| Douleur thoracique | 70 % |
| Dyspnée | 70 % |
| Toux | 20-30 % |
| Symptôme de TVP | 15-25 % |
| Malaise-syncope | 5-10 % |
| Hémoptysie | 2-5 % |
| Fièvre | 10-20 % |
La fréquence est donnée à titre indicatif, les chiffres varient de façon sensible d’une étude à l’autre.
Dyspnée
La dyspnée survient en principe brutalement (au moment de la migration du thrombus veineux dans l’artère pulmonaire) ; elle est en fait très souvent progressive et ne peut survenir qu’à l’effort. Elle peut également n’être que transitoire et disparaître après quelques heures ou jours ce qui explique parfois que les malades ne consultent qu’avec retard. Elle est expliquée par les douleurs ou par l’hypoxémie qui stimule les centres respiratoires. Sauf antécédent respiratoire, la dyspnée est silencieuse, sans râles. Quand elle n’est pas liée à une douleur thoracique, la dyspnée témoigne habituellement d’une obstruction vasculaire importante.
Douleurs thoraciques
Il s’agit principalement de douleurs pleurales donc latéro-thoraciques. Elles sont habituellement secondaires à un épanchement pleural ou à un infarctus pulmonaire. Attention, les douleurs pleurales peuvent être projetées à l’épaule ou à l’hypochondre ; elles peuvent également être reproduites à la percussion du thorax, ce signe ne doit donc pas conduire à un diagnostic de douleur pariétale sans avoir éliminé une EP. Comme la dyspnée, les douleurs peuvent être transitoires.
Toux
La toux est le plus souvent sèche, elle peut ramener une expectoration sanglante. Attention toutefois à l’EP survenant au cours d’une bronchopneumopathie chronique obstructive (BPCO) ; dans cette circonstance, la toux peut être liée à la BPCO et être productive.
Symptômes de TVP
Comme indiqué plus haut, les thromboses veineuses profondes (TVP) peuvent être asymptomatiques ; l’absence de signe au membre inférieur ne doit donc pas faire récuser le diagnostic d’EP. En revanche, la présence de signes évocateurs de TVP (ou de séquelles de TVP témoignant d’antécédents de MTEV) renforce considérablement la probabilité d’EP.
Malaises ou syncopes
Relativement rares, elles constituent parfois le seul symptôme de l’EP. La présence d’une dyspnée, d’une douleur pleurale ou d’une hypoxémie ou d’une circonstance favorisant les EP doit faire envisager ce diagnostic en premier lieu face à un malaise lipothymique ou une syncope. Ce symptôme est plus fréquent en présence d’une EP importante. Devant l’exploration d’une syncope nue, comme c’est le cas en cardiologie, l’EP doit faire partie des causes à évoquer.
Hémoptysie
Il s’agit également d’une manifestation rare au cours de l’EP ; elle est expliquée par la survenue d’un infarctus pulmonaire et est plus fréquente dans les embolies distales de petit calibre. Au cours de l’EP, l’hémoptysie est le plus souvent de faible abondance, elle ne contre-indique pas l’anticoagulation dans ce contexte.
Fièvre
Elle s’explique par l’inflammation liée à l’embolie ou la thrombose veineuse éventuellement associée. La température excède rarement 38,5 °C. Si elle s’accompagne d’une toux et de douleurs thoraciques, la distinction entre EP et pneumonie ne sera alors pas aisée.
Les signes d’examen clinique
Tachycardie
C’est le signe cardiovasculaire le plus fréquent ; elle est quasi constante au cours de l’EP, liée à la douleur ou à l’adaptation du ventricule droit à l’élévation de post-charge.
Tachypnée
Également très fréquente, elle est liée aux douleurs ou à l’hypoxémie.
Signes d’insuffisance cardiaque droite et d’hypertension pulmonaire
Sauf pathologie chronique sous-jacente, il n’y a pas d’œdèmes des membres inférieurs au décours immédiat d’une EP aiguë. La turgescence jugulaire et le reflux hépato-jugulaire ne sont observés que dans les embolies importantes qui obstruent plus de 50 % de la vascularisation pulmonaire. Il en va de même de l’éclat du 2e bruit au foyer pulmonaire qui témoigne de l’hypertension artérielle pulmonaire.
Anomalies auscultatoires pulmonaires
L’auscultation pulmonaire est souvent normale en l’absence de pathologie respiratoire associée à l’embolie. Cette dernière peut être à l’origine d’un épanchement pleural souvent de faible abondance qui est satellite de l’infarctus pulmonaire. L’infarctus se traduit cliniquement par un foyer de crépitants.
Signes de TVP
Ils peuvent totalement manquer. Il est possible de constater une augmentation douloureuse du volume d’un membre inférieur, qui augmente sensiblement la probabilité de l’EP.
Sémiologie de l’hypertension pulmonaire thromboembolique chronique
Dyspnée d’effort
Comme dans les autres formes d’hypertension pulmonaire, la dyspnée d’effort est le maître symptôme. Son manque évident de spécificité peut faire égarer le diagnostic. Contrairement à l’EP aiguë, la dyspnée d’effort est le plus souvent d’intensité progressivement croissante. Chez un patient ayant des antécédents thromboemboliques veineux, la dyspnée d’effort peut persister au décours de l’épisode d’EP ou bien apparaître après un intervalle libre variable (parfois plusieurs années), appelé « lune de miel ».
Hémoptysie
Il s’agit d’un symptôme classique mais rare, même si la fréquence exacte de survenue est mal connue au cours de l’HTP-TEC. Elle est due à l’hypertrophie, parfois très importante, des artères bronchiques et/ou diaphragmatiques ou plus rarement intercostales en réponse à l’obstruction chronique de la circulation artérielle pulmonaire. Elle peut être favorisée par le traitement anticoagulant. D’abondance variable, elle peut nécessiter le recours à l’artério-embolisation bronchique.
Syncope et les signes d’insuffisance cardiaque droite
Il s’agit de symptômes souvent tardifs traduisant la défaillance du ventricule droit.
Souffles thoraciques
L’auscultation pulmonaire est le plus souvent normale mais peut révéler la présence de souffles systoliques augmentant à l’inspiration et prédominant aux bases. Ils sont liés à l’écoulement turbulent du sang dans la circulation artérielle pulmonaire en cas d’obstruction proximale.
Démarche diagnostique et les examens complémentaires
Diagnostic positif
Principes généraux de la démarche diagnostique face à une suspicion de TVP et d’EP
Les démarches diagnostiques de la TVP et de l’EP reposent sur un principe commun. Dans les deux cas, le clinicien doit s’appuyer sur une démarche Bayesienne qui tient compte de la probabilité a priori pour déduire la probabilité a posteriori. En effet, la probabilité d’EP après le résultat d’un examen complémentaire dépend non seulement du résultat de l’examen mais également de la probabilité d’embolie avant l’examen. Par exemple, si le tableau clinique est typique avec plusieurs signes et symptômes évocateurs, qu’il existe un facteur de risque très fort (chirurgie par exemple) et que les autres hypothèses diagnostiques sont peu probables, la probabilité d’embolie est alors très forte et un examen complémentaire négatif, même très sensible ne diminuera cette probabilité que faiblement et ne permettra pas d’exclure le diagnostic. En d’autres termes, si la probabilité a priori est élevée (cliniquement, il est très probable que le patient ait une embolie), le risque de faux négatif d’un test négatif est élevé et on ne pourra conclure. Le même raisonnement peut être appliqué quand un examen complémentaire, même très spécifique, est positif alors que la probabilité a priori est faible.
La première étape de la démarche diagnostique consiste donc à apprécier la probabilité de TVP ou d’EP avant la réalisation du premier examen complémentaire. Cette probabilité, appelée probabilité clinique, repose sur l’existence de facteurs de risque de TVP ou d’EP, sur l’existence de signes évocateurs et sur la probabilité d’un diagnostic alternatif. Des scores sont disponibles pour ce calcul (tableaux 7.6 et 7.7)
Tableau 7.6. Score de probabilité clinique de TVP (score dit de Wells).
| Caractéristique clinique | Points |
| Antécédent de thrombose veineuse | + 1 |
| Cancer actif | + 1 |
| Paralysie, parésie ou immobilisation plâtrée récente d’un membre inférieur | + 1 |
| Alitement récent de plus de 3 jours ou chirurgie majeure < 4 semaines | + 1 |
| Douleur localisée sur un trajet veineux | + 1 |
| Œdème de tout un membre inférieur | + 1 |
| Œdème d’un mollet > 3 cm | + 1 |
| Œdème prenant le godet | + 1 |
| Circulation veineuse collatérale | + 1 |
| Diagnostic alternatif au moins aussi probable que celui de TVP | -2 |
| Probabilité de thrombose veineuse profonde en fonction du total des points | |
| Total ≥ 3 | 80 % |
| Total = 1 ou 2 | 30 % |
| Total ≤ 0 | 5 % |
Tableau 7.7. Scores de probabilité clinique de l’EP (score de Genève).
| Caractéristique clinique | Points |
| Âge > 65 ans | 1 |
| Antécédent de MTEV | 1 |
| Cancer actif < 1 an | 1 |
| Chirurgie ou fracture < 1 mois | 1 |
| Douleur unilatérale d’un membre inférieur | 1 |
| Hémoptysie | 1 |
| Fréquence cardiaque 75-94/min | 1 |
| Fréquence cardiaque ≥ 95/min | 2 |
| Œdème douloureux unilatéral | 1 |
| Probabilité d’EP en fonction du total des points | |
| 0-1 | 10 % |
| 2-5 | 25 % |
| > 5 | 70 % |
MTEV : maladie thromboembolique veineuse (TVP ou EP)
Il peut sembler surprenant de ne pas trouver la douleur thoracique dans les items du score. Il faut garder à l’esprit que le score est utilisé après que l’embolie a été évoquée ; à ce stade, la douleur thoracique n’est plus discriminante. Parmi les facteurs de risque, seuls les plus importants sont retenus dans ce type de score, raison pour laquelle, la pilule contraceptive, par exemple, n’est pas retenue car elle augmente le risque beaucoup plus faiblement que la chirurgie ou le cancer.
Ces scores ne permettent ni d’éliminer ni de confirmer le diagnostic, mais ils indiquent la probabilité d’avoir ou de ne pas avoir la TVP ou l’EP avant la réalisation des examens complémentaires. Les scores de Wells pour la TVP et de Genève pour l’EP ont été détaillés à titre d’exemple ; d’autres scores existent et possèdent les mêmes qualités, ils sont donc tous utilisables en pratique.
Particularités de la TVP
Une fois le diagnostic évoqué et la probabilité clinique calculée, le premier examen complémentaire va dépendre de cette probabilité clinique. Quand elle est faible ou intermédiaire, on peut réaliser soit un dosage des D-dimères soit une échographie veineuse (fig. 7.24).
________________________________________________________________________________
Figure 7.24. Algorithme diagnostique face à une suspicion clinique de thrombose veineuse.
________________________________________________________________________________
Les D-dimères proviennent de la lyse de la fibrine par la plasmine et témoignent d’une fibrinoformation. Leur présence n’est toutefois pas synonyme de thrombose mais d’une activation de la coagulation qui peut survenir dans de nombreuses circonstances : infection, inflammation, cancer, infarctus du myocarde, accident vasculaire cérébral, traumatisme, chirurgie, grossesse… Leur concentration sanguine peut même être élevée sans pathologie notamment chez les personnes âgées. Un résultat positif n’a donc aucune spécificité. En revanche, il s’agit d’un examen très sensible qui permet, quand il est négatif, d’éliminer le diagnostic de TVP, à condition que la probabilité clinique ne soit pas forte. Seuls les tests quantitatifs ont été suffisamment validés, le seuil est de 500 μg/L, en dessous de cette valeur le test est dit négatif, au-dessus, il est dit positif.
L’échographie veineuse confirme le diagnostic de thrombose en mettant en évidence une absence de compressibilité de la veine sous la sonde d’échographie. En effet, les veines sont souples et se compriment facilement sous la pression de la sonde d’échographie, contrairement aux artères, plus rigides. En présence d’un thrombus, la sonde ne parvient pas à collaber la veine. Il s’agit d’un examen très sensible ; quand il est négatif, il permet, comme les D-dimères, d’éliminer le diagnostic quand la probabilité clinique est faible ou intermédiaire. Quand l’échographie est positive, sa spécificité est suffisante pour confirmer le diagnostic quelle que soit la probabilité clinique.
Quand la probabilité clinique de thrombose est élevée, les D-dimères ne permettent pas d’éliminer le diagnostic et il faut recourir d’emblée à l’échographie veineuse.
Les autres examens complémentaires : phlébographie, scanner, imagerie par résonance magnétique (IRM) ne sont soit plus utilisés en raison de leur caractère douloureux (la phlébographie), soit insuffisamment étudiés (scanner et IRM). La figure 7.24 résume la démarche diagnostique face à une suspicion de TVP.
Particularités de l’EP
Le calcul de la probabilité clinique détermine le premier examen à effectuer.
Quand la probabilité clinique est faible ou intermédiaire, l’examen de première intention, est, comme pour la thrombose veineuse, le dosage des D-dimères. Un résultat négatif permet alors d’exclure le diagnostic avec une sécurité suffisante. Pour pallier son manque de spécificité, un ajustement du seuil de positivité à l’âge a été validé. Au-delà de 50 ans, le seuil n’est plus de 500 μg/L mais calculé en multipliant l’âge x 10. Pour un malade de 82 ans, le seuil n’est donc plus de 500 μg/L mais de 820 μg/L. Cet ajustement n’a pas été validé pour la TVP.
Quelle place pour la radiographie de thorax, les gaz du sang et l’électrocardiogramme ?
La radiographie de thorax est souvent normale au cours de l’EP. L’embolie peut se manifester par des signes radiologiques qui n’ont rien de spécifique : surélévation d’une coupole diaphragmatique (liée à la bronchoconstriction hypocapnique), épanchement pleural de faible abondance, atélectasies planes (qui apparaissent sous forme d’images linéaires dans les bases pulmonaires), foyers de condensation périphériques qui correspondent aux infarctus pulmonaires qui ne peuvent être distingués facilement d’images de pneumonie. Surtout, la radiographie de thorax peut participer au diagnostic différentiel en mettant en évidence une autre cause aux symptômes thoraciques qui ont fait évoquer l’EP : pneumothorax ou fracture de côte, pneumonie ou œdème aigu pulmonaire, notamment.
La gazométrie artérielle met le plus souvent en évidence une hypoxémie et une hypocapnie témoignant d’un effet shunt. Ces anomalies ne sont pas constantes, donc pas sensibles et n’ont aucune spécificité ; de nombreuses pathologies respiratoires donnent ce type d’anomalies gazométriques. La gazométrie artérielle a donc une place très réduite dans le diagnostic d’EP et ne doit pas être effectuée systématiquement.
L’anomalie électrocardiographique la plus fréquente est la tachycardie qui n’a évidemment aucune spécificité. La présence de signes de prépondérance ventriculaire droite : bloc de branche droit, onde S en D1, onde Q en D3, déviation axiale droite, ondes T inversées dans le précordium droit, sont peu sensibles, présentes uniquement dans les embolies les plus importantes et manquent de spécificité. Comme la radiographie de thorax, l’électrocardiogramme sert donc essentiellement à éliminer d’autres diagnostiques, syndrome coronaire aigu notamment.
Quand la probabilité clinique est forte ou que les D-dimères sont élevés, il faut recourir aux examens d’imagerie, en principe angioscanner spiralé des artères pulmonaires ou scintigraphie de ventilation-perfusion.
L’angioscanner spiralé produit des coupes millimétriques du thorax après injection de produit de contraste iodé. Les artères pulmonaires sont visualisées jusqu’aux branches sous-segmentaires. En cas d’EP, le scanner met en évidence des lacunes dans les artères rendues opaques par l’injection iodée (fig. 7.25). L’angioscanner est contre-indiqué par une insuffisance rénale sévère et en cas de réaction allergique sévère après injection de produit de contraste iodé. Il délivre également un rayonnement X. Quand l’opacité est satisfaisante, le scanner est suffisamment sensible pour éliminer le diagnostic quand il est négatif et le confirmer quand il est positif. Les deux seules exceptions à cette règle sont la conjonction d’une forte probabilité clinique et d’un scanner négatif qui nécessite un 2e examen négatif pour formellement éliminer le diagnostic et la conjonction d’une faible probabilité clinique avec un scanner positif dans un vaisseau sous-segmentaire, image qui n’a alors pas la spécificité suffisante pour affirmer le diagnostic.
________________________________________________________________________________
Figure 7.25. Angioscanner thoracique spiralé mettant en évidence une embolie pulmonaire proximale et distale (flèches). Noter que l’artère pulmonaire est mieux opacifiée que l’aorte. Examen de bonne qualité.
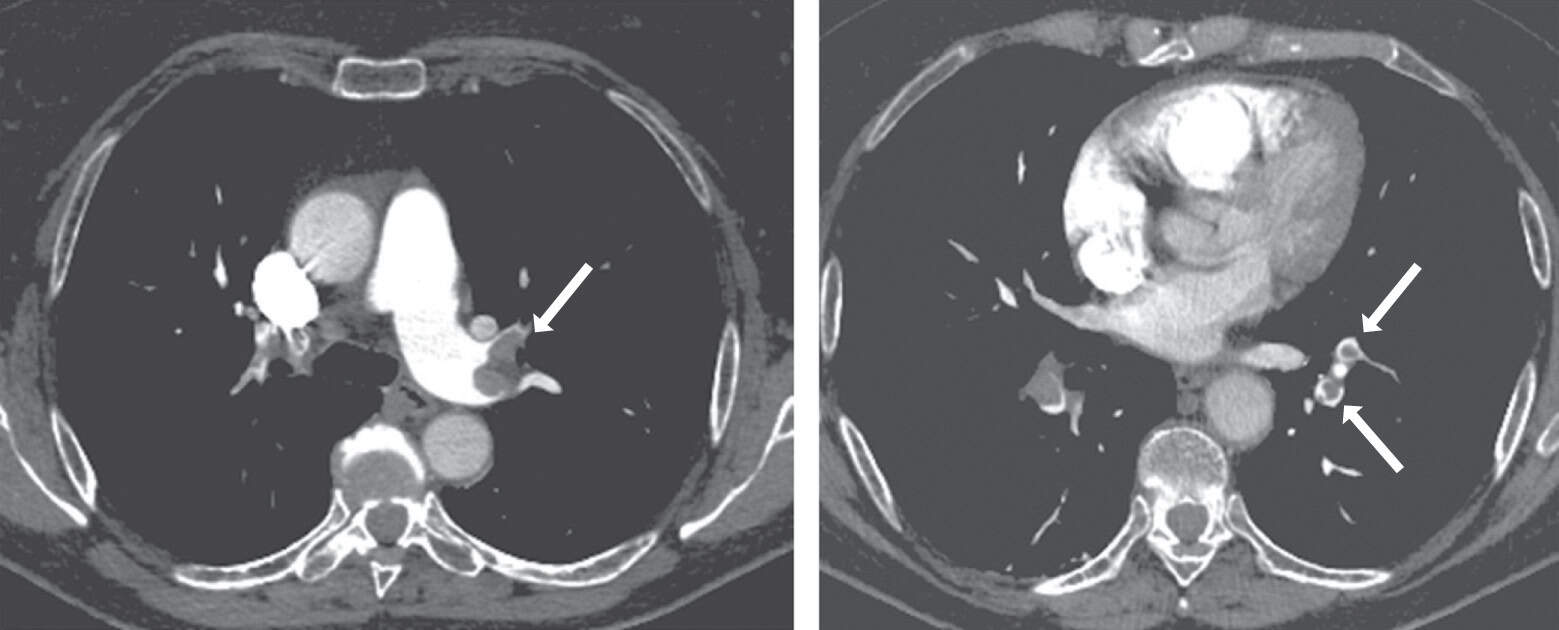
________________________________________________________________________________
La scintigraphie pulmonaire est le deuxième examen d’imagerie pouvant confirmer ou éliminer l’EP. Elle consiste en l’injection intraveineuse d’un radio-marqueur sur des micro-agrégats d’albumine humaine. Les micro-agrégats sont temporairement piégés dans la microcirculation pulmonaire et l’émission gamma du radio-traceur est captée par une gamma-caméra permettant de visualiser la répartition du flux artériel pulmonaire sous diverses incidences. Le même radio-marqueur est également administré par inhalation et les images de perfusion sont confrontées aux images de ventilation. En principe, une EP se manifeste par des zones bien ventilées (sans défaut de ventilation) mais mal perfusées. Ces zones suivent la segmentation artérielle pulmonaire et peuvent toucher l’ensemble d’un segment ou un sous-segment. La scintigraphie ne permet donc pas la visualisation directe du thrombus mais son retentissement sur la vascularisation pulmonaire. Les images ne sont pas parfaitement spécifiques, toutes les pathologies respiratoires qui provoquent une destruction (emphysème) ou une vasoconstriction (pneumonie, asthme) artérielle pulmonaire peuvent être à l’origine de zones moins bien perfusées que ventilées ; les antécédents d’EP diminuent également la spécificité des images ; en présence d’un antécédent il est indispensable de comparer la scintigraphie récente avec un examen de référence à la recherche de nouveaux territoires non perfusés. Enfin, certaines images ne permettent pas de conclure, notamment quand il existe une altération de la ventilation et de la perfusion dans le même territoire ou quand les défauts de perfusion sont trop limités. Une proportion importante, de l’ordre de 50 %, des examens n’est pas interprétable et ne permet ni de confirmer ni d’éliminer le diagnostic. En revanche quand la scintigraphie est normale (fig. 7.26), le diagnostic peut être éliminé avec une excellente sécurité. En pratique, il existe des critères validés pour l’interprétation, quand il existe plusieurs territoires segmentaires non perfusés mais bien ventilés (aspect scintigraphique de haute probabilité ; environ 15 % des cas) (fig. 7.27), le diagnostic est confirmé, sauf probabilité clinique faible ; quand la scintigraphie est normale (25 % des cas), le diagnostic peut être éliminé. Enfin, quand la scintigraphie est indéterminée (aspect ni normal ni de haute probabilité ; environ 60 % des cas), l’EP n’est ni exclue, ni confirmée et il faut réaliser d’autres examens. La proportion de scintigraphies indéterminées augmente avec l’âge, les anomalies radiologiques et les antécédents pulmonaires. La scintigraphie est donc plus utile chez les sujets jeunes sans anomalie radiologique ni antécédent respiratoire.
________________________________________________________________________________
Figure 7.26. Scintigraphie de perfusion sous huit incidences ; aspect normal.
________________________________________________________________________________
Figure 7.27. Scintigraphie de ventilation-perfusion.
Aspect de haute probabilité : plusieurs zones systématisées non perfusées (colonnes 2 et 4) contrastant avec une ventilation normale (colonnes 1 et 3).
________________________________________________________________________________
De nouvelles techniques d’acquisition de la scintigraphie, appelées SPECT (pour single photon emission computed tomography) permettent la réalisation de tomographies qui semblent diminuer la proportion d’examens indéterminés. Ce type d’imagerie fait encore l’objet de recherches.
L’échographie veineuse, en diagnostiquant une TVP proximale (poplitée, fémorale ou iliaque), peut également confirmer indirectement le diagnostic d’EP chez une personne qui a des signes évocateurs d’embolie. Dans ce cas, il est inutile de confirmer l’embolie par un examen thoracique (scanner ou scintigraphie). En revanche, l’échographie veineuse normale ne permet pas d’éliminer l’EP avec une sécurité suffisante, la totalité du thrombus ayant pu migrer dans l’artère pulmonaire. Devant une suspicion d’EP, la découverte d’une thrombose distale (sous-poplitée) n’a pas la spécificité suffisante pour confirmer le diagnostic d’embolie, il faut donc limiter l’échographie aux segments veineux proximaux. Enfin, la rentabilité de l’examen est très faible (5 % de positifs seulement) quand il n’y a pas de symptômes ou de signe de TVP.
Sauf diagnostics différentiels et/ou signe de gravité (insuffisance cardiaque droite aiguë, état de choc), l’échocardiographie n’a pas de place dans le diagnostic de l’EP. L’imagerie échocardiographique peut mettre en évidence deux anomalies : une dilatation des cavités droites et une thrombose des cavités droites. La dilatation des cavités droites n’est observée qu’en présence d’une hypertension pulmonaire et donc pour des obstructions vasculaires pulmonaires supérieures à 50 %, ce signe manque dans la grande majorité des cas. La découverte d’un thrombus dans les cavités cardiaques droites est exceptionnelle (moins de 5 % des cas). L’échographie cardiaque ne doit donc pas être réalisée pour diagnostiquer l’EP, sauf signe de gravité. L’algorithme diagnostique chez les malades stables est décrit dans la figure 7.28.
________________________________________________________________________________
Figure 7.28. Algorithme diagnostic pour les embolies pulmonaires hémodynamiquement stables.
EP : embolie pulmonaire ; PC : probabilité clinique.
*Une échographie veineuse proximale peut être faite avant ou à la place du scanner en cas de signes de thrombose veineuse associée.
**Quand le scanner est normal malgré une forte probabilité clinique, il est conseillé d’effectuer soit une échographie veineuse soit une scintigraphie pour éliminer avec certitude le diagnostic d’embolie pulmonaire.
________________________________________________________________________________
Un premier cas particulier, le diagnostic de la TVP ou de l’EP au cours de la grossesse
La grossesse est une période à risque de MTEV. Des symptômes évocateurs de TVP (œdèmes des membres inférieurs) ou d’EP (dyspnée) sont fréquemment décrits durant la grossesse. Les scores de probabilité clinique décrits plus hauts ne sont ni validés ni adaptés dans ce contexte, les D-dimères sont souvent élevés leur utilité est donc réduite, mais inférieurs au seuil, ils éliminent le diagnostic.
En pratique, il est possible d’estimer la probabilité clinique empiriquement ; un résultat négatif de D-dimère permet alors d’éliminer le diagnostic de TVP ou d’EP quand la probabilité clinique n’est pas forte, ce qui est souvent le cas dans cette circonstance. Quand les D-dimères sont élevés, il faut débuter les examens morphologiques par une échographie veineuse ; s’il s’agit d’une suspicion de TVP, une échographie négative élimine le diagnostic et une échographie positive le confirme. S’il s’agit d’une suspicion d’EP, une échographie veineuse positive en proximal confirme le diagnostic, en revanche, un examen négatif ne permet pas de l’écarter. Dans ce cas, force est de recourir à la scintigraphie ou au scanner. L’irradiation du fœtus est très inférieure aux doses maximales autorisées ; ni le scanner ni la scintigraphie ne sont contre-indiqués. L’irradiation mammaire est en revanche plus élevée avec le scanner, c’est une raison pour privilégier la scintigraphie.
Un second cas particulier, le diagnostic de l’EP grave en présence de signes de gravité
Les embolies pulmonaires graves se manifestent par un état de choc ou des signes d’insuffisance cardiaque droite aiguë (voir paragraphe sur le diagnostic de gravité). La présence d’un état de choc rend le transport de ces malades dangereux, il faut donc privilégier un diagnostic au lit du malade. Les D-dimères sont peu utiles, très souvent positifs dans ce contexte souvent marqué par une probabilité clinique forte qui rend leur emploi inutile. Le calcul de la probabilité clinique garde son intérêt suivi d’une radiographie de thorax qui permet d’éliminer d’autres causes de détresse respiratoire et de choc (SDRA notamment) et surtout d’une échocardiographie qui permet de confirmer la dilatation des cavités droites, constante dans le contexte d’une embolie grave et permet d’éliminer tamponnade, dissection aortique et défaillance cardiaque gauche, principaux diagnostics différentiels dans ce contexte. Si le doute persiste, il faudra transporter le malade au scanner après avoir stabilisé la situation hémodynamique quand c’est possible (fig. 7.29).
________________________________________________________________________________
Figure 7.29. Algorithme diagnostique des embolies pulmonaires graves responsables d’une instabilité hémodynamique.
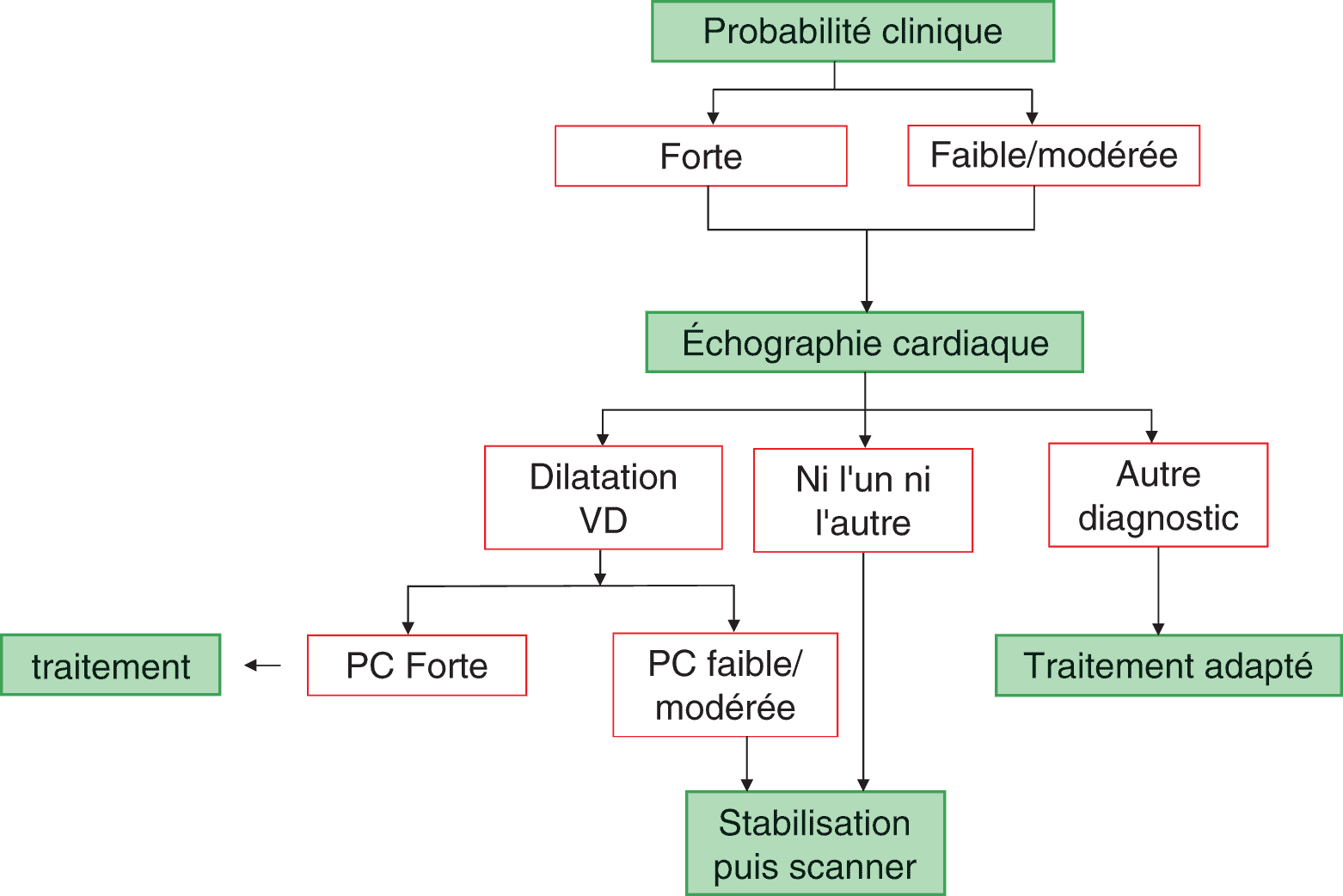
EP : embolie pulmonaire ; VD : ventricule droit ; PC : probabilité clinique
________________________________________________________________________________
Évaluation de la gravité
Une fois le diagnostic établi, il importe d’évaluer la gravité de l’EP pour définir le lieu de prise en charge et le traitement les plus appropriés.
La présence d’une hypotension artérielle persistante ou de signes de choc définit les embolies pulmonaires graves dont la mortalité précoce est constamment supérieure à 25 %. Ces formes graves ne représentent que moins de 5 % de toutes les EP.
En l’absence de choc, il est recommandé de calculer un score clinique, le pulmonary embolism severity index ou PESI (tableau 7.8) qui permet de définir les embolies pulmonaires de faible gravité. Sa forme simplifiée, plus facile à calculer, a les mêmes propriétés.
Tableau 7.8. Pulmonary Embolism severity Index (PESI) et sa forme simplifiée (sPESI).
| Pulmonary Embolism severity Index (PESI) | |
| Caractéristique | Points |
| Âge | 1 par an |
| Sexe masculin | 10 |
| Cancer | 30 |
| Insuffisance cardiaque chronique | 10 |
| Pathologie pulmonaire chronique | 10 |
| Pression artérielle systolique < 100 mmHg | 30 |
| Fréquence cardiaque > 110 b/min | 20 |
| Fréquence respiratoire > 20 c/min | 20 |
| SaO2 < 90 % | 20 |
| Température < 36 °C | 20 |
| Confusion | 60 |
| PESI simplifié | |
| Caractéristique | Points |
| Age > 80 ans | 1 |
| Cancer | 1 |
| Insuffisance respiratoire ou cardiaque | 1 |
| Pression artérielle systolique < 100 mmHg | 1 |
| Fréquence cardiaque > 110 b/min | 1 |
| SaO2 < 90 % | 1 |
Selon le PESI, les patients à faible risque ont un total de points ≤ 85 ; selon le PESI simplifié, les patients à faible risque ont un total à 0.
L’autre manière, plus pragmatique de sélectionner des malades à faible risque qui peuvent être traités de façon ambulatoire est d’utiliser les critères HESTIA.
________________________________________________________________________________
Critères HESTIA permettant un traitement ambulatoire de l’EP
- Stabilité hémodynamique
- Pas d’indication à la fibrinolyse ou à l’embolectomie
- Pas de saignement actif ni de risque élevé de saignement
- Pas de nécessité d’oxygénothérapie
- EP qui n’est pas survenue sous traitement
- Pas d’indication à des antalgiques par voie veineuse
- Pas d’autre raison médicale ou sociale d’être hospitalisé
- Clairance de la créatinine ≥ 30 ml/min
- Absence d’insuffisance hépatique sévère
- Absence de grossesse
- Absence d’antécédent de thrombopénie à l’héparine
________________________________________________________________________________
Quand l’EP ne répond ni aux critères de faible gravité ni aux critères d’embolie grave, elle est de gravité intermédiaire ; une évaluation de la taille des cavités droites (fig. 7.30) et la mesure des biomarqueurs cardiaques (troponine, BNP ou NT-proBNP) permettent alors de distinguer les embolies de gravité intermédiaire faible de celles de gravité intermédiaire forte.
________________________________________________________________________________
Figure 7.30. Angioscanner thoracique spiralé mettant en évidence une dilatation des cavités cardiaques droites.
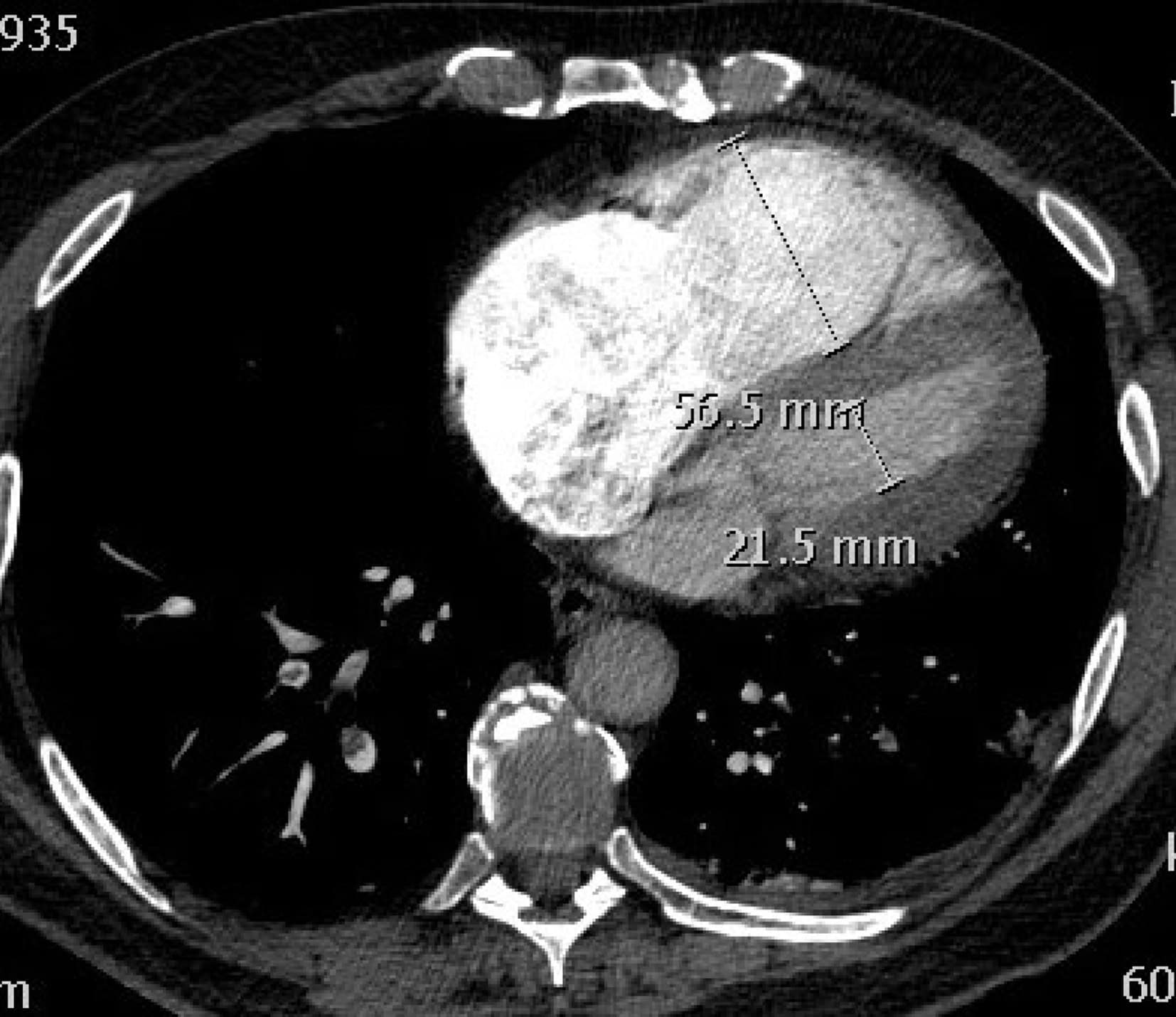
Noter que les cavités droites sont mieux opacifiées que les cavités gauches, ce qui constitue un élément de bonne qualité de l’angioscanner pour la recherche d’embolie pulmonaire.
________________________________________________________________________________
L’embolie de gravité intermédiaire forte est définie par une dilatation des cavités cardiaques droites sur l’échocardiographie ou le scanner et l’élévation d’au moins un biomarqueur cardiaque. L’embolie de gravité intermédiaire faible est définie par l’absence de dilatation des cavités droites ou la normalité des biomarqueurs cardiaques chez un malade qui n’est pas à faible risque selon le PESI ou le sPESI. La classification de l’EP selon sa gravité est résumée dans la figure 7.31.
________________________________________________________________________________
Figure 7.31. Classification de la gravité des embolies pulmonaires aiguës d’après la Société européenne de cardiologie.
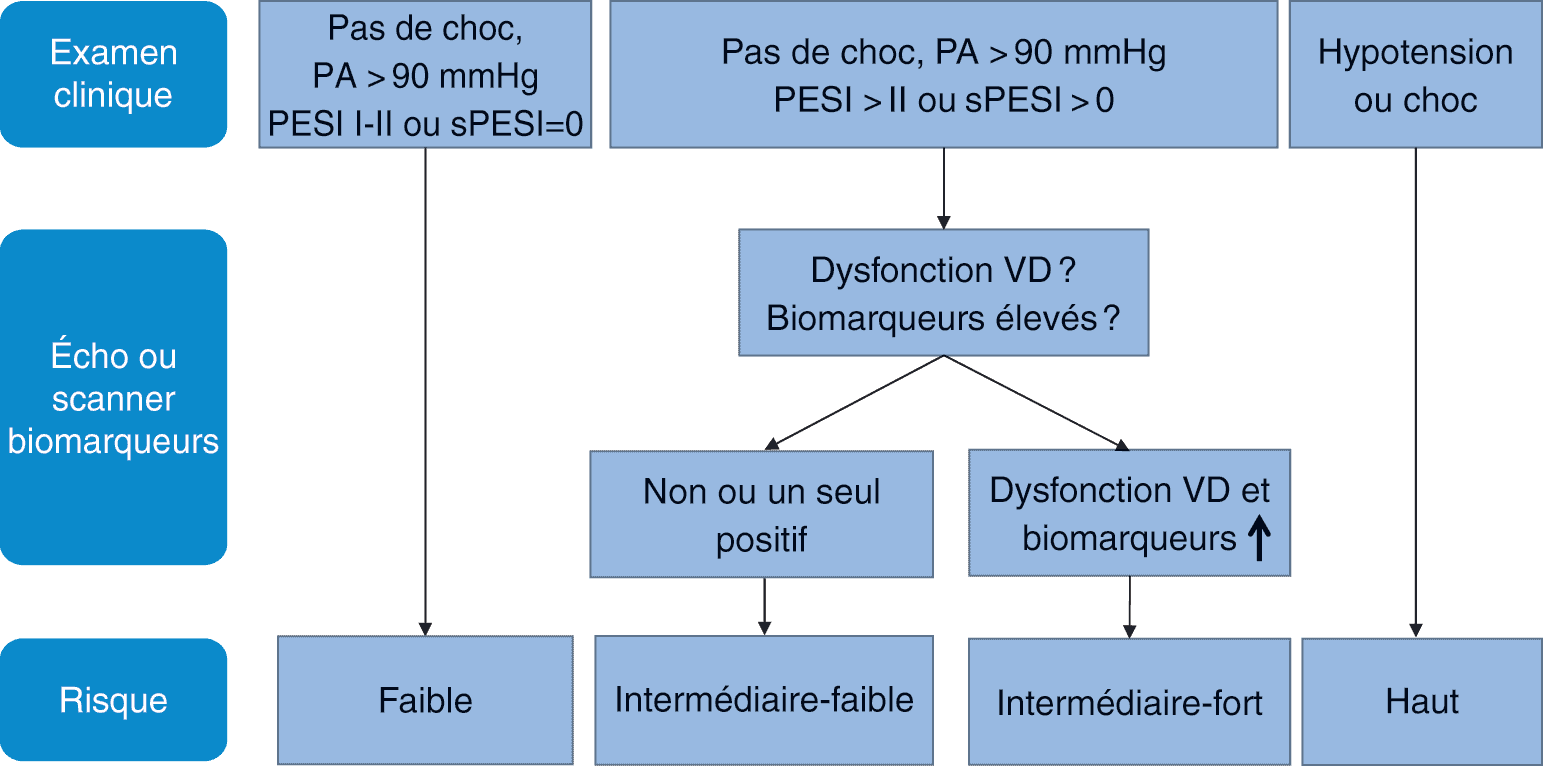
PA : pression artérielle systolique ; VD : ventricule droit ; PESI : Pulmonary Embolism Severity Index ; sPESI : simplified Pulmonary Embolism Severity Index. Les embolies pulmonaires à haut risque sont définies cliniquement par un état de choc ou une hypotension artérielle prolongée, les embolies à faible risque sont définies par le PESI ou le sPESI, les embolies à risque intermédiaire sont définies par une dilatation cardiaque droite et/ou des biomarqueurs cardiaques.
________________________________________________________________________________
Diagnostic étiologique
Deux questions dominent le diagnostic étiologique de la MTEV. Existe-t-il un cancer méconnu ou une anomalie constitutionnelle ou acquise de l’hémostase ?
Recherche de cancer
Une TVP ou une EP apparemment non provoquée peut être la première manifestation d’un cancer. Le plus souvent, des symptômes ou des signes cliniques évocateurs de cancer existent et le diagnostic est facile. Parfois, au contraire, ces symptômes sont plus frustes et il faut effectuer un interrogatoire et un examen clinique soigneux pour ne pas méconnaître un cancer encore peu symptomatique. Ce dernier peut également modifier les examens complémentaires effectués dans la démarche diagnostique ou lors du bilan initial de la TVP ou de l’EP. Le scanner fait pour diagnostiquer l’embolie peut mettre en évidence un cancer bronchique ou des métastases pulmonaires, voire une lésion hépatique ou du pôle supérieur d’un rein. La numération globulaire initiale effectuée avant de débuter le traitement anticoagulant peut mettre en évidence une anémie qui peut orienter vers une cause digestive ou gynécologique. La pratique d’examens complémentaires systématiques de type scanner thoraco-abdomino-pelvien, tomographie par émission de positron (TEP), endoscopies digestive et bronchique, n’apporte rien quand l’examen clinique a été minutieux.
Recherche d’une thrombophilie biologique
Les facteurs de risque biologiques décrits plus haut (tableau 7.4) augmentent sensiblement le risque de MTEV par rapport à la population générale ; en revanche, en dehors de quelques exceptions, comme le déficit en antithrombine et le syndrome des antiphospholipides, ils n’augmentent pas ou peu le risque de récidive après un premier évènement thromboembolique. En dehors de ces deux anomalies, ils ne constituent donc pas une raison majeure de prolonger le traitement anticoagulant. Les circonstances dans lesquelles il est suggéré de rechercher ces anomalies sont décrites ci-dessous.
________________________________________________________________________________
Indications de la recherche d’une thrombophilie biologique
- Chez les patients ayant un premier épisode de TVP proximale ou d’EP, non provoqué, avant l’âge de 50 ans et ayant une histoire de thrombose familiale au 1er degré.
- Chez les patients ayant une MTEV récidivante définie par au moins un épisode de TVP proximale ou d’EP et au moins un épisode non provoqué, avant 50 ans.
- Chez les patients ayant une TVP non provoquée dans des sites atypiques (splanchnique, membre supérieur, cérébrale).
________________________________________________________________________________
En dehors des anomalies génétiques (qui ne peuvent être recherchées qu’après accord écrit du patient) toute anomalie doit être confirmée par un 2e dosage. Le syndrome des antiphospholipides nécessite deux dosages espacés d’au moins 12 semaines.
________________________________________________________________________________
Influence des anticoagulants sur les tests de thrombophilie biologique
- Héparine non fractionnée et héparines de bas poids moléculaire : abaissement du taux d’antithrombine.
- Antagonistes de la vitamine K : baisse de la protéine S et de la protéine C (qui sont des molécules vitamine K dépendantes).
- Anticoagulants oraux directs : faux positifs et faux négatifs de la recherche d’anticoagulant circulant.
_______________________________________________
Définition du syndrome des antiphospholipides (SAPL)
Critères cliniques
Thromboses vasculaires
- Au moins un épisode clinique de thrombose artérielle, veineuse ou de petits vaisseaux quel que soit le tissu ou l’organe.
Complications obstétricales
- Au moins une mort fœtale inexpliquée survenue au-delà de la 10e semaine de gestation.
- Au moins une naissance prématurée avant la 34e semaine de gestation en raison d’une éclampsie, d’une prééclampsie sévère ou d’une insuffisance placentaire.
- Au moins trois fausses couches spontanées consécutives survenues avant la 10e semaine de gestation.
Critères biologiques
Anticoagulant circulant lupique
- Présent dans dex prélèvements à au moins 12 semaines d’intervalle.
Anticorps anticardiolipine
- Présence dans le sérum ou le plasma d’un anticorps d’isotype IgG et/ou IgM, à des taux moyens à élevés (> 40 unités ou > 99e percentile) dans 2 prélèvements à au moins 12 semaines d’intervalle.
Anticorps anti-β2GPI
- Présence d’un anti-β2GPI d’isotype IgG et/ou IgM, à des taux > 99e percentile, dans deux prélèvements à au moins 12 semaines d’intervalle.
- Le risque est d’autant plus élevé que les taux sont hauts et qu’ils sont combinés sous forme de double ou triple positivité des critères biologiques.
________________________________________________________________________________
Diagnostic de l’hypertension pulmonaire thromboembolique chronique
Le dépistage systématique de l’hypertension pulmonaire thromboembolique chronique (HTP-TEC) au décours d’une EP n’est pas recommandé. En revanche, une HTP-TEC doit être évoquée chez les patients ayant une dyspnée d’effort persistante au décours d’une EP, a fortiori en cas de présence de signes d’insuffisance cardiaque droite. Au décours d’une EP, la prise en charge diagnostique est réalisée après 3 mois de traitement anticoagulant curatif afin de laisser le temps aux thrombus frais d’être éliminés. Elle comprend plusieurs étapes.
Suspicion diagnostique : échocardiographie et scintigraphie pulmonaire
L’échocardiographie est l’examen de dépistage de l’hypertension pulmonaire de première intention. Plusieurs signes sont recherchés : une accélération de la vitesse du flux de régurgitation tricuspide permettant d’estimer la pression artérielle pulmonaire systolique, une dilatation du ventricule droit… (tableaux 7.9 et 7.10). La combinaison de ces signes permet d’estimer la probabilité échocardiographique d’hypertension pulmonaire (tableau 7.9)
Tableau 7.9. Probabilité échocardiographique de l’hypertension pulmonaire chez les patients symptomatiques suspects d’hypertension pulmonaire.
| Vitesse d’insuffisance
tricuspide (m/s) |
Autres signes échographiques d’HTP | Probabilité d’HTP
à l’échographie cardiaque |
| ≤ 2,8 ou non mesurable | Non | Bas |
| ≤ 2,8 ou non mesurable | Oui | Intermédiaire |
| 2,9-3,4 | Non | |
| 2,9-3,4 | Oui | Haut |
| > 3,4 | Non requis |
Tableau 7.10. Autres signes échocardiographiques recherchés.
| A. Ventricules | B. Artères pulmonaires | C. Veine cave et oreillette droite |
| Rapport du diamètre basal ventricule droit/ventricule gauche (VG) > 1,0 | Temps d’accélération du flux d’éjection pulmonaire < 105 m/s et/ou « notch » (encoche) mésosystolique | Diamètre de la veine cave inférieure > 21 mm avec diminution de son collapsus respiratoire (< 50 % lors du « sniff test » ou < 20 % en inspiration normale) |
| Inversion ou aplatissement de la courbure du septum interventriculaire (index d’excentricité du VG > 1,1 en systole et/ou en diastole) | Vitesse protodiastolique de régurgitation pulmonaire > 2,2 m/s | Surface de l’oreillette droite (télésystole) > 18 cm2 |
| Diamètre de l’artère pulmonaire > 25 mm |
La scintigraphie pulmonaire planaire de ventilation et de perfusion est l’examen de référence pour dépister l’HTP-TEC. Elle montre des défects perfusionnels systématisés habituellement bilatéraux sans anomalie ventilatoire associée (fig. 7.32). Cet aspect est très évocateur d’HTP-TEC mais peut également être retrouvé dans d’autres pathologies comme la maladie veino-occlusive pulmonaire ou la fibrose médiastinale ; avec une sensibilité > 96 %, une scintigraphie pulmonaire normale permet d’exclure le diagnostic d’HTP-TEC ce qui n’est pas le cas d’un angioscanner thoracique normal dont la sensibilité est insuffisante.
________________________________________________________________________________
Figure 7.32. Aspect scintigraphique d’hypertension pulmonaire thromboembolique chronique avec plusieurs défauts de perfusion (flèches) dans des zones normalement ventilées (même aspect que la scintigraphie de haute probabilité dans l’embolie pulmonaire aiguë).
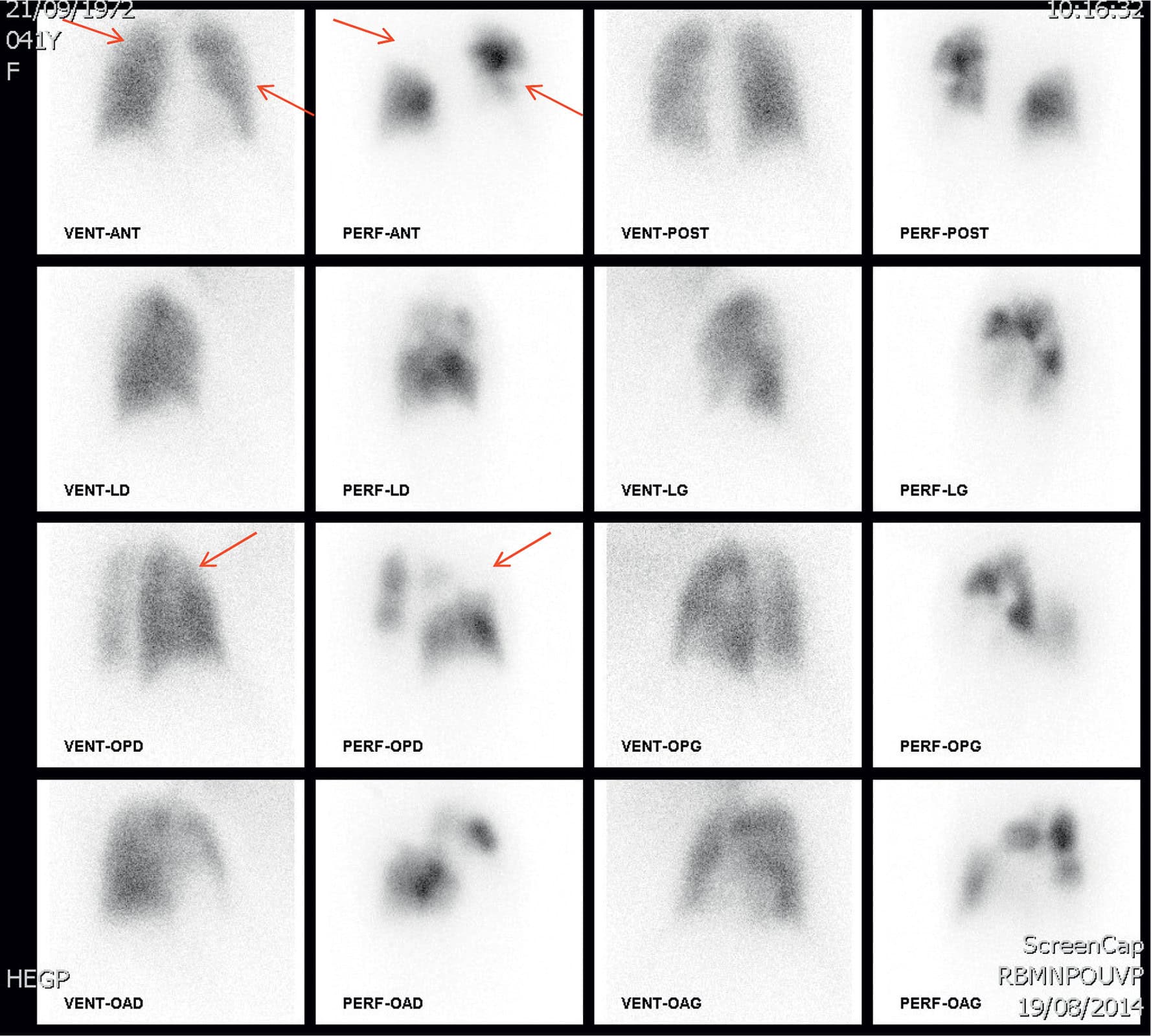
________________________________________________________________________________
Confirmation diagnostique : cathétérisme cardiaque droit et imagerie vasculaire pulmonaire
Une confirmation par cathétérisme cardiaque droit est indispensable chez les patients présentant une probabilité échocardiographique moyenne ou forte. Il retrouve une hypertension pulmonaire précapillaire définie par une pression artérielle pulmonaire (PAP) moyenne ≥ 25 mmHg et une PAP d’occlusion < 15 mmHg. La spécificité de la scintigraphie pulmonaire est excellente (> 90%) mais non suffisante pour affirmer la nature thromboembolique chronique de l’hypertension pulmonaire. C’est la raison pour laquelle il est indispensable de confirmer le diagnostic par la mise en évidence d’images thrombotiques chroniques sur l’angiographie pulmonaire et/ou l’angioscanner thoracique. L’angiographie pulmonaire demeure l’examen d’imagerie de référence pour le diagnostic d’HTP-TEC. Cet examen doit être réalisé dans un centre expérimenté afin d’assurer une qualité technique parfaite. Cinq signes angiographiques plus ou moins caractéristiques peuvent se rencontrer : (1) un arrêt cupuliforme (poutching defect) de progression du produit de contraste traduisant l’obstruction complète de l’artère pulmonaire, (2) des irrégularités et/ou une rectitude exagérée de la paroi artérielle pulmonaire, (3) des changements de calibre brutaux des artères pulmonaires, (4) des bandes transversales, correspondant à des sortes de cordages traversant et rétrécissant la lumière artérielle, et (5) le manque de branches artérielles pulmonaires segmentaires ou lobaires avec absence de parenchymographie en regard (fig. 7.33). L’angiographie détermine en fonction du siège proximal ou distal de ces lésions les possibilités d’endartérectomie pulmonaire. L’angioscanner thoracique complète l’angiographie pulmonaire et montre un épaississement de la paroi artérielle pulmonaire et une diminution du diamètre de la lumière artérielle par rapport à son diamètre externe (fig. 7.34). Ces images correspondent aux thrombus marginés qui diffèrent des thrombus observés dans l’EP aiguë en raison de leur raccordement pariétal secondaire à l’organisation du thrombus qui s’incorpore dans la paroi vasculaire. Ils peuvent générer des sténoses plus ou moins importantes et donner des aspects de stries linéaires (web) des artères pulmonaires. La perfusion mosaïque du parenchyme pulmonaire est caractérisée par la coexistence de zones de densité augmentée au sein desquelles la taille des vaisseaux pulmonaire est élevée, et de zones d’hypo-atténuation contenant des vaisseaux de calibre diminué (fig. 7.35). Bien que non spécifique, cet aspect est très suggestif d’HTP-TEC. L’hypervascularisation systémique (surtout bronchique mais également diaphragmatique, intercostale ou mammaire interne) est plus souvent observée (fig. 7.36).
________________________________________________________________________________
Figure 7.33. Angiographie pulmonaire de face montrant une obstruction proximale débutant dans le tronc de l’artère pulmonaire droite (flèches) et amputant le lobe supérieur droit (*).
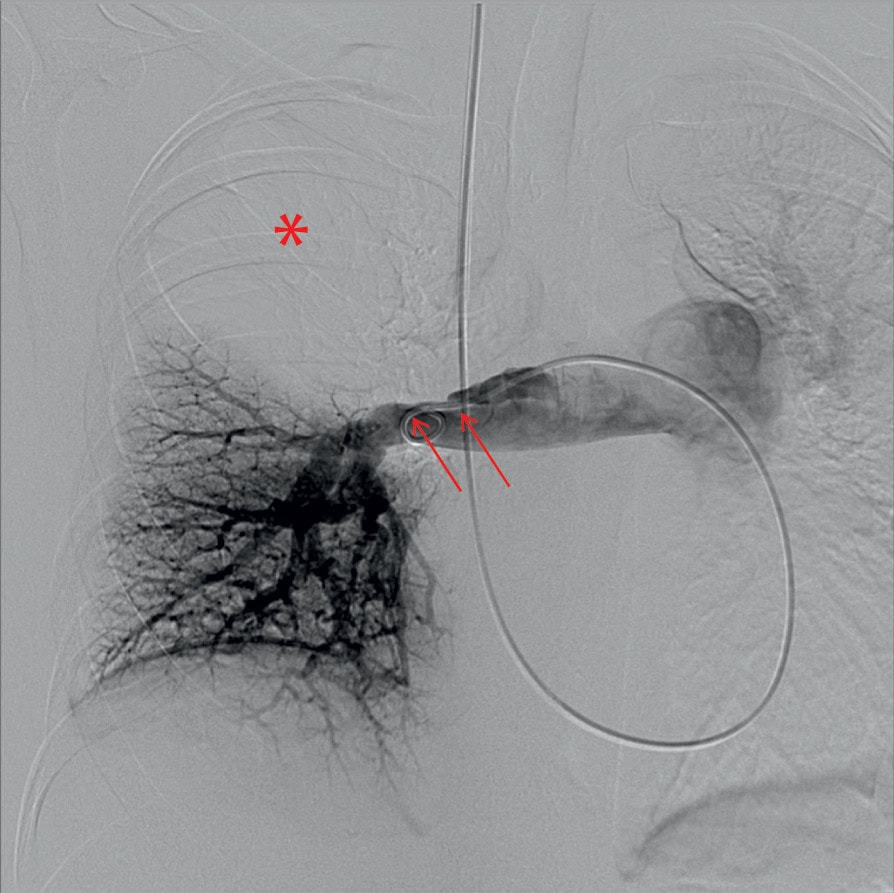
________________________________________________________________________________
Figure 7.34. Angioscanner thoracique spiralé en coupe sagittale et en fenêtre médiastinale montrant une réduction de calibre du tronc de l’artère pulmonaire droite opacifié (flèche orange) par du matériel hypodense adhérant à la paroi artérielle (flèche rouge).
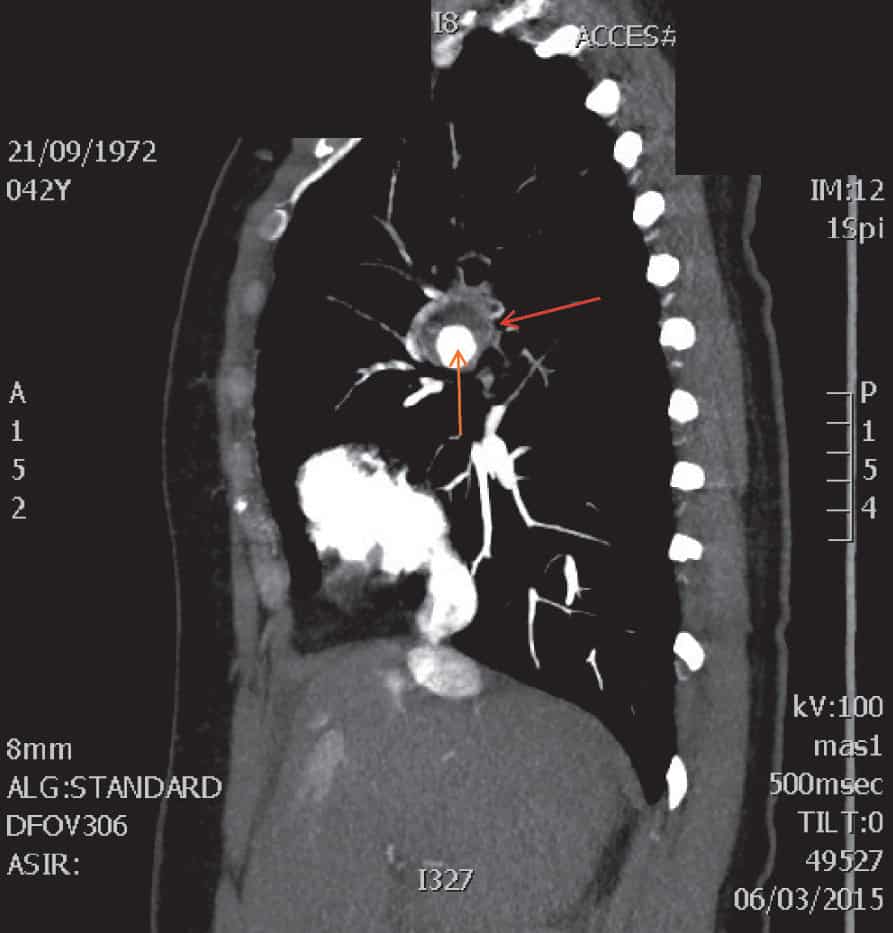
________________________________________________________________________________
Figure 7.35. Angioscanner thoracique en fenêtre parenchymateuse (reconstruction MIP) montrant une perfusion mosaïque avec des zones parenchymateuses hypodenses hypoperfusées (*) et des zones normodenses normoperfusées.
________________________________________________________________________________
Figure 7.36. Angioscanner thoracique en fenêtre médiastinale montrant une hypertrophie des artères bronchiques (flèches image de gauche) et diaphragmatiques (flèche image de droite).
________________________________________________________________________________
Présentations cliniques
Thromboses veineuses (localisations, caractéristiques)
La sémiologie de la TVP des membres inférieurs est décrite plus haut. Nous nous attarderons ici sur la présentation clinique des autres formes de thromboses veineuses : la thrombose veineuse superficielle, les thromboses iliaques et caves inférieures (habituellement regroupées avec les thromboses veineuses proximales des membres inférieurs), les thromboses des membres supérieurs et de la veine cave supérieure, les thromboses digestives et sus-hépatiques, et enfin, les thromboses veineuses cérébrales.
Thromboses veineuses superficielles
Les thromboses veineuses superficielles, longtemps appelées « paraphlébites », sont au moins aussi fréquentes que les thromboses veineuses profondes. Elles se manifestent par l’apparition d’un cordon veineux induré, parfois inflammatoire, sous cutané, à la face interne du mollet ou de la cuisse (grande veine saphène), ou à la face postérieure du mollet quand elle touche la veine petite saphène. Si le tableau clinique est très souvent typique, il est utile d’effectuer une échographie veineuse pour confirmer la thrombose objectivement, évaluer son extension (un thrombus de plus de 5 cm étant associé à un plus haut risque de TVP associée) et de vérifier s’il n’y a pas une TVP associée, ce qui est le cas dans 20 % des cas. Le risque de propagation dans le réseau profond et la migration artérielle pulmonaire ne sont pas exceptionnels, si bien que la mise en œuvre d’un traitement anticoagulant adapté (différent de celui de la TVP) est actuellement recommandée.
Thromboses iliaques
Comprises dans les thromboses veineuses proximales des membres inférieurs, les thromboses iliaques peuvent se manifester par des douleurs isolées de la cuisse ou de la fesse et sont parfois confondues avec une cruralgie ou une sciatique. Le risque de syndrome post-thrombotique est plus élevé dans cette localisation. À gauche, les thromboses iliaques peuvent être expliquées par un syndrome de Cockett : la veine iliaque se trouve comprimée par l’artère ce qui peut expliquer la localisation gauche préférentielle des thromboses veineuses au cours de la grossesse et leur caractère récidivant.
Thrombose de la veine cave inférieure
Les thromboses caves inférieures peuvent être à l’origine de douleurs abdominales, ou quand elles sont occlusives, d’un véritable syndrome cave inférieur qui se manifeste par des œdèmes bilatéraux parfois importants qui peuvent même être responsables d’une hypovolémie relative.
Thromboses des membres supérieurs
Beaucoup moins fréquentes que les thromboses des membres inférieures, les thromboses des membres supérieurs peuvent survenir spontanément, parfois un syndrome du défilé throraco-brachial quand la veine sous-clavière se trouve comprimée par certaines positions du bras. La thrombose survient alors le plus volontiers après un effort physique ayant impliqué le membre supérieur. La deuxième circonstance favorisante, maintenant la plus fréquente, est la présence d’un dispositif veineux de longue durée, soit cathéter veineux central, soit cathéter à chambre implantable, soit cathéter central introduit par voie périphérique (dit « PICC line ») ou encore un pace-maker. Des compressions médiastinales, notamment d’origine tumorale, peuvent également être impliquées dans la genèse de ces thromboses.
Les symptômes cliniques associent un œdème parfois mais non constamment douloureux ainsi qu’une circulation veineuse collatérale superficielle. Selon la localisation, l’œdème peut toucher le creux sus-claviculaire, le bras et l’avant-bras, ou l’épaule. Le diagnostic fait appel à l’échographie associée au doppler.
Thromboses de la veine cave supérieure
Également favorisées par la présence de cathéters et par les pathologies tumorales, notamment quand existe une compression médiastinale, les thromboses caves supérieures se manifestent habituellement par un syndrome cave supérieur qui associe à des degrés divers : céphalées, aspect cyanique du visage, télangiectasies, œdème du visage, œdème en pèlerine avec tuméfaction des creux sus-claviculaires et œdèmes des membres supérieurs.
Thromboses des veines utéro-ovariennes
Elles peuvent survenir après chirurgie carcinologique gynécologique ou en post-partum, elles sont le plus souvent asymptomatiques. En post-partum elles doivent être suspectées devant une douleur et une fièvre inexpliquée.
Thromboses splanchniques
Les thromboses splanchniques comprennent les thromboses des veines mésentériques, les thromboses de la veine porte et les thromboses des veines sus-hépatiques.
Les thromboses mésentériques peuvent se révéler par une ischémie intestinale dont elles sont la cause dans 5 à 10 % des cas, elles peuvent également entraîner une symptomatologie frustre faite de douleurs abdominales ou même être totalement asymptomatiques, comme toutes les autres thromboses veineuses. Le diagnostic sera fait par une échographie ou un scanner abdominal injecté.
Les thromboses du système porte extra-hépatique se manifestent le plus souvent par des douleurs abdominales accompagnées de fièvre ; l’extension de la thrombose aux veines mésentériques peut être à l’origine d’une ischémie intestinale. Les conséquences hépatiques sont modérées et en l’absence d’hépatopathie sous-jacente, le bilan hépatique est peu perturbé. La symptomatologie peut également être fruste et la thrombose est découverte tardivement au stade de cavernome portal qui traduit le développement d’une circulation collatérale autour du tronc porte thrombosé. À ce stade, il existe un syndrome d’hypertension portale avec une splénomégalie et des hémorragies digestives par rupture de varice œsophagienne.
En dehors de la cirrhose hépatique et des tumeurs malignes du foie et du pancréas, les causes locales sont infectieuses : appendicite, cholécystite ou sigmoïdite. En l’absence de cause locale, une thrombophilie biologique est fréquemment présente ; les thromboses portales peuvent également révéler un syndrome myéloprolifératif ; la recherche d’une mutation spécifique de type JAK-2 est recommandée en l’absence d’anomalie sur l’hémogramme.
La thrombose des veines sus-hépatiques réalise un syndrome de Budd-Chiari. Les manifestations cliniques peuvent être brutales et bruyantes ou se développer sur plusieurs semaines. Dans les formes aiguës, il existe des douleurs abdominales, de la fièvre, une ascite, une hépatomégalie douloureuse et une splénomégalie. En revanche, l’ictère et l’encéphalopathie sont plus rares et signent une forme évoluée.
Le diagnostic est habituellement fait par scanner ou imagerie par résonance magnétique.
Thromboses veineuses cérébrales
Les thromboses veineuses cérébrales sont rares, elles représentent environ 0,5 % des causes d’accident vasculaire cérébral. Elles peuvent toucher toutes les veines et sinus du système veineux cérébral. La symptomatologie varie avec la localisation de la thrombose, son extension et sa rapidité d’installation. Les céphalées sont très fréquentes, de même que les déficits focaux, dont la nature varie avec la localisation de la thrombose, et les crises comitiales ; les troubles de conscience sont plus rares. Le scanner cérébral élimine les autres causes mais c’est l’imagerie par résonance magnétique qui confirme habituellement le diagnostic.
Embolie pulmonaire
L’EP peut revêtir des aspects allant des formes asymptomatiques aux embolies pulmonaires graves responsables d’un état de choc. Nous décrirons ici trois formes : les embolies périphériques accompagnées d’infarctus pulmonaire, les embolies centrales responsables d’un tableau hémodynamique et les formes asymptomatiques.
Embolies asymptomatiques
Les embolies pulmonaires peuvent être totalement asymptomatiques, elles sont alors diagnostiquées sur un angioscanner thoracique réalisé pour d’autres raisons. Elles peuvent également se traduire par des symptômes qui ont été attribués à d’autres causes, notamment chez les patients atteints de cancer qui ont d’autres raisons d’être fatigués ou dyspnéiques et qui peuvent se plaindre de douleurs qui ont une autre origine. Les symptômes de l’embolie sont ainsi attribués à la pathologie tumorale et le scanner thoracique peut alors être réalisé pour évaluer la pathologie tumorale. Le risque de récidive de ces embolies découvertes fortuitement ne semble pas différent de celui des EP découvertes sur symptômes.
Embolies distales
Les embolies pulmonaires périphériques sont souvent très symptomatiques, responsables d’infarctus pulmonaire qui engendre des douleurs pleurales parfois très intenses, des hémoptysies de faible abondance et souvent de la fièvre. L’examen clinique retrouve un foyer de crépitants, si bien que cette présentation clinique peut être considérée à tort comme une pneumonie. Sur la radiographie de thorax, il existe souvent un épanchement pleural réactionnel au contact du foyer de condensation alvéolaire (fig. 7.37). L’hémoptysie, en règle absente dans la pneumonie, doit faire évoquer l’embolie.
________________________________________________________________________________
Figure 7.37. Embolie pulmonaire sous-segmentaire (flèche) antérobasale droite avec infarctus et réaction pleurale visibles sur la radiographie de thorax.
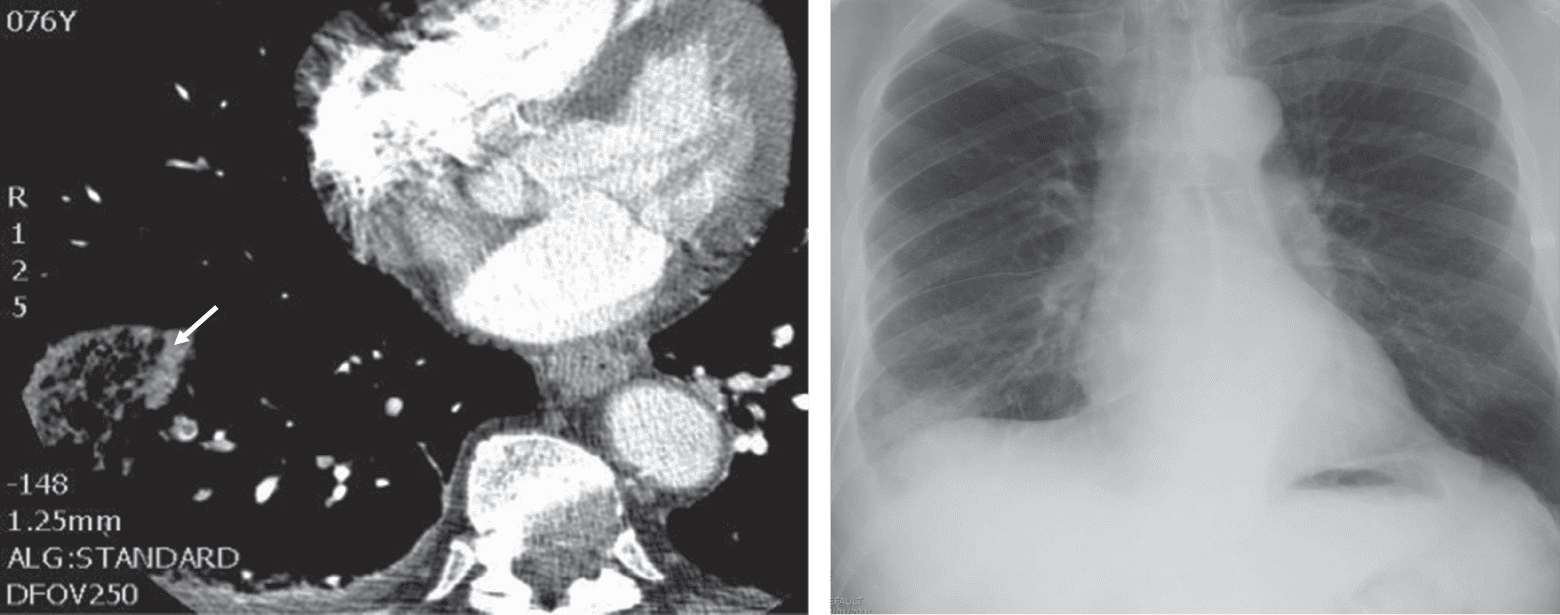
________________________________________________________________________________
Le diagnostic scanographique n’est pas simple, l’analyse des vaisseaux segmentaires et sous-segmentaires demande une qualité d’injection optimale et une grande expertise radiologique.
Embolies proximales
Les embolies tronculaires ont des conséquences hémodynamiques significatives ; elles se traduisent par une dyspnée, des malaises et des syncopes, voire un état de choc. Dans ces formes proximales, les douleurs et l’hémoptysie sont habituellement absentes. Il peut en revanche exister des signes d’insuffisance cardiaque droite aiguë.
Hypertension pulmonaire
Deux tableaux sont classiquement décrits. Le premier survient chez des patients ayant des antécédents thromboemboliques connus. Après un intervalle libre variable (parfois plusieurs années), appelé « lune de miel », ces patients décrivent l’aggravation progressive d’une dyspnée associée ou non à des signes d’insuffisance cardiaque droite (œdèmes des membres inférieurs, turgescence jugulaire…) et parfois des syncopes. Toutefois, cette « lune de miel » n’est pas constante et une EP aiguë peut mimer la première présentation d’une HTP-TEC. Dans ce cas, une importante élévation de la PAPs (> 60 mmHg) lors du diagnostic d’EP doit attirer l’attention et inciter à chercher des thrombus chroniques sur le scanner et à recontrôler l’échocardiographie après 3 mois de traitement anticoagulant curatif. Le diagnostic d’HTP-TEC peut également être fait à l’occasion du bilan étiologique d’une hypertension pulmonaire chez un patient avec ou sans antécédent thromboembolique veineux qui présente une dyspnée, une insuffisance cardiaque droite et parfois une hémoptysie.
Base physiopathologique et pharmacologique des traitements
Le traitement des thromboses veineuses profondes et de l’EP repose avant tout sur la prévention des récidives par les anticoagulants. Même si les antiagrégants réduisent le risque de thrombose post-opératoire ; ils ne préviennent pas les récidives à la phase aiguë d’une TVP ou d’une EP. Après la phase aiguë, les antiagrégants peuvent diminuer le risque de récidive, mais leur efficacité est moindre que celle des anticoagulants. Cette moindre efficacité des antiagrégants s’explique par la place prépondérante de la fibrinoformation dans la thrombose veineuse, alors que l’agrégation plaquettaire, au premier plan dans la thrombose artérielle, ne joue qu’un rôle secondaire dans la thrombose veineuse.
La majorité des récidives thromboemboliques surviennent dans les premiers jours après le diagnostic, le risque de récidive diminuant nettement après le premier mois. Les premières heures constituent la période dont le risque de récidive est le plus élevé. Le traitement anticoagulant doit donc être institué dès que possible et quand la probabilité clinique est forte ou intermédiaire, dès la suspicion de thrombose ou d’EP, quitte à l’arrêter si le diagnostic n’est pas confirmé.
Les méthodes de désobstruction veineuse pharmacologiques ou mécaniques ont pour but de prévenir le syndrome post-thrombotique en maintenant la veine ouverte. Les méthodes de désobstruction artérielle pulmonaire pharmacologiques ou mécaniques, ont pour but de diminuer rapidement la post-charge ventriculaire droite.
Enfin, l’interruption de la veine cave inférieure ne constitue qu’une méthode de remplacement quand les anticoagulants sont contre-indiqués.
Anticoagulants
Les schémas usuels pour le traitement initial des thromboses veineuses profondes et des embolies pulmonaires
Les propriétés pharmacologiques des divers anticoagulants ont fait l’objet d’un chapitre spécifique de cet ouvrage, nous nous limiterons ici aux spécificités du traitement des thromboses veineuses et des embolies pulmonaires.
Les anticoagulants, quelle que soit leur nature, ont un effet fibrinolytique négligeable, la désobstruction vasculaire est essentiellement liée à la fibrinolyse naturelle du malade. L’objectif de l’anticoagulation est alors de prévenir les récidives durant ce processus de fibrinolyse. Le risque de récidive étant maximal pendant les premiers jours et les premières heures, il importe que le traitement anticoagulant agisse sans délai. C’est la raison pour laquelle le traitement est débuté, en l’absence de contre-indication dès la suspicion clinique quand celle-ci est intermédiaire ou forte et qu’il n’est pas possible de débuter par un antagoniste de la vitamine K sans traitement héparinique associé.
Héparines et fondaparinux
Héparine non fractionnée (HNF), héparines de bas poids moléculaire (HBPM) et fondaparinux peuvent être employés à la phase aiguë de la TVP et de l’EP. L’héparine non fractionnée peut être administrée par voie veineuse en perfusion continue ou par voie sous-cutanée ; sa posologie initiale est de l’ordre de 500 UI/kg/jour ensuite adaptée pour obtenir un temps de céphaline activée (TCA) entre 2 et 3 fois le temps du témoin pour les réactifs employés en France, ou mieux, sur l’héparinémie mesurée par l’activité anti-Xa qui doit se situer au pic d’action (soit 4 heures après le début de la perfusion et 4 ou 6 heures après l’injection sous-cutanée) entre 0,3 et 0,7 unité. En pratique, l’HNF est difficile à manier et seuls 30 % des malades se situent dans les valeurs cibles durant les 24 premières heures de traitement.
Les HBPM et le fondaparinux sont donnés à posologie fixe, adaptée au poids, de l’ordre de 200 UI/kg pour les HBPM en une ou deux injections sous-cutanées par jour et, pour le fondaparinux, à la dose de 5 mg, 7,5 mg et 10 mg pour les patients pesant respectivement < 50 kg, entre 50 et 100 kg et plus de 100 kg. Les dernières méta-analyses suggèrent que les HBPM sont plus efficaces et mieux tolérées que l’HNF à la phase aiguë de l’EP et de la TVP proximale.
Les indications restantes pour l’HNF sont représentées par (1) l’insuffisance rénale sévère définie par une clairance de la créatinine < 30 ml/min, qui est une contre-indication à l’emploi des HBPM et du fondaparinux ; (2) les embolies pulmonaires graves pour lesquelles une fibrinolyse est envisagée ; et (3) les malades à haut risque hémorragique, non parce que l’HNF est à moindre risque hémorragique mais en raison de sa courte demi-vie et de l’existence d’un antidote, le sulfate de protamine, moins efficace pour les HBPM.
Les antagonistes de la vitamine K peuvent être débutés dès le premier jour de traitement par héparine, ce qui limite la durée de ce dernier, diminuant ainsi le risque de survenue d’une thrombopénie à l’héparine.
Les anticoagulants oraux directs (AOD) ont tous été validés dans le traitement des thromboses veineuses profondes et des embolies pulmonaires, avec des schémas thérapeutiques variables et qui diffèrent de ceux employés dans la fibrillation atriale.
Le dabigatran et l’edoxaban ne peuvent être débutés qu’après au moins cinq jours de traitement par HBPM ou HNF. Ils sont alors utilisés à posologie fixe : 150 mg deux fois par jour pour le dabigatran (la dose réduite n’a pas été testée dans la MTEV) et 60 mg une fois par jour pour l’edoxaban avec une dose réduite à 30 mg pour les malades dont le poids est inférieur à 60 kg ou dont la clairance à la créatinine est comprise entre 30 et 50 ml/min et en cas d’utilisation concomitante d’un inhibiteur puissant de la P glycoproteine P.
L’apixaban et le rivaroxaban peuvent être administrés d’emblée, mais peuvent être également utilisés si une HBPM ou du fondaparinux ont été utilisés initialement. L’apixaban est donné à la posologie de 10 mg deux fois par jour pendant 7 jours, suivis de 5 mg deux fois par jour. Le rivaroxaban est administré à la dose de 15 mg deux fois par jour pendant 3 semaines, suivis par 20 mg par jour en une prise.
Dans tous les cas, il n’y a pas de chevauchement entre HBPM et AOD, la première dose d’AOD est administrée à l’heure à laquelle l’injection suivante aurait été faite.
Exceptions à cette règle générale
Les thromboses veineuses superficielles relèvent d’un schéma thérapeutique particulier. Elles sont traitées par le fondaparinux à la dose de 2,5 mg par jour par voie sous-cutanée pendant six semaines.
Il n’est pas certain que le traitement anticoagulant soit indispensable pour les thromboses veineuses distales ; les diverses études n’ayant pas réussi à démontrer formellement la supériorité du traitement. Notons que ces thromboses profondes distales ne sont pas diagnostiquées (et donc pas traitées) dans de nombreux pays. Malgré cette incertitude, les recommandations suggèrent de les traiter avec la même posologie que les thromboses proximales mais pendant seulement 6 semaines.
La MTEV survenant en cours de grossesse doit être prise en charge par une HBPM, les AVK et les AOD étant contre-indiqués dans ce contexte.
La MTEV survenant au cours d’un cancer ne doit pas être traitée par les AVK qui sont associés à un risque de récidive particulièrement élevé dans ce contexte. Le traitement initial a donc recours aux HBPM, dalteparine ou tinzaparine, administrées aux posologies suivantes : 200 UI/kg en une seule injection quotidienne pendant un mois suivi par 150 UI/kg pour la dalteparine et 175 UI/kg en une seule injection quotidienne pour la tinzaparine sans modification de posologie. Les AOD sont actuellement évalués dans cette indication avec des premiers résultats qui semblent indiquer une efficacité supérieure à celle des HBPM mais un risque hémorragique plus élevé.
Durée du traitement
La durée du traitement est adaptée au risque de récidive après le traitement initial qui dépend de la présence et de la nature de la circonstance déclenchante de l’épisode initial.
Le risque de récidive à l’arrêt du traitement est schématiquement le suivant :
- il est inférieur à 5 % par an quand la MTEV a été provoquée par un facteur de risque transitoire majeur ;
- il est de l’ordre de 5 à 10 % par an après un premier épisode de MTEV non provoqué ou provoqué par un facteur de risque mineur transitoire. Il atteint environ 30 % à 10 ans et près de 50 % à 20 ans, surtout en cas de MTEV idiopathique ;
- après un épisode non provoqué, les hommes ont un risque deux fois supérieur à celui des femmes ;
- après un épisode non provoqué, le déficit en antithrombine et le syndrome des antiphospholipides augmentent sensiblement le risque de récidive alors que les autres thrombophilies biologiques ne semblent pas augmenter ce risque de façon importante ;
- les épisodes non provoqués récidivants sont associés à une augmentation sensible du risque de 2e récidive ;
- en présence d’un cancer actif, le risque de récidive reste de l’ordre de 20 % par an même après six mois de traitement anticoagulant ;
- enfin, si les EP ne récidivent pas plus que les TVP, elles récidivent plus souvent sous forme d’une nouvelle EP alors que les TVP récidivent plus souvent sous forme d’une nouvelle TVP.
________________________________________________________________________________
Durée du traitement des TVP et des EP
- Facteur de risque transitoire majeur (chirurgie, alitement de plus de 72 heures, immobilisation d’un membre inférieur, polytraumatisme impliquant les membres inférieurs) : 3 mois.
- Facteur de risque transitoire mineur (contraception œstro-progestative, voyage prolongé) ou absence de facteur de risque identifiable : évaluation du rapport risque bénéfice à 3 mois.
- Facteur de risque majeur prolongé (essentiellement cancer) : poursuivre le traitement tant que le facteur de risque persiste.
- Deuxième épisode non provoqué par un facteur de risque majeur : traitement de durée indéfinie.
- Déficit en antithrombine ou syndrome des antiphospholipides : traitement de durée indéfinie.
________________________________________________________________________________
La conduite à tenir vis-à-vis d’un premier épisode sans facteur de risque ou provoqué par un facteur de risque mineur est la plus délicate. Au 3e mois, il faut apprécier le risque de récidive et le risque hémorragique. Quand le risque hémorragique est élevé, il faut interrompre le traitement. Quand le risque hémorragique est faible, il faut évaluer le risque de récidive. Les outils les mieux évalués pour apprécier ces risques sont donnés dans les tableaux 7.11 et 7.12.
Tableau 7.11. Règle « HERDOO2 and Men Continue » pour apprécier le risque de récidive à l’arrêt du traitement des thromboses veineuses profondes proximales provoquées par un facteur de risque mineur ou spontanées.
| Variable | Points |
| Age ≥ 65 ans | 1 |
| D-dimères sous traitement ≤ 250 μg/L* | 1 |
| Hyperpigmentation, rougeur ou œdème du membre inférieur | 1 |
| IMC ≥ 30 kg/m2 | 1 |
| Faible risque (< 5% à un an) | 0 ou 1 point |
| Fort risque (environ 8 % à un an) | 2 points ou plus |
IMC : index de masse corporelle. *par test VIDAS DDRemarques : (1) le score n’est validé que pour les TVP et pas pour les EP, (2) le score (et notamment la valeur seuil des D-dimères) a été validé chez des malades sous AVK, (3) le score n’est utilisable que chez les femmes
Tableau 7.12. Score « VTE-bleed » évaluant le risque hémorragique sous traitement prolongé.
| Variable | Points |
| Cancer actif | 2 |
| Anémie* | 1,5 |
| Antécédent de saignement | 1,5 |
| Clairance de la créatinine entre 30 et 60 ml/min | 1,5 |
| Age ≥ 60 ans | 1,5 |
| Homme hypertendu** | 1 |
| Risque hémorragique faible | < 2 |
| Risque hémorragique élevé | ≥ 2 |
Remarques : (1) bien que comprenant la variable cancer actif, le score est adapté à la MTEV non provoquée ; (2) le score a été validé dans plusieurs cohortes sous AVK et sous AOD.
* Hémoglobine < 12 g/100 ml chez les femmes et < 13 g/100 ml chez les hommes.
** Pression systolique ≥ 140 mmHg
________________________________________________________________________________
Quand ces scores ne peuvent être utilisés et dans l’attente d’un score de récidive utilisable chez les hommes et pour les embolies pulmonaires, la décision d’arrêt ou de poursuite du traitement au 3e mois se fera au mieux lors d’une réunion pluridisciplinaire ; il est également recommandé de prendre en compte l’avis du malade, la poursuite du traitement pouvant modifier son style et sa qualité de vie.
Schémas posologiques au-delà du 3e mois
Quand le traitement est prolongé au-delà de 3 mois, différentes options thérapeutiques sont disponibles :
- si un AVK était utilisé, il est possible de le poursuivre, avec le même objectif d’INR (entre 2 et 3). Des tentatives de réduction de la posologie des AVK avec un objectif d’INR de 1,5 à 2 n’ont pas donné de bons résultats : pas moins d’hémorragies et plus de récidives ;
- si un AOD était utilisé, il est possible de le poursuivre à la dose conventionnelle, mais il est également possible de diminuer la dose de 50 %, cette dose plus faible étant aussi efficace que la dose pleine au-delà du 3e mois (apixaban 2,5 mg x 2 ou rivaroxaban 10 mg).
Anti-agrégants plaquettaires
Les antiagrégants plaquettaires n’ont pas de place dans le traitement curatif des EP ou des TVP. Ils n’ont jamais été testés à la phase aiguë ni en remplacement des anticoagulants ni en addition à ces derniers. Au-delà du 3e mois, des essais ont montré une réduction significative, mais modeste des récidives thromboemboliques quand l’aspirine est comparée au placebo chez des personnes traitées pour un premier épisode de MTEV non provoqué. Toutefois, quand l’aspirine a été comparée à un AOD, que ce dernier soit administré à dose pleine ou à dose réduite, l’aspirine est moins efficace avec un taux de récidive thromboembolique plus élevé que celui observé sous AOD.
Dans tous les cas, quel que soit le traitement proposé au-delà de 3 mois, il est important de noter qu’à l’arrêt de ce traitement le risque de récidive qui a été prévenu réapparaîtra avec une fréquence identique.
Thrombolytiques
Les anticoagulants agissent essentiellement en limitant l’extension du thrombus et préviennent ainsi les récidives thromboemboliques. Le thrombus régresse sous l’effet de la fibrinolyse endogène. Sous l’effet de celle-ci, la régression du thrombus est lente. Quand il s’agit d’une EP, aucune diminution significative de l’obstruction vasculaire n’est observée à la 24e heure et il faut attendre sept jours pour que la moitié de l’obstruction vasculaire pulmonaire régresse. Le phénomène semble encore plus lent dans les veines qui conservent plus souvent des thromboses séquellaires visibles en échographie mais qui n’ont pas toujours une traduction clinique.
Contrairement aux anticoagulants, les traitements fibrinolytiques, qui activent la plasmine directement ou indirectement, permettent une lyse du thrombus et obtiennent ainsi une désobstruction vasculaire beaucoup plus rapide. Dans l’artère pulmonaire, la désobstruction atteint généralement 30 % après deux heures et plus de 50 % après 12 heures. En raison de la relation exponentielle entre obstruction et résistance, la post-charge du ventricule droit décroît de façon très importante sous l’effet du traitement thrombolytique. Dans les veines, on observe également une désobstruction bien plus rapide avec le traitement fibrinolytique. La traduction clinique de cette action rapide est toutefois incertaine. Dans les veines, le traitement fibrinolytique ne diminue les séquelles cliniques. Dans l’artère pulmonaire, la mortalité des embolies graves est vraisemblablement diminuée, sans que cela ne soit certain. Dans les EP de gravité intermédiaire, le traitement fibrinolytique ne réduit l’incidence des états de choc secondaires, mais pas la mortalité. Le traitement fibrinolytique augmente les complications hémorragiques graves et notamment des hémorragies intracérébrales. Si ces complications ne sont pas suffisamment nombreuses pour diminuer l’intérêt du traitement dans les EP graves, il n’en va pas de même pour celles de gravité intermédiaire pour lesquelles les inconvénients hémorragiques du traitement fibrinolytique sont plus importants que ses avantages en termes d’efficacité. Enfin, il n’y a aucune place pour ce type de traitement pour les embolies de faible gravité dont le pronostic est excellent sous anticoagulants.
________________________________________________________________________________
Contre-indications au traitement fibrinolytique dans l’EP
Absolues
- Hémorragie active.
- Accident ischémique cérébral de moins de deux mois.
- Hémorragie intracrânienne.
Relatives
- Chirurgie majeure, accouchement, biopsie profonde, ponction d’un vaisseau non compressible datant de moins de 10 jours.
- Traumatisme datant de moins de 15 jours.
- Neurochirurgie ou chirurgie ophtalmologique datant de moins d’un mois.
- Hypertension sévère (systolique > 180 mm Hg, diastolique > 120 mm Hg).
- Massage cardiaque prolongé.
- Chiffre de plaquettes < 100 000 mm-3.
- Grossesse.
- Endocardite.
- Rétinopathie diabétique proliférative.
________________________________________________________________________________
La seule indication du traitement fibrinolytique est donc l’EP grave responsable d’un état de choc cardiogénique.
Le traitement fibrinolytique des thromboses veineuses est administré localement au moyen de cathéters qui exercent également une action mécanique locale pour réduire le thrombus. Si la désobstruction observée est nettement plus importante que celle obtenue par les anticoagulants, les effets recherchés sur le syndrome post-thrombotique n’ont pas été obtenus. Comme dans l’EP, le traitement fibrinolytique est accompagné de complications hémorragiques. En dehors des thromboses veineuses proximales, responsables de gangrène veineuse (phlegmatia cerulea), il n’y a pas d’indication pour le traitement fibrinolytique dans la TVP.
Traitements interventionnels
Les thérapeutiques instrumentales sont de plusieurs ordres ; à la phase aiguë, il s’agit du soutien hémodynamique, de la désobstruction vasculaire mécanique ou pharmaco-mécanique des embolies graves, de la désobstruction pharmaco-mécanique des thromboses veineuses proximales et de l’interruption de la veine cave inférieure. À la phase chronique, il s’agit de la thrombo-endartériectomie et des dilatations artérielles pulmonaires au cours de l’hypertension pulmonaire thromboembolique chronique et de la dilatation des sténoses veineuses séquellaires au cours du syndrome post-thrombotique. Enfin, la compression veineuse externe est également proposée en prévention ou comme traitement du syndrome post-thrombotique.
Soutien hémodynamique au cours de l’EP grave
L’état de choc cardiogénique au cours de l’EP grave peut être réfractaire au traitement inotrope et vasopresseur. Dans ce cas, une assistance circulatoire de type veino-artérielle associée à une oxygénothérapie extracorporelle peut être installée. Deux options s’offrent alors, soit attendre l’amélioration hémodynamique spontanée liée à la désobstruction artérielle pulmonaire progressive sous anticoagulant qui nécessite habituellement plusieurs jours, soit se servir de l’ECMO pour stabiliser le malade et réaliser une désobstruction artérielle pulmonaire, ce qui permet de limiter la durée du support extracorporel. Chez des malades particulièrement graves, les résultats restent médiocres avec une mortalité hospitalière supérieure à 50 % dans les séries de cas les moins sélectionnés.
Désobstruction artérielle pulmonaire à la phase aiguë
Elle peut être réalisée chirurgicalement ou au moyen de cathéters.
Embolectomie chirurgicale
Réalisée sous circulation extracorporelle après sternotomie, l’intervention consiste à réaliser une artériotomie artérielle pulmonaire suivie de l’extraction des thrombus les plus proximaux au moyen d’une pince ou d’un aspirateur. Malgré son apparente simplicité, l’intervention s’accompagne d’une mortalité supérieure à 5 % même dans les séries les plus récentes ; elle est réservée aux embolies graves responsables d’un état de choc quand la fibrinolyse est contre-indiquée.
Embolectomie par cathéter avec ou sans traitement fibrinolytique local à faible dose
L’embolectomie peut également être effectuée au moyen d’un cathéter introduit par voie veineuse et placé dans l’artère pulmonaire. De nombreux systèmes ont été décrits, la plupart combinent une action mécanique par aspiration, effet vortex, macération ou administration d’ultrasons avec la perfusion locale d’une faible dose de traitement fibrinolytique. En dehors d’une technique combinant ultrasons et traitement fibrinolytique, les divers cathéters n’ont fait l’objet que d’études rétrospectives sur de petits effectifs. La thrombolyse facilitée par ultrasons a fait l’objet d’une étude pilote sur 60 patients qui a démontré une plus grande réduction du rapport des diamètres ventriculaires cardiaques dans le groupe traité par ultrasons et thrombolyse. Le cathéter placé dans l’artère pulmonaire produit des ultrasons et délivre une faible dose de fibrinolytique localement, la pénétration du fibrinolytique dans le thrombus est facilitée par les ultrasons. Ces techniques, quand elles sont accessibles, constituent une option de secours en présence d’une EP grave et de contre-indications absolues à la fibrinolyse et à l’embolectomie chirurgicale.
Interruption de la veine cave inférieure
L’interruption de la veine cave consiste en l’introduction percutanée sous anesthésie locale d’un filtre qui est largué par un cathéter dans la veine cave inférieure (fig. 7.38). Son but est d’empêcher la migration de thrombus du système cave inférieur vers la circulation pulmonaire. Les filtres actuels sont dits optionnels dans la mesure où ils peuvent être laissés en place indéfiniment ou être retirés après quelques semaines ou mois d’utilisation.
________________________________________________________________________________
Figure 7.38. Différents types de filtre cave optionnels ou à option de retrait.
Ces filtres sont posés sous anesthésie locale par voie percutanée fémorale ou jugulaire et sont alors déployés dans la veine cave inférieure sous-rénale
________________________________________________________________________________
Les complications de la technique sont rares mais peuvent être graves, de la simple angulation du filtre dans la veine cave, ce qui limite son efficacité, à la perforation de la veine cave, la migration d’une partie du dispositif dans les vaisseaux ou organes abdominaux ou à la migration de l’ensemble du filtre dans les cavités cardiaques droites ou l’artère pulmonaire.
Les indications validées ou reconnues de l’interruption cave comportent les thromboses veineuses proximales et les embolies pulmonaires qui surviennent en présence d’une contre-indication formelle au traitement anticoagulant et les récidives emboliques cliniquement significatives sous traitement anticoagulant bien conduit.
En revanche, l’interruption cave n’apporte aucune sécurité supplémentaire quand un traitement anticoagulant peut être administré même en cas d’EP grave ou de TVP iliaque ou cave. La présence d’un thrombus dit flottant qui ne semble pas adhérer à la paroi veineuse sur plusieurs centimètres, n’est pas non plus une indication au filtre (tout thrombus veineux récent est initialement flottant).
Traitement de l’hypertension pulmonaire thromboembolique chronique
Traitement anticoagulant
Il repose avant tout sur le traitement anticoagulant oral par antivitaminiques K à dose curative pour obtenir un INR entre 2 et 3. Il permet d’éviter les récidives thrombo-emboliques mais ne modifie pas le cours évolutif de la maladie. Les AOD n’ont pas été évalués dans cette indication et leur utilisation n’est donc pas recommandée. Par ailleurs, il peut exister des interactions médicamenteuses potentielles avec les traitements antihypertenseurs pulmonaires spécifiques.
Interruption de la veine cave inférieure
Son utilisation demeure controversée dans l’HTP-TEC. Dans le passé, le filtre cave était fréquemment posé notamment après une endartérectomie pulmonaire. Toutefois, le registre multicentrique européen montre que la présence ou l’absence de filtre cave n’a pas d’effet sur la survie à un an après endartérectomie pulmonaire. À l’heure actuelle, le filtre cave reste utilisé, dans l’HTP-TEC, en cas de contre-indication ou de récidive thromboembolique malgré une anticoagulation efficace.
Endartérectomie pulmonaire
Il s’agit du premier traitement qui a réellement transformé le pronostic de l’HTP-TEC. Cette intervention consiste à extraire le matériel fibreux obstruant le lit vasculaire pulmonaire. Elle est réalisée sous circulation extracorporelle, après arrêt circulatoire et en hypothermie profonde (18 °C) afin de limiter les séquelles neurologiques. L’artère pulmonaire droite puis gauche est ouverte et le chirurgien va disséquer et littéralement « peler » l’intérieur des artères pulmonaires en partant de la portion proximale et en allant en distalité aussi loin que possible dans le lit vasculaire pulmonaire (fig. 7.39). Dans les centres très spécialisés pratiquant plus de 50 endartérectomies par an, la mortalité péri-opératoire est de l’ordre de 3 %. Cette intervention permet d’améliorer l’hémodynamique et réduit les résistances vasculaires pulmonaires postopératoires de près de 60 %. Dans le registre multicentrique européen, la survie à 1, 2 et 3 ans des patients opérés était de 93 %, 91 % et 89 % respectivement ; celle des patients inopérables, soit en raison de lésions trop distales soit en raison de comorbidités, était respectivement de 88 %, 79 % et 70 %. Entre 20 et 30 % des patients opérés gardent une hypertension pulmonaire en post-opératoire. L’impact clinique à moyen et long terme de cette hypertension pulmonaire post-opératoire persistante est toutefois mal évalué.
________________________________________________________________________________
Figure 7.39. Représentation schématique d’une endartériectomie pulmonaire.
L’artère pulmonaire est ouverte et la chirurgie va « peler » l’intérieur de l’artère pulmonaire afin d’extraire le matériel composé de thrombus fibreux plus ou moins mêlés à des thrombus plus frais.
Cliché aimablement fourni par le Pr Elie Fadel, Centre Chirurgical Marie Lannelongue.
________________________________________________________________________________
Près de 40 % des patients ne sont pas opérables, soit en raison de la localisation trop distale des lésions vasculaires pulmonaires, soit en raison de comorbidités. Chez ces patients, deux options thérapeutiques sont désormais discutées : le traitement spécifique antihypertenseur pulmonaire et l’angioplastie pulmonaire par ballonnet.
Angioplastie pulmonaire par ballonnet
L’angioplastie pulmonaire par ballonnet (APB) est un nouveau traitement qui consiste à dilater les sténoses vasculaires pulmonaires. Quatre à cinq séances d’APB sont en général nécessaires mais les séances peuvent être poursuivies au-delà s’il persiste une hypertension pulmonaire et surtout s’il existe des lésions vasculaires à dilater. La principale complication est la survenue d’hémoptysies rarement massives et dues soit à une rupture artérielle pulmonaire soit à des lésions endovasculaires par les guides ou les cathéters utilisés. Les premiers résultats sont prometteurs avec une réduction significative des résistances pulmonaires dans des centres spécialisés. L’impact sur la survie à court et moyen terme reste à déterminer.
Traitements spécifiques antihypertenseurs pulmonaires
Ces traitements ciblent la dysfonction endothéliale pulmonaire et agissent sur la part de remodelage vasculaire pulmonaire. Le riociguat est un activateur de la guanylate cyclase soluble (sGC) impliquée dans la synthèse du second messager du monoxyde d’azote (NO) (GMPc). L’efficacité de cette molécule a été établie dans un essai de phase 3 contre placebo. L’efficacité du macitentan, un antagoniste non sélectif des récepteurs de l’endothéline, a été montrée dans un essai de phase 2 contre placebo chez des malades atteints d’HTP-TEC inopérables ou persistante après chirurgie.
Ces différents traitements peuvent être associés (traitement spécifique médicamenteux et APB ± chirurgie). Les différentes options thérapeutiques doivent être discutées dans des centres spécialisés et nécessitent un suivi rigoureux. En cas d’échec des traitements, la transplantation pulmonaire ou cardio-pulmonaire demeure la seule alternative chez les patients jeunes (< 60 ans) sans comorbidités importantes.
Compression veineuse
La compression veineuse par bas de compression a deux buts : prévenir et traiter le syndrome post-thrombotique.
Le syndrome post-thrombotique se manifeste par des symptômes de gravité variable allant de simples sensations de lourdeur des membres inférieurs à la formation de varices, d’œdème, de signes inflammatoires chroniques, de modifications cutanées comprenant une modification de la coloration de la peau (dermite ocre) et une fragilité du revêtement cutané à l’origine d’ulcères chroniques. Les formes les plus sévères sont réellement invalidantes. Des données anciennes ont longtemps suggéré qu’une compression par mi-bas (comprimant le mollet) permettait de prévenir le syndrome post-thrombotique après une TVP proximale. Ces données ont été mises en cause récemment par un grand essai qui ne semble pas montrer de bénéfice de la compression. L’intérêt de la compression veineuse est donc toujours discuté et les attitudes variables. La gravité du syndrome post-thrombotique semble liée à la gravité des symptômes initiaux à la phase aiguë de la TVP, la compression semble donc peu ou pas utile en cas de TVP asymptomatique.
________________________________________________________________________________
Points importants
- L’incidence de la maladie thromboembolique veineuse est de l’ordre de 160 cas pour 100 000 habitants en France, répartis en un tiers d’embolie pulmonaire et deux tiers de thrombose veineuse profonde.
- L’incidence de la maladie thromboembolique veineuse augmente avec l’âge et n’est pas différente chez l’homme et chez la femme.
- Les facteurs de risque clinique de la maladie thromboembolique veineuse sont la chirurgie, le cancer, le traumatisme, l’immobilisation, la grossesse et le post-partum, la contraception.
- À noter que dans un cas sur deux, il n’y a pas de facteur clinique identifié.
- Parmi les facteurs de risque biologique (thrombophilie) il faut noter les déficits en antithrombines, protéine C, protéine S ainsi que la mutation Leiden du facteur V.
- Une recherche de syndrome des antiphospholipides est également systématique devant toute maladie thromboembolique veineuse de cause indéterminée chez un sujet âgé de moins de 50 ans.
- L’antithrombine inactive principalement la thrombine et le facteur Xa.
- La protéine C et la protéine S sont des protéines vitamine K dépendantes.
- La protéine C nécessite pour être activée la fixation de la thrombine sur un récepteur situé sur la surface de l’endothélium, la thrombomoduline.
- Pour être active, la protéine C nécessite elle-même un cofacteur, la protéine S.
- Les déficits en antithrombine, protéine C et protéine S ont une transmission autosomique dominante.
- Le plasminogène est converti en plasmine par clivage enzymatique.
- L’embolie pulmonaire est une migration d’un thrombus veineux dans l’arbre artériel pulmonaire et a des conséquences respiratoires (effet espace mort) et circulatoires.
- L’interdépendance ventriculaire se caractérise comme une réduction de la précharge ventriculaire gauche consécutive à une dilatation des cavités droites, à l’origine d’une baisse du débit cardiaque.
- L’hypertension pulmonaire thromboembolique chronique (HTP-TEC) est liée à la persistance et à l’organisation fibreuse de caillots fibrinocruoriques après une ou plusieurs embolies pulmonaires.
- Les thromboses veineuses profondes des membres se manifestent par des douleurs, isolées ou associées à un œdème du membre siège de la thrombose. Elles sont asymptomatiques dans un cas sur deux.
- La douleur thoracique ou la dyspnée ne sont observées que dans 70 % des cas d’embolie pulmonaire documentée.
- Le risque de syncope doit être connu et faire rechercher une embolie pulmonaire devant une syncope sans cause cardiaque évidente.
- Un score de probabilité clinique de la thrombose veineuse profonde a été décrit par Wells et prend en considération l’antécédent de thrombose veineuse, le cancer actif, l’immobilisation plâtrée, l’alitement, les douleurs localisées sur le trajet veineux, les œdèmes localisés ou généralisés, la circulation veineuse collatérale.
- Le score de probabilité clinique d’embolie pulmonaire ou score de Genève prend en considération l’âge supérieur à 65 ans, l’antécédent de maladie thromboembolique veineuse, un cancer actif inférieur à un an, une chirurgie ou une fracture inférieure à un mois, une douleur unilatérale d’un membre inférieur, une hémoptysie, une fréquence cardiaque supérieure à 75 bpm, un œdème douloureux unilatéral.
- Les D-dimères proviennent de la lyse de la fibrine par la plasmine et témoignent d’une fibrinoformation.
- La quantification des D-dimères, avec un seuil à 500 μg/l, permet lorsque le test est négatif d’éliminer le diagnostic de maladie thromboembolique veineuse dans 95 % des cas, en cas de probabilité clinique faible ou intermédiaire.
- Il n’y a pas d’indication à doser les D-dimères en cas de probabilité clinique élevée.
- Le seuil des D-dimères est corrigé avec l’âge pour le diagnostic d’embolie pulmonaire (mais non de TVP) ; il est alors calculé en multipliant l’âge par dix.
- L’angioscanner pulmonaire est la méthode de référence diagnostic de l’embolie pulmonaire mettant en évidence des lacunes dans les artères opacifiées par l’injection d’iode, en l’absence d’insuffisance rénale ou d’allergie documentée au produit de contraste iodé.
- La scintigraphie pulmonaire de perfusion-ventilation peut être indiquée en cas de contre-indication à l’angioscanner.
- L’écho-Doppler veineux est systématiquement réalisé à la recherche d’une thrombose veineuse profonde proximale, poplitée, fémorale ou iliaque.
- L’échographie cardiaque n’est pas indispensable au diagnostic d’embolie pulmonaire, sauf dans les formes graves, à la recherche d’un cœur pulmonaire aigu (dilatation ventriculaire droite, septum paradoxal, hypertension pulmonaire).
- L’évaluation de la gravité d’une embolie pulmonaire repose sur le calcul du score PESI (pulmonary embolism severity index).
- Un score PESI simplifié a été proposé, prenant en considération (un point par caractéristique) l’âge supérieur à 80 ans, la présence d’un cancer, d’une insuffisance respiratoire ou cardiaque, une pression artérielle systolique inférieure à 100 mmHg, une fréquence cardiaque supérieure à 110 bpm et une SAO2 inférieure à 90 %.
- Des critères ont été proposés pour le traitement ambulatoire de l’embolie pulmonaire (critères HESTIA).
- Le diagnostic étiologique de maladie thromboembolique veineuse repose sur la recherche d’un cancer et d’une thrombophilie biologique.
- La recherche d’une thrombophilie biologique doit être faite en dehors de tout traitement anticoagulant.
- L’échocardiographie est l’examen de dépistage de l’hypertension pulmonaire, reposant sur la mesure de la vélocité de l’insuffisance tricuspide et la recherche d’autres signes évocateurs d’une hypertension pulmonaire (dilatation du ventricule droit, temps d’accélération du flux pulmonaire, dilatation de la veine cave inférieure).
- Le cathétérisme cardiaque droit est indispensable chez les patients présentant une probabilité échographique moyenne ou forte d’hypertension pulmonaire.
- Une hypertension pulmonaire pré capillaire est définie par une pression artérielle pulmonaire moyenne supérieure ou égale à 25 mmHg et une PAP d’occlusion inférieure strictement à 15 mmHg.
- Le traitement des thromboses veineuses profondes et de l’embolie pulmonaire repose sur les anticoagulants ; il n’y a pas de place pour le traitement antiagrégant plaquettaire.
- Les anticoagulants à disposition sont l’héparine, le fondaparinux, les anticoagulants oraux vitamine K dépendants et les anticoagulants oraux directs, anti-IIa et anti-Xa.
- La durée du traitement anticoagulant après le diagnostic d’une thrombose veineuse profonde ou d’une embolie pulmonaire dépend de la présence d’un facteur de risque sous-jacent :
- en cas de facteur de risque transitoire majeur ou mineur, la durée du traitement est fixée à trois mois ;
- en cas de facteur de risque majeur prolongé, tel un cancer, le traitement anticoagulant doit être poursuivi tant que le facteur de risque persiste ;
- en cas de deuxième épisode non provoqué par un facteur de risque majeur, le traitement est alors de durée indéfinie ;
- enfin, en cas de déficit en antithrombine ou de syndrome des antiphospholipides, la durée du traitement est également indéterminée.
- Les thrombolytiques (fibrinolytiques) sont rarement indiqués dans l’embolie pulmonaire grave.
- L’indication de la désobstruction artérielle pulmonaire à la phase aiguë, embolectomie chirurgicale ou embolectomie par cathéter avec ou sans traitement fibrinolytique local à faible dose, est exceptionnelle.
- L’interruption de la veine cave inférieure est à discuter en cas de contre-indication au traitement anticoagulant ou de complication hémorragique majeure sous traitement anticoagulant.
- Le traitement anticoagulant est indiqué dans l’hypertension pulmonaire thromboembolique chronique (HTP-TEC).
- L’endartériectomie pulmonaire ou l’angioplastie pulmonaire par ballonnet peut être proposée au terme d’une confrontation médicoradiologique.
- La compression veineuse par bas de compression a pour objectif de prévenir et de traiter le syndrome post thrombotique.
________________________________________________________________________________
Exercices en ligne
Les exercices relatifs à ce chapitre sont disponibles en ligne à l’adresse suivante : http://www.em-consulte.com/e-complement/475848
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

7.1 Pathologies de l'aorte et des artères cérébrales et périphériques Auteurs : V. Aboyans [...]

Auteurs : D. Legallois, P. Milliez Anatomie L'étude de l'électrophysiologie cardiaque nécessite de connaître [...]


