Chapitre 1 Notions de base sur le système cardiovasculaire : anatomie, embryologie, histologie, physiologie, hémostase-coagulation
- Borgel , S. Dupont , J. Emmerich , L. Houyel , J.-J. Mercadier , A. Sannier et J.-M. Schleich
Plan du chapitre
- Anatomie du système cardiovasculaire2
- Embryologie cardiaque9
- Histologie12
- Physiologie16
- Hémostase-coagulation28
- Exercices en ligne37
________________________________________________________________________________Le système cardiovasculaire, encore appelé circulation, comprend le cœur et les vaisseaux. Son rôle est d’apporter à toutes les cellules de l’organisme l’oxygène et les nutriments nécessaires à leur bon fonctionnement, et ce, en toutes circonstances, c’est-à-dire au repos comme à l’effort, qu’il soit bref ou prolongé. Dans ce contexte, le cœur assure le rôle d’une pompe génératrice d’un débit, mouvement du sang à travers tous les vaisseaux de l’organisme, mais aussi le rôle de pompe responsable de la pression qui règne dans la circulation, responsabilité partagée, en première approximation, avec les résistances vasculaires. Les vaisseaux assurent, pour leur part, un rôle de distribution du sang aux différents organes et tissus de l’organisme.
S’il existe anatomiquement deux cœurs placés en parallèle dans le thorax, le cœur gauche et le cœur droit, et deux circulations, la circulation systémique et la circulation pulmonaire, les deux cœurs et les circulations auxquelles ils appartiennent sont fonctionnellement placés en série, les vaisseaux (artères qui quittent le cœur et veines qui reviennent vers le cœur), s’intercalant entre eux. La particularité de la pompe cardiaque dans ce circuit est qu’elle n’assure pas un débit continu comme le fait une turbine mais, au contraire, un débit discontinu, pulsatile, où se succèdent une phase de remplissage des ventricules suivie d’une phase d’éjection du sang dans les artères qui assure à la fois le débit et la pression.
Cet enchaînement est rendu possible grâce à l’automatisme cardiaque qui naît au niveau des cellules du nœud sinuatrial sous la forme d’un potentiel d’action (PA, voir chapitre 6) qui se transmet de proche en proche par l’intermédiaire des voies de conduction jusqu’aux myocytes contractiles du myocarde dont il déclenche la contraction, rapidement suivie de la relaxation, le tout sous la dépendance de phénomènes moléculaires extrêmement précis, rigoureusement organisés dans l’espace et dans le temps au niveau des myocytes cardiaques (appelés communément cardiomyocytes). Des phénomènes analogues (contraction et relaxation) s’observent au niveau vasculaire et sont connus sous le nom de vasomotricité. Ils comportent un certain nombre de différences avec les contraction/relaxation cardiaques dont la plus notable est le délai de mise en jeu. La vasomotricité participe à la régulation des pressions artérielles systémique et pulmonaire et à la modulation de la distribution du débit cardiaque aux différents organes et tissus de l’organisme.
Pour faire face à la grande variabilité des besoins de l’organisme au cours du temps, le fonctionnement de l’ensemble du système cardiovasculaire est finement régulé grâce à un système de régulation nerveux et humoral permettant, d’une part, la régulation de la pression artérielle systémique, grandeur régulée du système cardiovasculaire et, d’autre part, l’adaptation du débit cardiaque aux besoins de l’organisme.
Avant de décrire les grands principes de la physiologie du système cardiovasculaire, il convient de décrire son anatomie, son embryologie et ses caractéristiques histologiques. Enfin, ce chapitre d’introduction apportera une brève description de la coagulation et de l’hémostase qui jouent un rôle important dans la physiologie et la physiopathologie de la circulation.
Anatomie du système cardiovasculaire
Le système cardiovasculaire est composé d’une grande circulation, ou circulation systémique, qui alimente tous les organes en sang oxygéné et ramène au cœur le sang appauvri en oxygène et d’une petite circulation, ou circulation pulmonaire, qui sert à la réoxygénation du sang via des échanges gazeux entre les globules rouges contenus dans les capillaires pulmonaires et l’air contenu dans les alvéoles. Le cœur constitue le carrefour de ce système, agissant comme une pompe qui éjecte le sang par l’artère pulmonaire et l’aorte et vers laquelle revient le sang par les veines caves et les veines pulmonaires.
Cœur
Situation
Le cœur est un muscle strié creux formé de quatre cavités : deux atriums (droit et gauche), et deux ventricules (droit et gauche). Il se situe dans le thorax, dans le médiastin antérieur, à gauche du bord droit du sternum. Il se projette du troisième au sixième espace intercostal, en regard des vertèbres T6 à T8.
Le médiastin est la partie centrale de la cavité thoracique située entre les deux cavités pleuropulmonaires. Il est divisé en trois parties, selon deux plans frontaux, passant en avant et en arrière de la trachée. On distingue ainsi :
- le médiastin antérieur avec le cœur entouré du péricarde et les gros vaisseaux arrivant ou partant du cœur ;
- le médiastin moyen avec l’arbre trachéo-bronchique ;
- le médiastin postérieur avec, entre autres, l’aorte thoracique descendante, l’œsophage thoracique, le conduit lymphatique thoracique et le système veineux azygos.
Les rapports du cœur sont :
- les parois thoraciques : en arrière le rachis thoracique, latéralement les côtes, en avant le plastron sterno-costal et en bas le diaphragme (le cœur repose sur la coupole diaphragmatique gauche) ;
- les organes médiastinaux : notamment en arrière l’œsophage.
Morphologie externe
Le cœur est subdivisé en deux parties non communicantes par une cloison étanche ou septum : le cœur droit (atrium droit + ventricule droit) qui appartient à la circulation pulmonaire et le cœur gauche (atrium gauche + ventricule gauche) qui appartient à la circulation systémique.
Des sillons délimitent, sur la face externe du cœur, les cavités atriales et ventriculaires : sillons atrioventriculaires, interventriculaires et inter-atriaux. Les vaisseaux coronaires cheminent dans ces sillons (fig. 1.1 et 1.2).
________________________________________________________________________________
Figure 1.1.
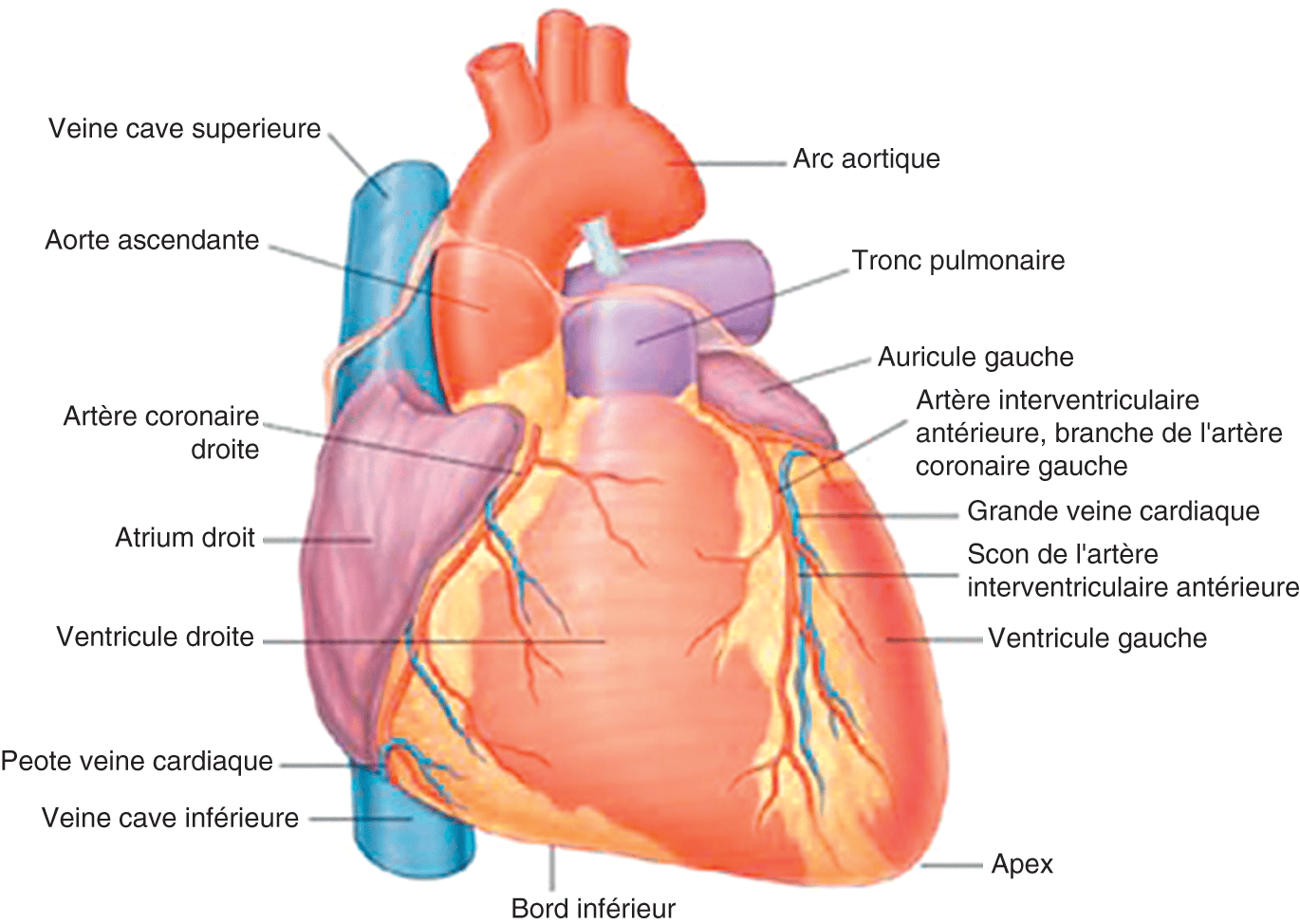
Vue antérieure du cœur.
Source : Gray’s anatomie, Le Manuel pour les étudiants. Elsevier ; 2020.
________________________________________________________________________________
________________________________________________________________________________
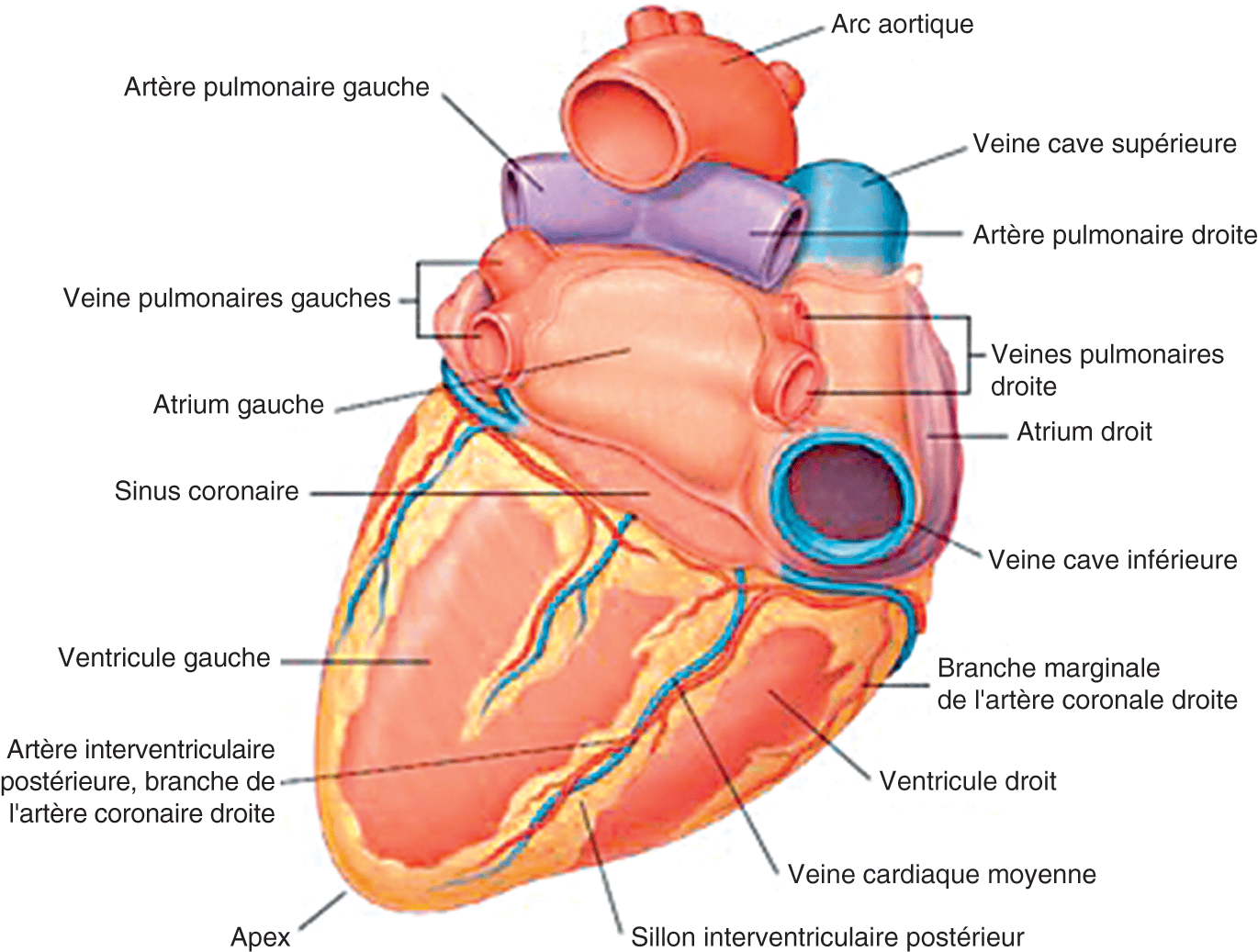
Figure 1.2.
Vue postérieure du cœur.
Source : Gray’s anatomie, Le Manuel pour les étudiants. Elsevier ; 2020.
________________________________________________________________________________
Le cœur pèse de 250 à 300 g chez l’adulte et a une forme de pyramide triangulaire avec trois faces, une base et un apex :
- la face ventrale ou antérieure (ou sterno-costale) correspond principalement au ventricule droit et à la partie antérieure de l’atrium droit avec son excroissance : l’auricule droite ;
- la face inférieure (ou diaphragmatique) correspond principalement au ventricule gauche ;
- la face gauche (ou pulmonaire) correspond principalement au ventricule gauche ainsi qu’à l’auricule gauche (excroissance de l’atrium gauche) ;
- la base représente la face dorsale ou postérieure du cœur occupée à droite par l’atrium droit et à gauche par l’atrium gauche ;
- l’apex, ou sommet, ou encore pointe du cœur.
Le grand axe du cœur est dirigé vers l’avant, la gauche et légèrement vers le bas. Chez les sujets longilignes, le grand axe se rapproche de la verticale, chez les sujets brévilignes de l’horizontale.
Morphologie interne
L’atrium droit et l’atrium gauche sont séparés par le septum interatrial, le ventricule droit et le ventricule gauche par le septum interventriculaire. Entre le septum interatrial et le septum interventriculaire, on distingue le court septum atrioventriculaire qui sépare l’atrium droit du ventricule gauche.
La face interne des atriums est lisse, la face interne des ventricules est hérissée de saillies musculaires appelées colonnes charnues :
- de premier ordre : muscles papillaires ou piliers ;
- de second ordre : fixées à la paroi interne par leurs extrémités et libres dans leur partie intermédiaire ;
- de troisième ordre : simples excroissances adhérant à la paroi interne sur toute leur longueur.
Les colonnes charnues de premier ordre (ou muscles papillaires ou piliers) servent d’attache aux cordages permettant l’ouverture et la fermeture des valves atrioventriculaires fermant la communication (ostium) entre les atriums et les ventricules.
Cœur droit
Atrium droit
L’atrium droit est assimilé à un cube à six faces à grand axe vertical avec :
- une face supérieure dans laquelle s’abouche la veine cave supérieure par un ostium avalvulaire ;
- une face inférieure dans laquelle s’abouchent, en arrière, la veine cave inférieure par un ostium valvulaire (valvule d’Eustache) et, en avant et médialement, le sinus coronaire, entouré par sa valve (dite valvule de Thébésius) ;
- une face latérale, hérissée de muscles pectinés, structures musculaires peu saillantes, formant une excroissance de la paroi atriale ;
- une face médiale ou septale formée par le septum interatrial avec, à sa partie moyenne, une dépression : la fosse ovale limitée en haut et en avant par un repli en croissant : le limbus de la fosse ovale (ou anneau de Vieussens) ; la fosse ovale est le vestige du foramen ovale, témoin de la communication embryonnaire entre les deux atriums ;
- une face dorsale ou postérieure, lisse, présentant dans sa partie moyenne une saillie transversale, le tubercule intraveineux (de Lower), à égale distance des deux orifices caves. Les bords droits des ostiums caves sont unis par la crête terminale ;
- une face ventrale ou antérieure qui répond à l’ostium atrioventriculaire droit et se prolonge latéralement par l’auricule droite.
Ventricule droit
Le ventricule droit est en forme de pyramide à trois faces (ventrale ou antérieure qui est sternocostale, inférieure ou diaphragmatique, et interne ou septale) et une base formée de l’ostium atrioventriculaire droit et de l’ostium du tronc pulmonaire.
Le ventricule droit présente quatre groupes de colonnes charnues de premier ordre servant d’arrimage aux cordages de la valve tricuspide :
- le pilier antérieur (ou muscle papillaire antérieur) situé à partie moyenne de la paroi antérieure du ventricule droit ;
- les piliers internes situés sur le septum interventriculaire et répartis en deux groupes : supérieur à la base de l’infundibulum pulmonaire ou muscle papillaire du cône artériel et inférieur formé de plusieurs petits muscles ;
- le pilier postérieur situé sur la paroi inférieure du ventricule droit ;
- les piliers externes répondent au bord externe du ventricule droit.
La paroi interne ou septale est soulevée à sa partie moyenne par une saillie musculaire, l’éperon de Wolf. Au-dessus de l’éperon et de son prolongement antéro-inférieur, la bandelette ansiforme, se situe la chambre de chasse du ventricule avec l’infundibulum qui mène à l’orifice pulmonaire. Au-dessous de l’éperon se situe la chambre de remplissage qui reçoit le sang en provenance de l’atrium droit.
Cœur gauche
Atrium gauche
L’atrium gauche a une forme arrondie, à six faces :
- une face latérale lisse, l’auricule gauche se place en avant de cette face ;
- une face médiale correspondant au septum inter-atrial ;
- une face supérieure et une face inférieure, étroites et lisses ;
- une face dorsale ou postérieure recevant l’abouchement des quatre veines pulmonaires ;
- une face ventrale ou antérieure occupée par l’ostium atrioventriculaire gauche et par l’ostium de l’auricule gauche.
Ventricule gauche
Le ventricule gauche a une forme de cône aplati. Il présente :
- un sommet, à la pointe du cœur, et une base occupée en bas et à gauche par l’ostium atrioventriculaire gauche, et en haut et à droite par l’ostium aortique ;
- deux faces : une face gauche (latérale, présentant de nombreuses colonnes charnues) et une face droite (médiale, correspond au septum interventriculaire).
Le ventricule gauche présente deux groupes de colonnes charnues de premier ordre servant d’arrimage aux cordages de la valve mitrale :
- le pilier antérieur (ou muscle papillaire antérieur) implanté sur la paroi antérieure du ventricule gauche ;
- le pilier postérieur (ou muscle papillaire postérieur) implanté sur la paroi postérieure du ventricule gauche ;
On distingue fonctionnellement une chambre de remplissage qui reçoit le sang en provenance de l’atrium gauche, limitée par la paroi gauche, la grande valve mitrale, ses cordages et les deux piliers et une chambre de chasse – ou canal aortique – dont le sang est éjecté dans l’aorte, située entre la grande valve à gauche et le septum à droite.
Valves du cœur
Valves atrioventriculaires
Les ostiums atrioventriculaires, permettant la communication entre atriums et ventricules, sont fermés par des valves atrioventriculaires : valve mitrale à gauche et valve tricuspide à droite.
Ces valves atrioventriculaires sont amarrées aux muscles papillaires de la paroi ventriculaire par des cordages tendineux. Ces cordages sont de trois ordres :
- cordages de premier ordre : se fixent sur la base des valves ;
- cordages de deuxième ordre : se fixent sur la base pariétale des valves ;
- cordages de troisième ordre : se fixent sur le bord libre des valves.
La valve mitrale est annexée à l’ostium atrioventriculaire gauche situé à la base du ventricule gauche. Elle est composée de deux valvules ou cuspides : antérieure (ou grande valve mitrale) et postérieure (ou petite valve mitrale), possédant chacune un bord adhérent et un bord libre, une face atriale et une face pariétale (en rapport avec la cavité ventriculaire et recevant les insertions des cordages tendineux). Les valvules ou cuspides sont séparées par deux commissures, antérieure et postérieure. La valve mitrale s’ouvre à l’intérieur du ventricule gauche.
La valve tricuspide est annexée à l’ostium atrioventriculaire droit situé à la base du ventricule droit. Elle est composée de trois valvules ou cuspides : antérieure, postérieure et interne ou septale, possédant chacune un bord adhérent et un bord libre, une face atriale et une face pariétale. Les valvules ou cuspides sont séparées par trois commissures. La valve tricuspide s’ouvre à l’intérieur du ventricule droit (fig. 1.4).
________________________________________________________________________________
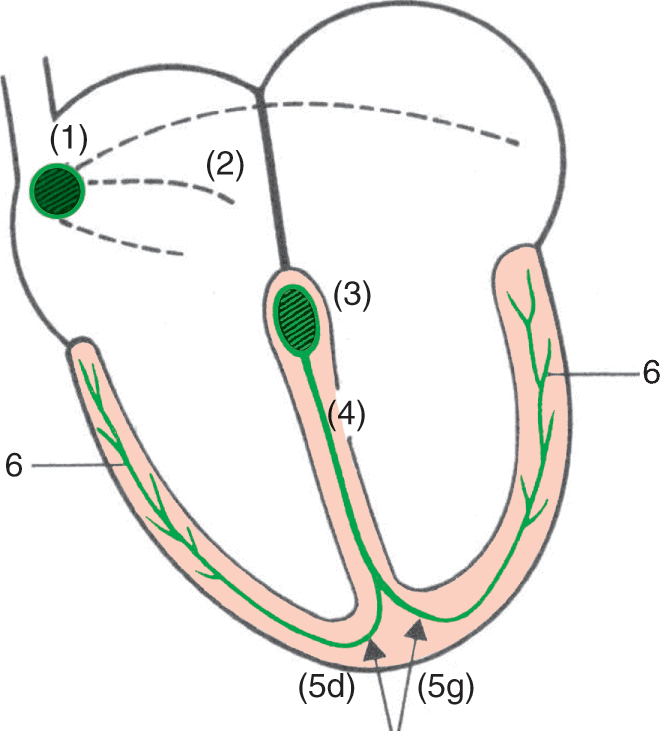
Figure 1.3.
Tissu nodal et de conduction.
- Noeud sinuatrial (ou noeud de Keith et Flack) ; 2. Faisceaux internodaux ; 3. Noeud atrioventriculaire (ou noeud d’Aschoff-Tawara) ; 4. Tronc du faisceau de His ; 5d. Branche droite du faisceau de His ; 5g. Branche gauche du faisceau de His ; 6. Réseau de Purkinje.
________________________________________________________________________________
Valves artérielles
L’aorte émerge du ventricule gauche et l’artère pulmonaire émerge du ventricule droit. Des valves sigmoïdes artérielles ferment l’émergence de ces gros vaisseaux dans les ventricules : valve pulmonaire à droite, valve aortique à gauche.
Les valvules sigmoïdes artérielles ou valvules semi-lunaires sont composées :
- pour la valve pulmonaire, de trois valvules semi-lunaires : gauche et droite (postérolatérales) et antérieure ;
- pour la valve aortique, de trois valvules semi-lunaires : gauche et droite (antérolatérales) et postérieure.
Tissu nodal et de conduction, innervation cardiaque
Tissu nodal et de conduction
Le tissu nodal et de conduction, parfois appelé système nerveux intrinsèque du cœur, est responsable de l’automatisme cardiaque et de la transmission de cet automatisme à toutes les cellules musculaires du cœur (fig. 1.3). Le terme système nerveux intrinsèque est en fait impropre puisque ce système est formé de cellules musculaires spécifiques : le tissu nodal divisé en deux segments :
- l’appareil atrionecteur : nœud sinuatrial (ancien nœud sinusal ou nœud de Keith et Flack) et fibres atriales internodales. Il semble, cependant, qu’il n’existe pas de fibres ou de « faisceaux » de conduction anatomiquement identifiables entre les nœuds, mais plutôt des voies de conduction préférentielle qui contournent les obstacles constitués par les orifices ;
- l’appareil ventriculonecteur comportant :
- le nœud atrioventriculaire (ou nœud d’Aschoff et Tawara) ;
- le faisceau atrioventriculaire (ou faisceau de His) qui se prolonge par le réseau de Purkinje.
________________________________________________________________________________
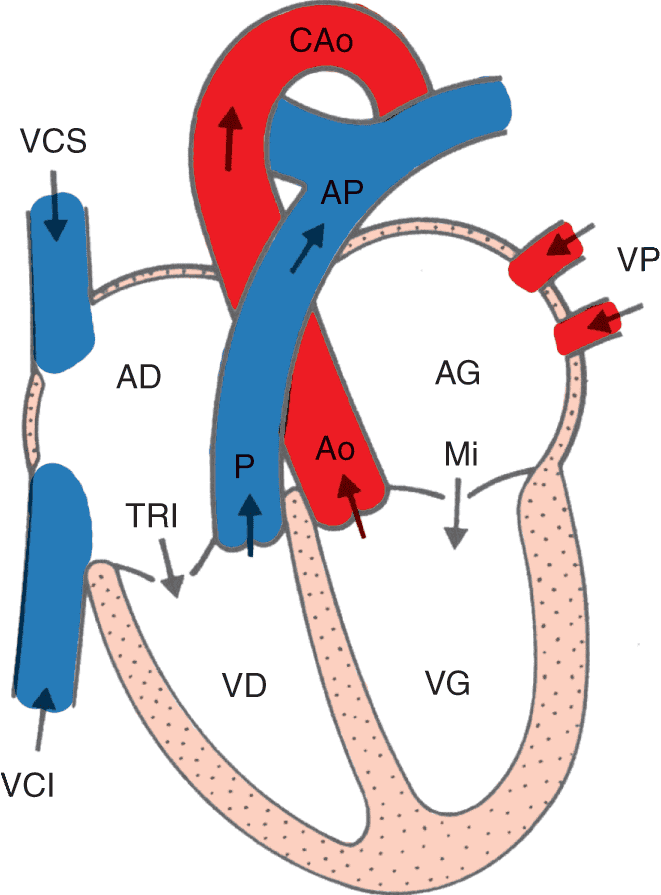
Figure 1.4.
Configuration interne du coeur et de ses connexions vasculaires.
AD, atrium droit : AG, atrium gauche ; VD, ventricule droit ; VG, ventricule gauche ; VCS, veine cave supérieure ; VCI, veine cave inférieure ; VP, veine pulmonaire ; TRI, valve tricuspide, Mi, valve mitrale ; P, valve pulmonaire ; Ao, valve aortique ; AP, artère pulmonaire ; CAo, crosse de l’aorte. Les flèches indiquent le sens de circulation du sang.
________________________________________________________________________________
Le nœud sinuatrial est situé dans la paroi postérieure de l’atrium droit, entre l’orifice de la veine cave supérieure et l’auricule droite, occupant les 2/3 supérieurs de la crête terminale. Il initie le rythme cardiaque.
Le nœud atrioventriculaire est situé sur le plancher de l’atrium droit, contre la cloison interatriale. Le faisceau atrioventriculaire (ou faisceau de His) naît dans le prolongement du nœud atrioventriculaire, puis descend dans le septum atrioventriculaire puis interventriculaire, croise l’insertion de la valvule septale de la valve tricuspide, et se divise en deux branches :
- une branche droite qui descend sur le bord droit du septum interventriculaire, puis pénètre dans la bandelette ansiforme (colonne charnue de deuxième ordre de la paroi du ventricule droit), gagne le pilier antérieur de la valve tricuspide et, enfin, se termine dans les parois du ventricule droit (réseau de Purkinje) ;
- une branche gauche qui traverse le septum interventriculaire, gagne son bord gauche puis se divise en deux hémi-branches, antérieure et postérieure gauches qui se terminent toutes deux dans les parois du ventricule gauche (réseau de Purkinje).
Innervation extrinsèque
Le cœur est innervé par des plexus cardiaques, réunion de nerfs à destination cardiaque issus du système nerveux autonome, sympathique et parasympathique.
Les axones des neurones préganglionnaires du système sympathique (appelés premiers neurones) émergent de la moelle entre C7 et T6 et rejoignent les ganglions de la chaîne sympathique latérovertébrale où ils font relais avec les neurones postganglionnaires (appelés seconds neurones). Ces derniers se distribuent à l’ensemble du cœur, innervant les nœuds sinuatrial et atrioventriculaire ainsi que le tissu de conduction ainsi que la totalité du myocarde contractile des oreillettes et des ventricules.
Les neurones préganglionnaires (premiers neurones) du système parasympathique empruntent la Xe paire crânienne et font relais avec les seconds neurones au niveau de ganglions situés à proximité du cœur, notamment dans le plexus sous-aortique. Les seconds neurones innervent essentiellement les nœuds, accessoirement les atriums mais, en principe, pas le myocarde ventriculaire. Ce point reste néanmoins discuté.
Vascularisation du cœur
La vascularisation artérielle du cœur est assurée par les artères coronaires droite et gauche, la vascularisation veineuse par les veines coronaires. Les artères coronaires et leurs collatérales sont largement anastomosées entre elles, ce qui crée des circuits de suppléance en cas d’obstruction artérielle.
Au repos, 5 % du débit cardiaque sert à l’irrigation du myocarde par les artères coronaires, le reste emprunte l’aorte pour être distribué à la tête, aux membres et aux organes périphériques.
Les artères coronaires donnent deux types de branches (voir fig. 1.1 et 1.2) :
- des branches pariétales pour la paroi des atriums et des ventricules ;
- des branches septales, perforantes, pénétrant dans les septums et vascularisant notamment le système cardionecteur.
Artère coronaire droite
L’artère coronaire droite prend son origine au niveau du sinus aortique (de Valsalva) juste après la naissance de l’aorte, en regard de la valvule semi-lunaire antéro-droite. On lui décrit trois segments :
- le segment 1, court, rejoint le sillon atrioventriculaire antérieur entre la veine cave supérieure et le tronc pulmonaire ;
- le segment 2 parcourt verticalement le sillon atrioventriculaire antérieur jusqu’au bord inférieur du cœur, passe alors en avant et à gauche de la veine cave inférieure ;
- le segment 3 chemine sur la face postérieure le long du sillon atrioventriculaire postérieur où il se termine en artère interventriculaire postérieure et artère rétro-ventriculaire gauche. Elle vascularise ainsi l’atrium droit et une petite partie de l’atrium gauche, la face anterieure du ventricule droit et la partie adjacente du ventricule gauche, le septum inter-atrial, le 1/3 postérieur du septum interventriculaire, le noeud sinuatrial (dans 2/3 des cas), le noeud atrioventriculaire, le tronc du faisceau de His et une partie de la branche gauche du faisceau de His.
Artère coronaire gauche
L’artère coronaire gauche prend également son origine au niveau du sinus aortique (de Valsalva) en regard de la valvule semi-lunaire antéro-gauche. Elle possède un tronc court, souvent appelé tronc commun, qui passe derrière le tronc de l’artère pulmonaire, émerge entre ce dernier et l’auricule gauche puis chemine à droite de l’atrium gauche où il se divise en :
- artère interventriculaire antérieure qui descend dans le sillon interventriculaire antérieur avec la grande veine coronaire, contourne la pointe pour s’anastomoser avec l’artère interventriculaire postérieure.
- artère circonflexe qui passe en arrière du sillon atrioventriculaire pour rejoindre la croix des sillons, donnant entre autres l’artère marginale gauche. Elle vascularise ainsi la majorité de l’atrium gauche, la face postérieure du ventricule gauche et la partie adjacente du ventricule droit, les 2/3 antérieurs du septum interventriculaire, le nœud sinuatrial (dans 1/3 des cas), la branche droite du faisceau de His et une partie de la branche gauche du faisceau de His.
Veines du cœur
La majeure partie du sang veineux myocardique est collectée par la grande veine coronaire qui naît à la pointe du cœur, remonte dans le sillon interventriculaire antérieur puis contourne le bord gauche. La dilatation terminale de la grande veine coronaire, dénommée sinus coronaire, se jette dans la paroi inférieure de l’atrium droit.
Vaisseaux
Par définition, en se déplaçant dans le sens du flux sanguin, tous les vaisseaux qui quittent le cœur sont des artères et tous les vaisseaux qui y reviennent sont des veines. Les vaisseaux capillaires s’interposent entre les artères et les veines au sein des organes. Il existe également des vaisseaux lymphatiques qui drainent la lymphe et se jettent dans le système veineux.
Circulation systémique
Système artériel
Le système artériel de la circulation systémique est sous la dépendance de l’aorte qui naît à la base du ventricule gauche au niveau de l’ostium du tronc aortique (fig. 1.3 et 1.5). Elle donne peu après son émergence les artères coronaires droite et gauche au niveau du sinus aortique (de Valsalva). L’aorte thoracique ascendante suit ensuite un trajet ascendant dans le thorax, oblique en haut et à droite, puis réalise une crosse vers l’arrière à hauteur de T4 (arc aortique) en passant au-dessus du pédicule pulmonaire gauche. À ce niveau naissent le tronc artériel brachiocéphalique, l’artère carotide commune gauche et l’artère subclavière gauche, toutes artères destinées à la vascularisation du cou, de la face, du cerveau et des membres supérieurs. Puis l’aorte thoracique descend dans le médiastin postérieur, donnant des branches pariétales (artères intercostales) et viscérales (artère bronchique, phrénique supérieure) et traverse le hiatus aortique du diaphragme au niveau de T9. Elle devient alors l’aorte abdominale qui chemine en arrière dans l’abdomen jusqu’à sa division en ses branches terminales en L4 : les artères iliaques communes. L’aorte abdominale donne de nombreuses collatérales que l’on subdivise habituellement en trois groupes :
- les artères à destinée viscérale (pour le foie, le pancréas, la rate, le tube digestif) : le tronc cœliaque (en regard du disque T12-L1, qui donne trois branches, l’artère hépatique commune, l’artère gastrique gauche et l’artère splénique), l’artère mésentérique supérieure (en regard de L1) et l’artère mésentérique inférieure (en regard de L3) ;
- les artères à destinée pariétale (artère phrénique inférieure, artère d’Adamkiewicz qui vascularise la moelle spinale, artères lombales, etc.) ;
- les artères à destinée génito-urinaire : les artères rénales, les artères surrénaliennes moyennes et les artères génitales (testiculaire chez l’homme et ovarique chez la femme).
________________________________________________________________________________
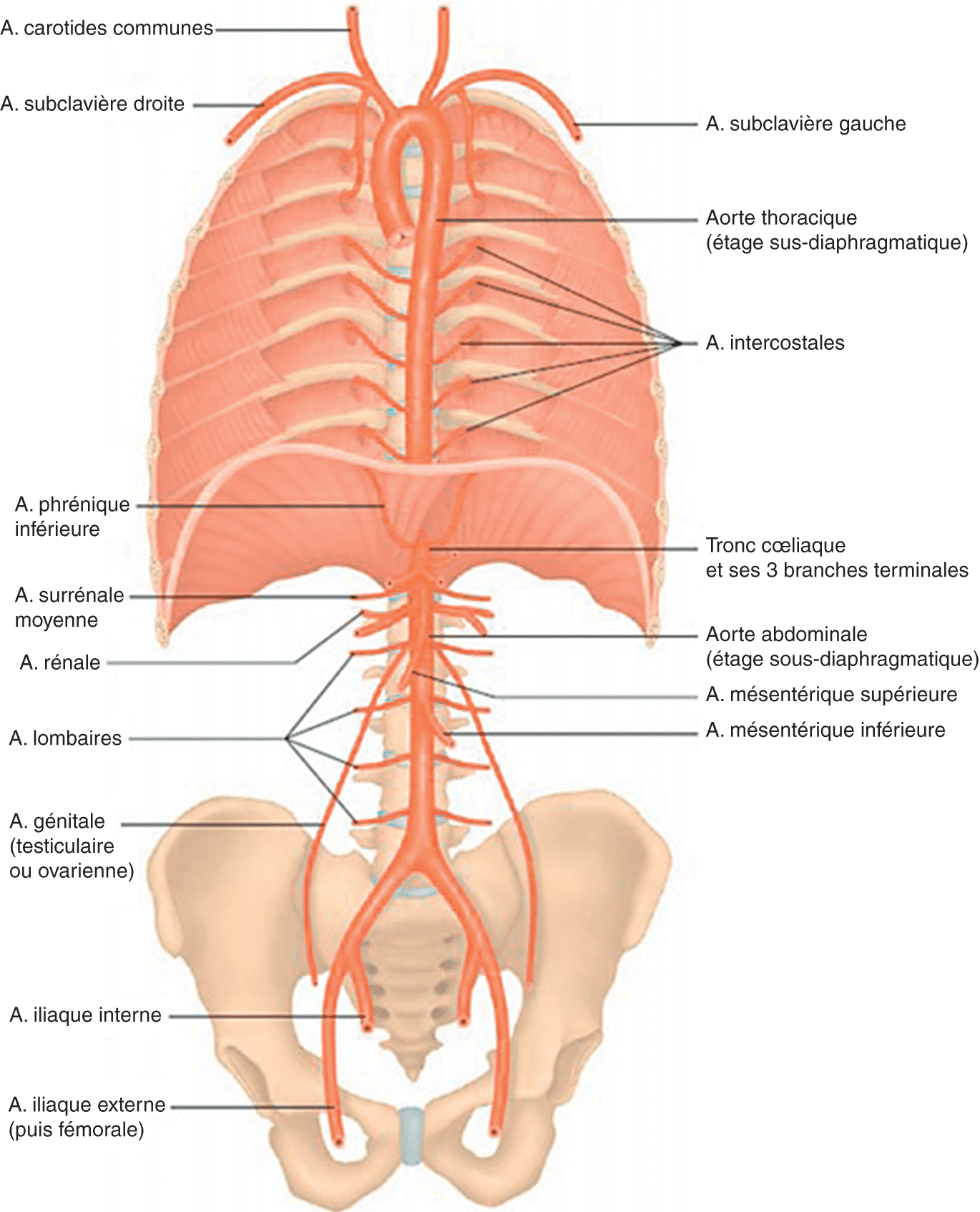
Figure 1.5.
Le système artériel de la circulation systémique est sous la dépendance de l’aorte.
Source : L’Anatomie et la physiologie pour les infirmier(e)s, 3e édition, S. Dupont. Dessin d’Eléonore Lamoglia.
________________________________________________________________________________
Chaque artère iliaque commune donne ensuite une artère iliaque interne (vascularisation du petit bassin) et externe (vascularisation du membre inférieur) :
- l’artère iliaque interne donne des branches viscérales (artères ombilicale, utérine, vésicale inférieure, vaginale, rectale moyenne et pudendale interne) et pariétales ;
- l’artère iliaque externe devient l’artère fémorale à partir du ligament inguinal. L’artère fémorale donne plusieurs branches dont l’artère profonde de la cuisse (ex-artère fémorale profonde) pour l’os fémoral et les muscles de la cuisse. Elle chemine dans la cuisse le long des adducteurs et devient l’artère poplitée dans la fosse poplitée. L’artère poplitée se divise ensuite en trois branches principales vascularisant le mollet et le pied : l’artère fibulaire, l’artère tibiale postérieure et l’artère tibiale antérieure qui se prolonge au niveau du coup du pied en artère pédieuse.
Le système artériel de la petite circulation est sous la dépendance de l’artère pulmonaire qui naît à la base du ventricule droit au niveau de l’ostium du tronc pulmonaire, présente un court trajet ascendant en avant de l’aorte thoracique ascendante, puis se divise à la hauteur de T5 sous l’arc aortique en une artère pulmonaire droite et une artère pulmonaire gauche qui pénètrent dans les poumons pour se ramifier jusqu’aux alvéoles pulmonaires.
Système veineux
Il existe, au niveau de la circulation systémique, trois systèmes veineux parallèles qui aboutissent tous in fine dans le système veineux cave qui se jette dans l’atrium droit :
- le système cave :
- supérieur : les veines jugulaire interne et subclavière (drainant le sang de la tête, du cou et des membres supérieurs) confluent pour former les troncs veineux brachiocéphaliques droit et gauche qui eux-mêmes se réunissent pour former la veine cave supérieure qui se jette dans l’atrium droit,
- inférieur : les veines iliaques internes (drainant le sang du petit bassin) et externes (drainant le sang des membres inférieurs) confluent pour former les veines iliaques primitives qui elles-mêmes se réunissent pour former la veine cave inférieure qui se jette dans l’atrium droit. Tout au long de son trajet, la veine cave inférieure reçoit des veines drainant les organes pelviens, abdominaux et thoraciques ;
- Le système porte : système veineux débutant et finissant par des capillaires. Le principal système porte se situe au niveau du tube digestif : il s’agit de la veine porte qui naît de la confluence des veines splénique, mésentériques supérieure et inférieure (drainant le sang des principaux viscères abdominaux). La veine porte arrive au foie dans lequel elle se ramifie jusqu’aux lobules hépatiques, apportant le sang du système digestif jusqu’aux hépatocytes. Puis ce sang est rejeté par les veines sus-hépatiques dans la veine cave inférieure. Il existe également un système porte rénal et hypophysaire ;
- Le système azygos : série de veines longitudinales drainant essentiellement le sang de la paroi thoracique, avec à droite la veine azygos et à gauche les veines hémiazygos et la veine hémiazygos accessoire, qui s’anastomosent entre elles et se jettent dans la veine cave supérieure.
Circulation pulmonaire
Le système artériel de la circulation pulmonaire est sous la dépendance de l’artère pulmonaire qui naît à la base du ventricule droit au niveau de l’ostium du tronc pulmonaire.
Le tronc pulmonaire se dirige en haut et en arrière et se divise rapidement en artère pulmonaire droite qui passe derrière l’aorte ascendante puis la veine cave supérieure, et en artère pulmonaire gauche qui rejoint le pédicule pulmonaire gauche.
Les veines pulmonaires sont les seules veines de l’organisme à transporter du sang saturé en oxygène. Elles naissent de la confluence des capillaires pulmonaires et se regroupent pour former quatre veines pulmonaires (supérieures et inférieures droites et gauches) qui quittent le poumon par le pédicule pulmonaire et se jettent dans l’atrium gauche.
Embryologie cardiaque
Première et deuxième semaines (J1 à J14)
Les spermatozoïdes arrivent au contact de la zone pellucide de l’ovocyte. La fusion des deux pronucléus mâle et femelle aboutit à la constitution du zygote fécondé : moment zéro du développement embryonnaire. Le zygote subit une succession de divisions, appelée segmentation, créant les blastomères inclus dans la zone pellucide. Cet ensemble de blastomères forme, vers J14, la morula, laquelle arrive dans la cavité utérine. Les cellules internes de la morula, formant un amas compact à un pôle de l’œuf, constituent l’embryoblaste. Les cellules externes, réparties en une couche unicellulaire, forment le trophoblaste. À ce stade, l’embryon est appelé blastocyste. Au pôle embryonnaire du blastocyste, le trophoblaste prolifère ; les cellules de l’embryoblaste se différencient entre J6 et J17 en deux couches, une externe appelée épiblaste et une interne appelée hypoblaste l’ensemble formant le disque embryonnaire didermique. Les cellules de ce disque sont à l’origine de l’embryon proprement dit.
Troisième semaine (J15 à J21)
Vers J15, la ligne primitive, établissant les axes fondamentaux de l’embryon (cranio-caudal, dorso-ventral et gauche-droite), apparaît à la partie médiane et caudale du disque embryonnaire didermique. À J16, des cellules épiblastiques migrent à travers cette ligne primitive. Ce phénomène de pénétration, appelé gastrulation, aboutit à la formation de l’endoderme et du mésoderme intra-embryonnaire. Les cellules précardiaques du mésoderme splanchnique antérieur migrent vers la partie crâniale et latérale de l’embryon et forment le croissant cardiaque composé des deux tubes cardiaques primitifs réunis par un pont antérieur, encore appelé premier champ cardiaque. Dès ce stade apparaît un second champ cardiaque qui se forme dans le mésoderme pharyngé, à la partie médiane et caudale du premier champ cardiaque. Les deux tubes endocardiques droit et gauche se rejoignent ensuite à la partie médiane et ventrale de l’embryon, formant le tube cardiaque primitif (fig. 1.6). Ce tube cardiaque est lié en arrière au mésoderme splanchnique par le mésocarde dorsal. Il est composé de deux couches cellulaires, le myocarde et l’endocarde, séparés par la matrice extracellulaire ou gelée cardiaque.
________________________________________________________________________________

Figure 1.6.
Formation de deux tubes endocardiques droit et gauche qui se rejoignent ensuite à la partie médiane et ventrale de l’embryon, formant le tube cardiaque primitif.
© Andru/Schleich
________________________________________________________________________________
Quatrième semaine (J22 à J28)
On sait maintenant que le tube cardiaque primitif ne contient pas tous les éléments qui constitueront le cœur définitif à quatre cavités. Le tube cardiaque primitif est composé des cellules du premier champ cardiaque et comporte une seule cavité qui donnera plus tard le ventricule gauche et une petite partie des oreillettes, un pôle veineux et un pôle artériel (fig. 1.6). Le tube cardiaque primitif ne sert donc que de charpente à partir de laquelle l’essentiel du cœur définitif se formera à partir des cellules du second champ cardiaque. À ce stade du développement apparaissent les premières contractions cardiaques permettant ainsi l’installation d’une véritable circulation sanguine (entre J22 et J24).
À J23, le tube cardiaque s’infléchit et se courbe sous forme d’une boucle à convexité dextroventrale, appelée D-loop, constituant ainsi la première manifestation de l’asymétrie gauche-droite chez l’embryon. Le phénomène de la boucle au sens large s’étend de J23 à J28, jusqu’à l’achèvement du stade de convergence (fig. 1.7). Ce positionnement est une étape primordiale en vue de la future morphologie cardiaque car il amène les futures cavités cardiaques dans leurs rapports mutuels corrects.
________________________________________________________________________________

Figure 1.7.
Boucle cardiaque ou D-Loop.
© Andru/Schleich
________________________________________________________________________________
Dans cette configuration (stade dit du early looping), l’oreillette primitive s’ouvre par le canal atrioventriculaire (CAV) uniquement dans le ventricule primitif (futur ventricule de morphologie gauche), alors que la voie d’éjection est située exclusivement au-dessus du futur ventricule droit.
Après l’étape de la boucle cardiaque, le processus de convergence permet l’alignement sur la ligne médiane de la voie d’éjection avec le ventricule primitif, le CAV et l’oreillette primitive.
Le passage de la boucle au stade de convergence est rendu possible par l’adjonction au tube cardiaque primitif des cellules myocardiques du second champ cardiaque qui vont former le futur ventricule de morphologie droite et participer à l’élongation du tube cardiaque primitif en assurant la formation des voies d’éjection et des oreillettes.
Deux autres populations cellulaires extracardiaques contribuent aussi à la formation du cœur : les cellules de la crête neurale et de l’épicarde. Leur rôle est déterminant dans le développement des arcs aortiques et des voies d’éjection ventriculaires.
L’addition des cellules du second champ cardiaque sur la voie d’éjection permet son élongation et sa rotation (wedging) antihoraire amenant la future valve aortique en bas, en arrière et à droite de la future valve pulmonaire.
Développement des oreillettes (fig. 1.8)
Vers J28, le cloisonnement de l’oreillette primitive débute à sa partie postérieure et haute par croissance vers l’avant et le bas du septum primum, laissant un orifice avant d’atteindre les bourgeons endocardiques du canal atrioventriculaire, l’ostium primum. Pendant la croissance du septum primum, une formation mésenchymateuse, dénommée épine vestibulaire, provenant du mésocarde dorsal situé dans le médiastin postérieur, progresse vers l’avant et vers la partie inférieure du cœur. L’ostium primum est ainsi fermé vers J34 par la fusion des éléments mésenchymateux issus de l’épine vestibulaire, du septum primum, et des bourgeons endocardiques du canal atrioventriculaire. Avant que l’ostium primum ne se ferme, la partie crâniale du septum primum se résorbe par un phénomène de mort cellulaire programmée, formant ainsi l’ostium secundum, encore appelé foramen ovale permettant toujours au sang de passer de l’oreillette droite vers l’oreillette gauche. Entre J36 et J42, à droite du septum primum, du toit de l’oreillette primitive, se développe, par un phénomène d’invagination, le septum secundum. Après la naissance, en raison de l’augmentation brutale de la pression intra-atriale gauche, le septum primum, ou valve de Vieussens, se plaquera sur la face gauche du septum secundum pour fermer le foramen ovale.
________________________________________________________________________________

Figure 1.8.
Cloisonnement des oreillettes.
Septum primum en jaune et épine vestibulaire en bleu. En blanc, fermeture de l’ostium primum et le septum ventriculaire membraneux.
© Andru/Schleich
________________________________________________________________________________
Développement des ventricules
Les ventricules se forment à partir du tube cardiaque primitif pour le ventricule gauche, et des cellules issues du second champ cardiaque antérieur pour le ventricule droit, par un processus de ballonisation de leur partie apicale. À J30, le septum musculaire ou trabéculé se développe à partir de l’anneau primitif vers le haut, laissant un espace, avant sa fusion avec les bourgeons endocardiques du canal, correspondant au foramen interventriculaire primitif. Le septum musculaire sépare ainsi les ventricules dans leurs portions apicale et d’admission.
Après le wedging ou formation de la voie d’éjection, la septation interventriculaire définitive se fera par la fermeture du foramen interventriculaire primitif à partir des bourgeons endocardiques supérieur et inférieur du canal atrioventriculaire, formant le septum membraneux.
Développement des valves et orifices atrioventriculaires
Initialement, le canal atrioventriculaire embryologique communique uniquement avec le ventricule gauche et le ventricule droit s’ouvre uniquement vers la voie d’éjection. Les ventricules communiquent entre eux par le foramen interventriculaire primitif. La première étape nécessaire au stade de convergence est donc l’établissement de la connexion atrioventriculaire droite, et du développement de la valve tricuspide. Ceci se produit par la formation d’une excavation apparaissant à la partie dorsale du myocarde de l’anneau primitif, entre la courbure interne et la partie droite du canal atrioventriculaire, appelée entonnoir tricuspidien.
Les feuillets des valves tricuspide et mitrale se forment à partir des bourgeons endocardiques du canal atrioventriculaire, par délamination à partir du myocarde des parois ventriculaires pour les feuillets septal et inférieur de la valve tricuspide et le feuillet mural de la valve mitrale, et par apoptose du myocarde de la paroi antérieure de l’entonnoir tricuspidien. Le feuillet antérieur de la mitrale se forme par fusion des bourgeons antérosupérieur et postéroinférieur du canal atrioventriculaire et n’a aucune origine musculaire. Les piliers se forment par compaction du myocarde trabéculé des ventricules, alors que les cordages proviennent, comme les feuillets valvulaires, des bourgeons endocardiques.
Développement des voies d’éjection
La voie d’éjection initiale est située entièrement au-dessus du ventricule droit. Le transfert de la future valve aortique au-dessus du ventricule gauche se produit pendant la phase de wedging, ou encastrement de la valve aortique entre mitrale et tricuspide. Pendant ce mouvement de rotation antihoraire, la partie proximale des bourgeons endocardiques de la voie d’éjection fusionne, formant ainsi le septum conal ou infundibulaire. Pendant la rotation de la valve aortique, le septum conal se déplace lui aussi vers la gauche et va s’aligner puis se fusionner avec la partie supérieure du septum interventriculaire, créant ainsi la voie d’éjection du ventricule gauche. Pendant ces déplacements, la partie gauche du conus se résorbe totalement, aboutissant à la continuité fibreuse mitroaortique. Seul persiste le conus en position sous-pulmonaire. Les feuillets valvulaires aortique et pulmonaire se développent à partir des bourgeons droit et gauche de la voie d’éjection et des bourgeons latéraux.
Ces processus embryologiques au niveau des voies d’éjection sont sous l’étroite dépendance des cellules de la crête neurale cardiaque qui se détachent des bords du tube neural lors de sa fermeture puis migrent à partir de J22 vers les arcs aortiques et les voies d’éjection cardiaque, et des cellules du second champ cardiaque antérieur. L’aorte et l’artère pulmonaire proviennent du sac aortique.
Développement du système cardionecteur
Le cœur est un des rares organes à fonctionner dès qu’il est constitué. Le tube cardiaque primitif contient au départ uniquement des myocytes à conduction lente. Puis apparaissent dans les oreillettes et les ventricules des myocytes à conduction rapide. Le nœud sinuatrial, formé de cellules myocardiques à conduction lente, apparaît à la jonction de la veine cave supérieure et de l’oreillette droite, puis apparaît le nœud atrioventriculaire à partir de l’anneau atrioventriculaire, anneau de tissu conjonctif servant d’isolant entre le myocarde à conduction rapide des oreillettes et celui des ventricules. Le nœud atrioventriculaire est lui aussi constitué de myocytes à conduction lente mais le faisceau de His qui lui fait suite et ses branches se forment à partir des myocytes à conduction rapide des ventricules.
La complexité des processus du développement cardiaque chez l’embryon explique la relative fréquence des malformations cardiaques congénitales, avec une incidence proche de 9 pour mille nouveau-nés. De nombreuses inconnues persistent quant aux mécanismes du développement impliqués dans l’embryogenèse, laissant ainsi un vaste domaine pour la recherche, notamment en biologie moléculaire et en génétique.
Histologie
Tuniques cardiaques
La paroi du cœur est composée de trois tuniques qui sont de l’intérieur vers l’extérieur l’endocarde, le myocarde et le péricarde (fig. 1.9). Cette organisation est commune à toutes les cavités cardiaques.
________________________________________________________________________________

Figure 1.9.
Histologie des tuniques cardiaques.
(A) L’endocarde (flèche) est constitué d’un endothélium qui repose sur une lame basale et d’une couche sous-endothéliale. Le myocarde est situé sous l’endocarde (HPS × 200). (B) L’endocarde est plus épais au sein des oreillettes, du fait d’une couche sous-endothéliale plus épaisse (HPS × 100). (C) Le myocarde comporte de nombreux cardiomyocytes contractiles (HPS × 200). (D) Les cardiomyocytes contractiles comportent un noyau central allongé (flèche) cerné de myofibrilles (HPS × 400).
________________________________________________________________________________
Endocarde
L’endocarde est la tunique la plus interne. Il tapisse les cavités cardiaques ainsi que les valves et les cordages. L’endocarde est plus épais dans les oreillettes que dans les ventricules. Il est composé d’un endothélium qui repose sur une lame basale et d’une couche sous-endothéliale. L’endothélium est en continuité avec celui des gros vaisseaux caves, pulmonaires et aortiques. La couche sous-endothéliale est constituée de fibres de collagène, de cellules musculaires lisses et de fibres élastiques. L’endocarde est séparé du myocarde par une couche sous-endocardique pouvant contenir des fibres de collagène, des fibres élastiques, des vaisseaux, des terminaisons nerveuses et du tissu adipeux. Dans les ventricules, la couche sous-endocardique contient les ramifications du tissu cardionecteur.
Au niveau des valves, le tissu conjonctif sous-endothélial devient très dense. Entre oreillettes et ventricules se trouve un anneau fibreux sur lequel s’arriment les contingents musculaires des parois des cavités cardiaques et qui assure un isolement électrique entre oreillettes et ventricules.
Myocarde
Il est composé de trois principaux types cellulaires : les cellules musculaires contractiles communément appelées cardiomyocytes, les cellules myoendocrines et les cellules cardionectrices disposées dans un tissu conjonctif riche en capillaires.
Cardiomyocytes contractiles
Les cardiomyocytes contractiles sont des cellules musculaires striées dont le noyau central est cerné de myofibrilles organisées en sarcomères et de mitochondries. L’extrémité de ces cellules présente des bifurcations, leur permettant de former un réseau avec les cardiomyocytes adjacents. Ces cellules sont unies par des dispositifs de jonction appelés stries scalariformes, permettant notamment la cohésion des cellules et la transmission de l’excitation d’une cellule à l’autre.
Cellules myoendocrines
Les cellules myoendocrines sont des cardiomyocytes qui ont une fonction endocrine. Pauvres en myofibrilles, elles synthétisent les peptides natriurétiques de type A et B participant à la régulation de la volémie (voir chapitre 2.1).
Cellules cardionectrices
Les cellules cardionectrices sont des cardiomyocytes modifiés qui constituent le système d’automatisme et de conduction du myocarde, ou système cardionecteur (alias tissu de conduction). Elles génèrent et conduisent l’influx électrique qui assure le rythme autonome du cœur ; elles sont spécialisées dans l’initiation de l’excitation (dépolarisation cellulaire) et dans la conduction de cette excitation (le potentiel d’action, voir chapitre 6). Elles se répartissent en quatre grandes structures : nœud sinuatrial, nœud atrioventriculaire, faisceau de His, réseau de Purkinje. Il existe deux types de cellules cardionectrices : les cellules nodales et les cellules de Purkinje.
Les cellules nodales se situent dans le nœud sinuatrial, le nœud atrioventriculaire et le tronc du faisceau de His. Elles sont de petite taille, riches en glycogène. Les cellules de Purkinje sont situées dans les branches du faisceau de His et dans le réseau de Purkinje. Ce sont des cellules beaucoup plus volumineuses que les cardiomyocytes contractiles. Leur cytoplasme est riche en glycogène et en mitochondries, pauvre en myofibrilles. La conduction du potentiel d’action s’y fait à une vitesse beaucoup plus élevée que dans les cardiomyocytes contractiles.
Péricarde
Il appartient au groupe des séreuses. Il est formé de deux feuillets, limitant une cavité quasiment virtuelle chez le sujet normal, permettant le glissement des feuillets l’un sur l’autre et autorisant les variations de volume du cœur.
L’épicarde tapisse l’extérieur du cœur et représente le feuillet viscéral du péricarde qui se réfléchit au niveau des gros troncs artériels pour se continuer par le feuillet pariétal (médiastinal) du péricarde. Il est constitué d’un mésothélium qui repose, par l’intermédiaire de sa lame basale, sur une couche sous-mésothéliale conjonctive comportant en particulier des fibres élastiques. L’épicarde reste séparé du myocarde par une couche sous-épicardique, où l’on observe une épaisse couche de tissu adipeux, des nerfs et les vaisseaux coronaires (artères et veines coronaires et leurs branches).
Histologie vasculaire
Structure générale des vaisseaux
Dans toutes les parties de l’arbre vasculaire, on distingue trois tuniques concentriques qui sont, de la lumière vers la périphérie : l’intima, la média et l’adventice.
Ces trois tuniques se retrouvent tout au long de l’arbre vasculaire, à l’exception des capillaires, où la structure est réduite à un endothélium, une lame basale et une fine couche de tissu conjonctif sous-endothélial.
Intima
L’intima est au contact du sang. Elle se compose d’un endothélium fait de cellules plus ou moins jointives reposant sur une lame basale et une couche sous-endothéliale constituée de tissu conjonctif et élastique. Sous l’effet du flux sanguin, l’endothélium génère du monoxyde d’azote (NO) favorisant la relaxation des cellules musculaires lisses sous-jacentes et est ainsi responsable d’un tonus vasodilatateur. L’endothélium génère d’autres substances à action vasodilatatrice telles que la prostacycline ou vasoconstrictrice comme l’endothéline. Il a également un rôle de transport, contrôlant le passage inter- et transcellulaire de nutriments, et pouvant exprimer des molécules d’adhérence conditionnant le passage des leucocytes dans l’intima. Il a, enfin, une fonction de barrière empêchant l’exposition de la couche sous-endothéliale, thrombogène, aux facteurs circulants de la coagulation.
Média
Elle est séparée de l’intima par une limitante élastique interne qui est constituée d’une seule lame élastique disposée concentriquement autour de la lumière. La média est constituée de cellules musculaires lisses et de tissu élastique. Sa composition en cellules musculaires lisses et fibres élastiques varie selon le type d’artères : élastiques ou musculaires (fig. 1.10).
________________________________________________________________________________

Figure 1.10.
Histologie de la paroi artérielle : artères élastiques et musculaires.
(A) Artère élastique à faible grossissement (HES × 25) : observation de trois tuniques concentriques qui sont de la lumière à la périphérie : l’intima, la média et l’adventice. (B) Une artère élastique se caractérise par une média riche en fibres élastiques disposées de façon concentrique (HES × 100). (C) Artère musculaire à faible grossissement (HES × 100), où l’on observe également l’intima, la média et l’adventice. D. Une artère musculaire se caractérise par une média constituée de nombreuses cellules musculaires lisses, avec une limitante élastique interne bien visible (flèche) (HES × 200).
________________________________________________________________________________
Adventice
C’est une structure essentiellement conjonctive, parfois séparée de la média par une limitante élastique externe de même structure que la limitante élastique interne.
Artères
Les artères sont des vaisseaux conduisant le sang du cœur jusqu’aux capillaires, avec un calibre qui décroît progressivement. Les artères de la circulation systémique contiennent du sang riche en oxygène, tandis que les artères pulmonaires contiennent du sang pauvre en oxygène.
Deux modes de terminaison des artères sont possibles :
- le mode terminal pour lequel chaque branche est indépendante de l’autre ;
- le mode anastomotique pour lequel les artères forment des connexions superficielles et profondes, ce qui permet une suppléance en cas d’occlusion d’une branche.
On distingue trois types d’artères, en partant du cœur : les artères élastiques, les artères musculaires et les artérioles.
Artères élastiques
Les artères élastiques correspondent aux plus gros vaisseaux (aorte, artères pulmonaires, carotides, subclavières). Leur rôle essentiel est, en amortissant la pulsatilité de l’éjection ventriculaire, de transformer le débit cardiaque discontinu en flux sanguin semi-continu. Leur média est riche en fibres élastiques, leur permettant d’absorber l’impulsion générée lors de l’éjection ventriculaire. Ce sont des vaisseaux de gros calibre, à lumière ronde. L’adventice des artères élastiques contient des vasa vasorum, petits vaisseaux vascularisant la paroi.
Artères musculaires
Les artères musculaires font suite aux artères élastiques. Elles jouent un rôle dans la distribution du sang aux différents territoires. Elles ont une capacité de contraction et de relaxation (vasomotricité) leur permettant d’adapter le débit aux besoins métaboliques de la région. Les artères musculaires ont un calibre moindre, une lumière arrondie et une paroi relativement épaisse par rapport à leur diamètre. Leur intima est fine et leur média plus ou moins épaisse selon le calibre. La limitante élastique interne est bien visible. La média est constituée d’une couche à orientation circulaire de cellules musculaires lisses entourées de quelques fibres collagènes et élastiques. L’adventice contient des vasa vasorum moins visibles que dans les artères élastiques.
Artérioles
Les artérioles sont les plus petits vaisseaux artériels, d’un diamètre inférieur à 100 μm. Leur structure histologique est simplifiée : l’intima comporte un endothélium reposant sur une fine couche de tissu conjonctif sous-endothélial, la média comporte quelques couches de cellules musculaires lisses, l’adventice est fine. Leur vasomotricité est importante. En raison de leur calibre, elles jouent un rôle important dans la valeur et la régulation de la pression artérielle.
Capillaires
Ce sont les vaisseaux les plus fins de l’organisme, dépourvus de média et de limitante élastique afin de faciliter les échanges entre le sang et le compartiment interstitiel. La transition entre artérioles et capillaires survient lorsque la média de l’artériole disparaît. Ils sont disposés en réseau enchevêtré au sein même des organes. Ils sont constitués d’un endothélium et d’une lame basale comportant des péricytes, cellules comportant de longs prolongements cytoplasmiques enveloppant les cellules endothéliales.
Il existe trois types de capillaires :
- les capillaires continus, présents dans la plupart des territoires de l’organisme ;
- les capillaires fenêtrés, présents dans des organes dans lesquels les échanges sont intenses (rein, intestin, glandes endocrines, etc.) ; la structure histologique est identique aux capillaires continus mais il existe dans l’épaisseur des cellules endothéliales des pores permettant ces échanges moléculaires ;
- les capillaires sinusoïdes, se rencontrant essentiellement dans le foie, la rate, les surrénales et la moelle osseuse. Ils sont formés de cellules endothéliales disjointes, avec une lame basale qui est inconstante, ce qui permet une communication directe entre le contenu des capillaires et les tissus.
Veines et veinules
Le sang des capillaires se draine d’abord vers les veinules postcapillaires, dépourvues de couche musculaire, qui donnent ensuite les veinules musculaires. Les veinules se rejoignent progressivement pour former des veines de calibre croissant. Les veines comportent de manière générale une lumière plus large et une paroi plus mince que les artères.
Comme les artères, leur structure histologique comprend les trois tuniques classiques :
- l’intima est formée d’un endothélium, d’une lame basale et d’un tissu conjonctif sous-endothélial ;
- la média comprend un mélange, en proportions variables, de cellules musculaires lisses, de fibres collagènes et de fibres élastiques ; la limitante élastique interne est discontinue ; la limitante élastique externe n’est généralement pas visible ;
- l’adventice est faite de tissu conjonctif pouvant contenir quelques faisceaux musculaires lisses à disposition longitudinale dans les plus grosses veines, qui contiennent aussi à ce niveau des vasa vasorum.
La structure histologique des veines est beaucoup plus variable que celle des artères.
La fonction essentielle des veines est d’assurer le retour du sang au cœur. Pour favoriser ce retour, elles comportent des valvules anti-reflux qui s’opposent au retour du sang en arrière.
Le drainage lymphatique
Il fonctionne de façon unidirectionnelle, drainant le liquide interstitiel des tissus pour l’évacuer vers la circulation sanguine. Il joue également un rôle important pour le système immunitaire, les vaisseaux lymphatiques transportant des antigènes et se jetant dans les ganglions lymphatiques disposés tout le long du système lymphatique. Le drainage lymphatique est présent partout sauf dans le système nerveux central, la moelle osseuse et l’oreille interne. La lymphe se déplace grâce aux pressions environnantes et avec l’aide de valves anti-reflux. On distingue classiquement les capillaires lymphatiques, les lymphatiques collecteurs et les gros troncs lymphatiques (le canal thoracique et le canal lymphatique droit).
Les capillaires lymphatiques s’anastomosent les uns avec les autres pour former un réseau lymphatique. Ils sont de plus grand calibre que les capillaires sanguins, constitués d’un fin endothélium continu avec une lame basale discontinue permettant un haut degré de perméabilité.
Les collecteurs lymphatiques comportent une intima constituée d’un endothélium et d’une lame basale reposant sur un fin réseau de fibres élastiques, une média comportant des fibres musculaires circonférentielles et une adventice représentant la couche la plus épaisse du vaisseau.
Les gros troncs lymphatiques ont une structure voisine de celles des veines, mais avec une média plus épaisse et une adventice aux contours moins bien définis, en continuité avec le tissu conjonctif péri-adventitiel.
Physiologie
Les circulations pulmonaire et systémique assurent avec le sang la fonction de transport et de distribution de l’oxygène et des nutriments à tous les organes, tissus et cellules de l’organisme. Elles le font en générant les pressions qui règnent dans chaque circulation et en assurant un débit de sang qui, compte tenu de l’organisation en série des deux circulations, est nécessairement le même dans chacune d’elles. Grâce à des mécanismes de régulation intrinsèques, c’est-à-dire propres au cœur et aux vaisseaux, et extrinsèques, essentiellement neurohormonaux, cœur et vaisseaux sont capables d’adapter leur débit global et les débits régionaux à la variabilité des besoins en oxygène et en nutriments des organes et tissus périphériques, notamment lors de l’exercice.
Cœur
Ce sont les ventricules qui assurent le débit régnant dans chacune des deux circulations. Ils le font de façon discontinue, pulsée, en raison du fonctionnement de leurs myocytes qui alternent une phase de contraction et une phase de relaxation. En effet, au niveau de chaque myocyte ventriculaire, la dépolarisation membranaire, phénomène électrique transitoire appelé potentiel d’action (PA, voir chapitre 6) qui provient de la dépolarisation spontanée des cellules du nœud sinuatrial par l’intermédiaire du tissu de conduction, est transformée en activité mécanique ou contraction grâce au mécanisme de couplage excitation-contraction (CEC, fig. 1.11) qui aboutit à une élévation brutale de la concentration de Ca2 + libre ([Ca2 +]i) à l’intérieur des cardiomyocytes.
________________________________________________________________________________

Figure 1.11.
Mécanismes moléculaires du couplage excitation-contraction et de la relaxation des cardiomyocytes.
La dépolarisation membranaire associée au potentiel d’action active un courant de Ca2 + (ICa-L) qui entre dans la cellule par les canaux calciques de type L (CCTL) situés sur la membrane des tubules-t. Ce courant est insuffisant pour déclencher la contraction. Mais il déclenche l’ouverture d’autres canaux calciques situés sur la membrane du réticulum sarcoplasmique (RS) appelés récepteurs de la ryanodine (RyR2), permettant la sortie, hors du RS, d’une grande quantité de Ca2 + qui va aller déclencher la contraction au niveau des sarcomères en se fixant sur la troponine c (voir légende de la figure 1.12). La relaxation est assurée principalement par une ATPase appelée SERCA2a qui repompe le Ca2 + dans le RS contre un gradient de concentration. SERCA est activée par la grande quantité de Ca2 + présente dans le cytoplasme à la suite du CEC. Le Ca2 + pompé dans le RS se fixe sur diverses protéines, dont la calséquestrine (CSQ), qui lui permettent de regagner la région des RyR afin d’être disponible pour la contraction suivante. Pendant ce pompage, RyR est maintenu fermé, grâce à l’action de protéines appelées FKBP (pour FK506 binding proteins). SERCA est régulée par le phospholamban (PLN) qui exerce sur elle un effet inhibiteur. Lors de la stimulation sympathique, sa phosphorylation lève cet effet inhibiteur, permettant d’accélérer la relaxation. Afin de maintenir l’homéostasie calcique du myocyte, le Ca2 + entré par les CCTL doit être expulsé hors de la cellule. Ceci se fait par l’échangeur Na+-Ca2 + (NCX) qui expulse un Ca2 + contre l’entrée de 3 Na+, ce qui génère un courant entrant dépolarisant (voir chapitre 6).
________________________________________________________________________________
Cette élévation permet, au niveau des sarcomères, l’interaction entre le filament épais constitué principalement de myosine et le filament fin d’actine et, ainsi, le raccourcissement des sarcomères responsables de la contraction du cardiomyocyte (fig. 1.12). La phase de contraction des myocytes est rapidement suivie d’une phase de relaxation contemporaine du retour du PA à sa valeur de repos. Elle est due principalement à l’activité de la Ca2 +-ATPase du réticulum sarcoplasmique (appelée SERCA pour sarcoplasmic endoplasmic reticulum calcium ATPase) qui repompe le Ca2 + dans le RS, complétée par celle de l’échangeur Na+– Ca2 + qui expulse un ion Ca2 + hors de la cellule en échange de l’entrée de trois ions Na+ afin de maintenir l’homéostasie cellulaire du Ca2 +. Les contractions et les relaxations de chaque myocyte, à peu près simultanées en raison du caractère syncitial du myocarde (connexion électrique de tous les myocytes ventriculaires), s’additionnent au niveau du myocarde pour générer la contraction et la relaxation des ventricules, correspondant respectivement à la systole et à la diastole physiologique.
________________________________________________________________________________

Figure 1.12.
Photographie en microscopie électronique (en bas) et représentation schématique (en haut) d’un sarcomère, unité élémentaire des myofibrilles comprise entre deux lignes Z.
La bande I, centrée par la ligne Z, est constituée essentiellement des filaments fins de deux sarcomères adjacents qui s’ancrent dans la ligne Z. La bande A, au centre du sarcomère, est constituée de la superposition des filaments fins et épais. En son centre, une zone plus claire, la bande H, qui ne comporte plus de filaments fins. En son centre, une zone plus sombre, la bande M. Le Ca2 + libéré par le RS lors du CEC se fixe sur la troponine c ancrée sur le filament fin. Ceci permet un basculement des troponines qui libère l’espace entre filaments fins et épais, permettant ainsi leur interaction et le raccourcissement des sarcomères. La titine, en mauve, s’ancre d’un côté dans la ligne Z et de l’autre dans le filament épais. Entre les deux, elle est libre et présente une élasticité.
Modifié de Pajak and Orzechowski. Importance of plasma membrane nanodomains in skeletal muscle regeneration. https://doi.org/10.5772/60615
________________________________________________________________________________
Cycle cardiaque
Le début et la fin de la systole et de la diastole physiologiques pouvant être difficiles à identifier, il est préférable d’y substituer la définition clinique qui est plus précise : la systole commence par le premier bruit du cœur (B1) généré par la fermeture des valves atrioventriculaires et se termine avec le second bruit du cœur (B2) généré par la fermeture des valves sigmoïdes aortique et pulmonaire. Ainsi, la diastole commence avec B2 et se termine avec B1. La succession de sa systole et de la diastole réalise un cycle cardiaque décrit en détail dans la figure 1.13. Au repos, la systole est beaucoup plus courte que la diastole (300-350 msec vs 650-700 msec pour une FC de 60/min).
________________________________________________________________________________

Figure 1.13.
Cycle cardiaque représenté en fonction du temps.
De bas en haut : systole et diastole sont définies par les bruits du cœur B1 et B2 : la systole est l’intervalle entre B1 et B2, la diastole l’intervalle entre B2 et B1. Les différentes phases du cycle : 1 = contraction isovolumique, 2 = éjection, 3 = relaxation isovolumique, 4 = remplissage rapide marqué par le creux y sur la courbe de pression ventriculaire, 5 = diastasis, 6 = contraction atriale marquée par l’onde a. Le volume ventriculaire est maximal après la contraction des oreillettes et pendant la contraction isovolumique. Il est minimal à la fin de l’éjection et pendant la relaxation isovolumique. Les pressions aortiques et ventriculaires se rejoignent au moment de l’ouverture des valves sigmoïdes et se séparent lors de leur fermeture. La contraction des ventricules entraîne la fermeture des valves atrioventriculaires. La relaxation débute avec le pic de pression et se poursuit pendant la diastole.
________________________________________________________________________________
Systole
La contraction du myocarde entraîne une déformation des ventricules avec, au niveau du ventricule gauche, une rotation horaire de la base, associée à une rotation antihoraire de la pointe. Cette contraction entraîne la fermeture des valves atrioventriculaires alors que les valves sigmoïdes ne sont pas encore ouvertes. Il en résulte une contraction dite isovolumique car le volume des ventricules est constant. Pendant cette phase, la pression dans les ventricules s’élève rapidement pour atteindre la pression régnant dans l’aorte et dans l’artère pulmonaire en fin de diastole. Le dépassement de cette pression entraîne l’ouverture des valves sigmoïdes, ce qui marque le début de la phase d’éjection. Pendant cette phase durant laquelle les ventricules éjectent un volume de sang appelé volume d’éjection systolique (VES), les pressions dans les ventricules et les artères correspondantes sont à peu près identiques. Elles passent par un maximum puis décroissent rapidement en raison du début de la relaxation des ventricules. Quand la pression dans les ventricules, qui baisse très vite, devient inférieure à la pression dans les artères qui diminue moins vite, les valves sigmoïdes se ferment, fermeture responsable du deuxième bruit du cœur (B2). À ce moment, les ventricules contiennent le plus petit volume de sang de tout le cycle cardiaque appelé volume télésystolique ou VTS.
Diastole
B2 qui marque le début de la diastole, marque aussi le début de la phase de relaxation isovolumique des ventricules pendant laquelle leur pression décroît rapidement tandis que leur volume ne change pas puisque les valves sigmoïdes sont fermées alors que les valves atrioventriculaires ne sont pas encore ouvertes. Au niveau des courbes de pressions artérielles, B2 est suivi de l’incisure catacrote, elle-même suivie de l’onde dicrote liée au retour de l’onde de pouls qui parcourt l’aorte et les grosses artères et qui participe à la fermeture des valves sigmoïdes (voir plus loin). Quand la pression dans les ventricules devient inférieure à celle qui règne dans les oreillettes, les valves atrioventriculaires s’ouvrent ce qui marque le début de la phase de remplissage rapide des ventricules. Pendant cette phase très brève, la pression dans les ventricules atteint son minimum (voir fig.1.13, creux y) puis remonte rapidement en raison de l’important volume de sang qui passe des oreillettes dans les ventricules (70 % à 80 % de ce volume). Y fait suite une phase assez longue appelée diastasis pendant laquelle les volumes et les pressions augmentent peu. Enfin, la diastole se termine par la contraction des oreillettes (voir fig. 1.13, onde a) dont la fonction est de compléter le remplissage des ventricules des derniers 10 à 20 % du retour veineux. À ce moment, les ventricules contiennent le plus grand volume de sang de tout le cycle cardiaque appelé volume télédiastolique (VTD).
Boucle pression-volume
Une autre manière de décrire le cycle cardiaque consiste à le représenter dans un schéma dans lequel le volume ventriculaire figure en abscisse et les pressions correspondantes en ordonnée (fig. 1.14).
________________________________________________________________________________

Figure 1.14.
Cycle cardiaque représenté sous forme de boucle pression-volume.
Le cycle du VG peut être décrit dans un diagramme ou le volume figure en abscisse et la pression en ordonnée, comme une boucle de rotation antihoraire : en partant de l’ouverture de la valve mitrale à la fin de la relaxation isovolumique (VTS), le VG se remplit rapidement (remplissage rapide), puis plus lentement (diastasis puis contraction de l’oreillette), ce qui fait augmenter la pression intra-VG jusqu’à la fermeture de la mitrale, suivie de la phase de contraction isovolumique pendant laquelle la pression intra-VG augmente sans que son volume ne change. L’ouverture de la valve aortique marque le début de l’éjection qui se termine avec la fermeture de la valvule aortique par le point télésystolique, suivie de la relaxation isovolumique jusqu’à l’ouverture de la valve mitrale.
________________________________________________________________________________
En partant de l’ouverture des valves atrioventriculaires en bas à gauche et en tournant dans le sens inverse des aiguilles d’une montre, on observe, pendant la diastole, une augmentation progressive du volume et de la pression ventriculaire liée à leur remplissage progressif qui fait se succéder remplissage rapide, diastasis et contraction des oreillettes. La fin du remplissage est marquée par la fermeture des valves atrioventriculaires secondaire à la contraction des ventricules. Y fait suite la phase de contraction isovolumique pendant laquelle les pressions ventriculaires s’élèvent rapidement tandis que les volumes ventriculaires ne changent pas. Quand la pression dans les ventricules atteint celle qui règne dans les artères, les valves sigmoïdes s’ouvrent ce qui marque le début de la phase d’éjection pendant laquelle les ventricules éjectent le VES jusqu’à la fermeture des valves sigmoïdes. Cette fermeture marque le début de la phase de relaxation isovolumique pendant laquelle la pression dans les ventricules diminue rapidement tandis que leur volume ne change pas. Cette représentation offre deux avantages. Le premier est de montrer clairement la relation qui existe entre le volume des ventricules et la pression qui y règne pendant leur remplissage et d’accéder ainsi aux notions de compliance et de rigidité passive des ventricules qui jouent un rôle important dans la qualité du remplissage (fig. 1.15). Le second est de permettre une estimation de la performance contractile des ventricules à partir de leur rigidité active (voir plus loin, Contractilité ou Inotropie).
________________________________________________________________________________

Figure 1.15.
Propriétés passives des ventricules : compliance et rigidité.
Cette figure détaille les notions de compliance et de rigidité en repartant de la phase de remplissage de la figure 14. Il s’agit ici d’un ventricule virtuel normal (courbe bleue) et d’un ventricule virtuel pathologique (courbe marron). Si l’on poursuit le remplissage du ventricule normal au-delà de 10 mmHg avec un volume ΔV1, la pression augmente d’une valeur ΔP jusqu’à 30 mmHg. Si l’on fait la même chose avec le VG pathologique, on voit qu’un volume plus petit, ΔV2, est nécessaire pour atteindre 30 mmHg. ΔV1/ΔP est plus grand que ΔV2/ΔP. Ainsi, le ventricule normal est-il plus compliant (moins rigide) que le ventricule pathologique. Le même raisonnement s’applique aux vaisseaux.
________________________________________________________________________________
Volumes ventriculaires, fraction d’éjection, fonction systolique, fonction diastolique, débit et index cardiaque
Chez un individu de taille et de corpulence moyenne au repos, le VTD est d’environ 110 ml et le VTS d’environ 40 ml. Le volume de sang éjecté par les ventricules à chaque systole, (VES), qui est par définition la différence entre le VTD et le VTS, est donc d’environ 70 ml. En multipliant le VES par le nombre de battements cardiaques par minute (bpm) ou fréquence cardiaque (FC), on obtient par définition le débit cardiaque soit Qc = VES × FC = 70 ml × 70 bpm ≈ 5 L/min environ. Il se distribue aux divers organes et tissus comme indiqué dans le tableau 1.1 ci-dessous.
Tableau 1.1.
Distribution du débit cardiaque aux différents organes et tissus
| Distribution du débit cardiaque aux différents organes et tissus (au repos) | Débit
(mL/min) |
%
du débit total |
| Myocarde (via les artères coronaires) | 250 | 5 |
| Muscles du squelette | 850 | 16 |
| Cerveau | 750 | 15 |
| Peau | 450 | 8 |
| Rein | 1 200 | 22 |
| Circulation hépato-splanchnique | 1 500 | 28 |
| Reste | 350 | 6 |
| Total | ≈ 5 000 | 100 |
Fraction d’éjection et fonction systolique
La fraction d’éjection (FE) est le rapport entre le VES et le VTD (FE = VES/VTD). Elle représente la proportion du volume télédiastolique du ventricule que celui-ci est capable d’éjecter à chaque systole ce qui, de manière intuitive, est une estimation de sa performance. De fait, la FE représente en première approximation la performance systolique (fonction systolique) des ventricules. Sa valeur normale est d’environ 65 % pour le ventricule gauche et de 45 % pour le ventricule droit. Sa diminution permet de suivre la dégradation de la fonction systolique des ventricules au cours des cardiopathies (voir chapitre 5).
Fonction diastolique
Il n’existe pas d’index directement basé sur les volumes permettant d’évaluer la performance diastolique des ventricules, c’est-à-dire la qualité de leur remplissage. Un remplissage insuffisant en fin de diastole se traduira par une pression télédiastolique du ventricule gauche (PTDVG) anormalement basse tandis qu’une élévation anormale de cette valeur traduira une dysfonction cardiaque. En fait, la qualité du remplissage (fonction diastolique) des ventricules doit s’apprécier en fonction de chacune de ses trois phases (fig. 1.13) qui sont accessibles notamment à l’écho-Doppler cardiaque (voir chapitre 4).
Remplissage rapide
Le remplissage rapide dépend de la qualité de la relaxation qui dépend elle-même de l’activité de SERCA – et donc de la quantité d’ATP disponible – et de facteurs mécaniques (décompression des éléments élastiques en parallèle des sarcomères constitués essentiellement par la titine comprimés pendant la systole, détorsion des ventricules, remplissage avec turgescence des artères coronaires en protodiastole (voir chapitre 3), l’ensemble créant un phénomène d’aspiration du sang contenu dans les oreillettes par les ventricules). La qualité de la relaxation peut s’apprécier en mesurant la vitesse maximale de décroissance de la pression (dP/dtmin) qui survient pendant la phase de relaxation isovolumique, ou en calculant la constante de temps de cette décroissance qui est exponentielle.
Diastasis
À la suite de l’irruption du sang dans les ventricules, le phénomène d’aspiration cesse rapidement et les pressions remontent très vite. Ce sont alors les propriétés passives des ventricules estimées par leur compliance et son inverse, leur rigidité, qui déterminent la suite du remplissage (fig. 1.15).
Contraction des oreillettes
La contraction des oreillettes vient parfaire le remplissage en injectant dans les ventricules les derniers millilitres (environ 10 à 20 % du retour veineux) qui sont néanmoins nécessaires pour observer une bonne précharge (voir plus loin).
Débit et index cardiaqueLes volumes, et donc le débit cardiaque, varient avec la taille et la corpulence des individus. Afin de déterminer si ces volumes et débits sont normaux ou s’éloignent de la normale chez un individu donné, il convient de les normaliser (i.e. diviser ou encore indexer) par un élément qui prend en compte ces différences. Il a été choisi par convention de les normaliser par la surface corporelle de l’individu. Les volumes indexés sont ainsi exprimés en ml/m2 et le débit cardiaque indexé, appelé index cardiaque, en ml/min/m2. Sa valeur est d’environ 3,5 l/min/m2.
Avant l’essor de l’échographie, l’évaluation des volumes et des performances cardiaques se faisait à l’occasion d’un cathétérisme cardiaque permettant à la fois la visualisation des cavités cardiaques tout au long du cycle suite à l’injection de produit de contraste et la mesure simultanée des pressions intracardiaques permettant le calcul de leurs dérivées en fonction du temps (dP/dt) et celui des contraintes (voir plus loin). Le débit cardiaque pouvait aussi être évalué en mesurant la consommation d’oxygène du sujet et sa gazométrie sanguine (méthode de Fick) ou à l’aide d’un indicateur injecté dans le sang, le plus souvent un bolus de sérum physiologique glacé (méthode dite de thermodilution encore utilisée en soins intensifs).
Ces techniques invasives et lourdes à mettre en œuvre ont été supplantées à partir du début des années 1980 par l’écho-Doppler cardiaque qui permet d’estimer les volumes cardiaques, les débits, les performances systoliques et diastoliques et même certaines pressions intracardiaques (voir chapitre 4, « Examens complémentaires »). Ceci se fait au prix d’un certain degré d’imprécision dans les mesures, inhérent aux technologies utilisées, et d’hypothèses hémodynamiques pas toujours vérifiées, ce qui doit conduire à une grande prudence dans l’interprétation des résultats. L’imagerie par résonance magnétique nucléaire (IRM) est actuellement en plein essor pour apprécier la structure et la fonction du cœur et des vaisseaux et est complémentaire de l’écho-Doppler cardiaque avec une précision des mesures inhérente à la technologie utilisée. Cependant, sa disponibilité est moins grande.
La morphologie et la géométrie sont l’apanage de l’IRM et du scanner cardiaque (imagerie en coupes). L’échocardiographie Doppler est plus précise pour la détermination de l’hémodynamique intracardiaque (pressions, débits, gradients…)
Relation entre débit cardiaque et pression artérielle
En première approximation, on peut dire que la pression qui règne dans les grosses artères est la résultante de l’effet combiné de la contraction des ventricules qui pousse le sang dans les vaisseaux, soit le débit cardiaque, et des résistances vasculaires qui s’y opposent. Ceci s’écrit mathématiquement selon une formule simple qui ressemble à la loi d’Ohm (U = IR) appelée loi de Darcy : ΔP = Qc × RAS pour les résistances artérielles systémiques et ΔP = Qc × RAP pour les résistances artérielles pulmonaires où Qc représente le débit cardiaque et ΔP représente la différence de pression, encore appelée gradient de pression, qui existe de part et d’autre des résistances vasculaires (ΔP = P artérielle – P veineuse). Cette formule indique que ΔP est égale au produit du débit du sang qui passe à travers ces résistances, multiplié par la valeur de ces résistances. Comme le débit cardiaque pendant un temps donné est le même au niveau de l’aorte et de l’artère pulmonaire, on voit que ce sont surtout les résistances vasculaires qui sont à l’origine de la différence des pressions qui règnent dans la grande et la petite circulation : élevées au niveau de la circulation systémique, beaucoup plus basses au niveau de la circulation pulmonaire. En pratique, les pressions veineuses étant très basses par rapport aux pressions artérielles correspondantes, on les néglige ce qui revient à remplacer ΔP par les pressions artérielles systémique et pulmonaire. Cependant, compte tenu de leur variabilité au cours du cycle cardiaque, elles doivent être moyennées. Si l’on dispose d’un enregistrement intra-artériel des pressions, comme c’est le plus souvent le cas dans les unités de soins intensifs, le système électronique qui permet le report de la courbe de pression sur un écran donne également la valeur de la pression artérielle moyenne à partir de la mesure de l’aire sous la courbe de pression au cours du temps. En son absence, on peut utiliser la formule de Burton qui reste néanmoins une approximation : PA moyenne = PA diastolique + (PA systolique – PA diastolique)/3.
Adaptation du débit cardiaque, régulation de la pression artérielle systémique
La finalité du système cardiovasculaire étant d’apporter à tous les organes et tissus l’oxygène et les nutriments nécessaires à leur bon fonctionnement en toutes circonstances, c’est-à-dire au repos comme lors de l’effort, le débit cardiaque doit pouvoir s’adapter à la variabilité des besoins. Il peut ainsi varier schématiquement de 5 à 20 L/min, voire plus. Mais la bonne perfusion des tissus et des organes nécessite également une pression artérielle suffisante qui doit ainsi être « contrôlée ». C’est pourquoi le débit cardiaque s’adapte aux besoins tandis que la pression artérielle systémique est régulée pour ne pas s’éloigner de la valeur normale permettant une bonne perfusion tissulaire appelée valeur cible. La régulation de la pression artérielle est détaillée chapitre 2.1.
Adaptation du débit cardiaque
Le débit cardiaque Qc s’adapte aux besoins de l’organisme grâce à la variabilité de ses deux composantes, grande pour ce qui concerne la fréquence cardiaque (FC), moindre pour ce qui concerne le VES. La FC est sous la dépendance d’un double tonus : parasympathique ralentisseur et sympathique accélérateur par modulation de l’activité des cellules du nœud sinuatrial (voir chapitre 2.1 « Baroréflexe » et chapitre 6). Au repos, l’effet du système parasympathique prédomine, responsable d’une FC de 60-70 bpm, tandis qu’à 37 °C, un cœur dénervé bat à 100-110/min. Quant au VES, il dépend schématiquement de trois facteurs :
Précharge
C’est la pression qui règne dans les ventricules en fin de diastole (pression télédiastolique du ventricule gauche, PTDVG) et qui dépend : (i) de la quantité de sang revenue vers ces derniers par les veines caves et pulmonaires, appelée retour veineux ; et (ii) de caractéristiques propres aux ventricules (compliance et son inverse rigidité, voir fig. 1.15). Dans certaines limites, plus la quantité de sang qui revient aux ventricules est importante donc plus la PTDVG est élevée, plus la contraction des ventricules est puissante et plus le VES est grand (Loi de Frank-Starling).
Postcharge
On la décrit classiquement comme tout ce qui s’oppose à l’éjection du VES par les ventricules : en première approximation, c’est la pression qui règne dans la racine de l’aorte au moment de l’ouverture de la valve aortique puis au cours de l’éjection. Cette pression dépend bien entendu de la valeur des résistances vasculaires, mais également de la plus ou moins grande rigidité des gros troncs artériels, rigidité qui augmente avec le vieillissement. Plus précisément, c’est la charge supportée par le myocarde pendant qu’il se contracte, exactement équivalente à la force qu’il développe. Cette charge prend en compte, non seulement la pression qui règne dans le ventricule mais aussi ses dimensions et son épaisseur (voir plus loin, loi de Laplace). Une diminution de la postcharge secondaire, par exemple, à l’administration d’une substance vasodilatatrice qui diminue les résistances vasculaires, entraîne une augmentation du VES et inversement.
Contractilité ou inotropie
Ce terme définit le niveau de la performance contractile inhérente aux ventricules, c’est-à-dire qui ne dépend ni de la précharge ni de la postcharge. Par exemple, la stimulation sympathique, qui au niveau des myocytes aboutit à une augmentation du couplage excitation-contraction avec davantage de Ca2 + disponible pour les myofibrilles, exerce un effet inotrope positif sur les ventricules, c’est-à-dire qu’elle augmente le VES sans que cette augmentation soit le fait d’une augmentation de la précharge (Loi de Frank-Starling) ou d’une baisse de la postcharge. Inversement, certains médicaments qui diminuent la disponibilité du Ca2 + dans les cardiomyocytes diminuent le VES en diminuant la contractilité du myocarde. L’évaluation de la contractilité du myocarde in vivo est complexe. À l’époque du cathétérisme cardiaque (voir supra), la dérivée de la montée en pression du VG par rapport au temps (dP/dt) permettait d’accéder à sa valeur maximale ou pic (dP/dtmax), paramètre témoignant de la performance contractile du myocarde néanmoins sensible aux variations de conditions de charge. Un index plus fiable est la pente de la relation qui lie la pression télésystolique (PTS) au volume télésystolique (VTS) en fonction des variations de pré- ou de postcharge (fig. 1.16). En effet, au point télésystolique, le ventricule présente un degré de rigidité dite active – par rapport à la rigidité passive estimée pendant la phase de remplissage – qui témoigne du degré « d’activation » des myofibrilles par le Ca2 + ce qui caractérise précisément l’état contractile. En faisant varier la pré- ou la postcharge, le point télésystolique décrit une relation à peu près linéaire dont la pente – appelée élastance (= rigidité) télésystolique – est caractéristique d’un niveau de contractilité donné. En effet, elle ne varie pas avec la modification des conditions de charge alors qu’elle augmente lors d’une intervention inotrope positive et inversement.
________________________________________________________________________________

Figure 1.16.
Boucle pression-volume : modifications observées lors de variations des conditions de charge et de contractilité du ventricule.
À l’occasion d’une brusque augmentation de la précharge comme peut le faire la perfusion rapide d’un produit de remplissage vasculaire, la boucle PV est déplacée en haut et à droite (boucle verte, 2) avec une augmentation du volume et de la pression télédiastolique du VG. Selon la loi de Frank-Starling, la contraction du VG est alors plus forte et le VES est plus grand, avec un déplacement en haut et à droite du point télésystolique. Au bout d’un moment, une partie du produit de remplissage est passée dans la circulation à haute pression, avec pour conséquence une baisse du volume télédiastolique (VTD3) et un déplacement en haut et à droite du point télésystolique du fait de l’augmentation de la postcharge (boucle orange, 3). À l’occasion de ces variations de précharge les points télésystoliques décrivent une droite appelée relation PTS-VTS (encore appelée droite d’élastance télésystolique) dont la pente est caractéristique d’un niveau de contractilité donné du ventricule. Pour une même pré- et postcharge, l’adjonction d’un agent inotrope positif (I +) augmente la force de la contraction du VG, donc le VES, avec un point télésystolique déplacé en haut et à gauche (boucle 4).
________________________________________________________________________________
Sur le plan biologique, la véritable charge n’est pas la pression qui règne dans les ventricules pendant leur remplissage (précharge) ou la phase d’éjection (postcharge) mais c’est la tension passive en diastole ou active en systole respectivement ressentie ou développée par la paroi du ventricule (le myocarde) et les cardiomyocytes qui la composent. Cette tension appelée contraintepeut être approchée par la loi de Laplace qui, pour une sphère, indique qu’elle est proportionnelle au produit de la pression qui règne dans la cavité à un instant t, multipliée par le rayon r de la cavité, divisé par l’épaisseur de la paroi au même instant, soit : σ = k.P.r/e
Cette formule met clairement en évidence le rôle joué par les pressions dans la charge du VG, du myocarde et finalement des cardiomyocytes tant en systole qu’en diastole, mais aussi le rôle joué par les dimensions du ventricule et l’épaisseur de sa paroi. Ainsi, pour une pression et une épaisseur de parois données, plus le VG est dilaté, plus ses pré- et postcharge sont élevées. Cette formule permet aussi de comprendre les mécanismes d’adaptation du VG et notamment l’augmentation de son épaisseur lors des augmentations chroniques de pré- et de postcharge puisque l’augmentation de l’épaisseur « e » au dénominateur permet, en compensant l’augmentation de la pression « P » et/ou du rayon « r » au numérateur, de normaliser la contrainte « σ » (voir chapitre 4 et 5).
Adaptation cardiaque à l’exercice
Dans son rôle de transport et de distribution de l’oxygène et des nutriments aux différents tissus et organes, la circulation doit pouvoir s’adapter à la variabilité de leurs besoins, c’est-à-dire avant tout, en conditions physiologiques, à l’effort (appelé exercice par les physiologistes). Cette adaptation se fait par la modulation des deux paramètres dont le produit définit le débit cardiaque : la FC et le VES. Lors de l’effort, la FC peut être multipliée environ par trois (la FC maximale théorique est classiquement de 220 – l’âge). Cette augmentation est le fait d’une levée initiale du tonus parasympathique bradycardisant sur le nœud sinuatrial puis, rapidement, d’une augmentation du tonus sympathique. L’augmentation du VES est nettement moindre : + 40-50 % environ. Elle est le fait de l’augmentation du retour veineux qui augmente la précharge des ventricules et ainsi la force de leur contraction selon la loi de Frank-Starling, et de la stimulation sympathique qui augmente la contractilité du myocarde (effet inotrope positif). À la fin de l’effort, il existe un retour du tonus parasympathique qui peut être brutal et responsable d’une lipothymie voire d’une syncope vagale (voir chapitre 6).
Circulation systémique
La circulation systémique comporte des artères, des capillaires, des veines et des lymphatiques. Elle se décompose en :
- un système de distribution : l’aorte et ses ramifications, les grosses artères ;
- un système à résistance variable : les artérioles et les sphincters précapillaires ;
- un système d’échanges formé par les capillaires ;
- un système collecteur : les veines.
Artères
Généralités
Le secteur artériel débute à la sortie du VG, au niveau de la valve sigmoïde aortique, par l’aorte thoracique ascendante. En raison des pressions élevées qui y règnent, l’ensemble des artères systémiques jusqu’aux artérioles est appelé système à haute pression. L’aorte et les grosses artères sont relativement pauvres en cellules musculaires lisses mais riches en fibres élastiques ce qui leur assure une relative compliance. Ceci permet un certain degré d’expansion de ces artères pendant la systole et ainsi le stockage d’une partie du VES qui est restitué pendant la diastole (effet windkessel), mécanisme amortissant la pulsatilité de l’éjection du VES et limitant ainsi la pression et favorisant un débit relativement continu au niveau capillaire (fig. 1.17).
________________________________________________________________________________

Figure 1.17.
Effet windkessel.
Grâce à leur relative compliance, l’aorte et les grosses artères se distendent lors de l’éjection du VES par le ventricule, ce qui leur permet d’accumuler une partie de ce VES (schéma du haut) qui est restituée lors de la diastole lorsque les artères reviennent à leur volume initial (schéma du bas). Ce phénomène permet un relatif amortissement de l’onde systolique et un écoulement quasi-continu du sang au niveau capillaire. Lors du vieillissement, aorte et grosses artères perdent de leur compliance (= deviennent plus rigides), ce qui diminue l’effet windkessel. Cette augmentation de rigidité augmente la postcharge du ventricule et la PA systolique.
________________________________________________________________________________
Ainsi, à chaque systole, le VES se répartit en une composante axiale et une composante transversale ou radiale, phénomène qui se reproduit de proche en proche vers l’aval en constituant une onde appelée onde artérielle – ou onde de pouls – qui se propage à tout l’arbre artériel. C’est cette onde qui est perçue au niveau des différentes artères périphériques comme le pouls (radial, carotidien, fémoral, etc.). La vitesse de propagation de cette onde (3 à 5 m/sec dans l’aorte chez le sujet jeune, s’accélérant vers l’aval) est proportionnelle à la rigidité de la paroi. Elle est donc plus grande chez les sujets âgés dont la paroi vasculaire est plus rigide que chez les sujets jeunes. Cette onde se réfléchit sur les embranchements vasculaires et les résistances artériolaires pour revenir vers le cœur. Elle revient au niveau de l’aorte initiale au moment de la fermeture de la valve aortique à laquelle elle contribue, ainsi qu’à la perfusion des artères coronaires dont les ostiums sont situés en regard des valvules sigmoïdes (voir chapitre 3, Physiologie de la circulation coronaire).
L’onde de pouls et sa réflexion sont également responsables du fait que la PA systolique des artères distales est plus élevée que celle des artères proximales. En effet, pour des raisons qui tiennent à la moindre compliance des artères distales, à une plus grande vitesse de propagation et à une plus grande proximité des sites de réflexion, onde incidente et onde réfléchie s’additionnent. Au contraire, la PA diastolique diminue vers la périphérie, ce qui augmente la PA différentielle (PA pulsée) et la PA moyenne diminue également. Néanmoins, ces augmentations et diminutions restent modérées.
Dans les artères, l’écoulement du sang présente, à l’état physiologique, une organisation laminaire, en couches concentriques glissant les unes sur les autres dans l’axe du vaisseau, avec un profil le plus souvent parabolique. Au niveau d’un rétrécissement pathologique tel qu’une plaque d’athérosclérose, l’écoulement devient turbulent, les couches présentant des orientations et des vitesses désorganisées, anarchiques.
L’application au système cardiovasculaire de principes simples de mécanique des fluides permet d’identifier les facteurs qui déterminent la circulation (le débit) du sang dans les vaisseaux. Les principaux facteurs ont été mis en évidence au milieu du xixe siècle par Poiseuille pour ce qui concerne les écoulements laminaires.
Soit un segment de tuyau de longueur L et de rayon r, dans lequel s’écoule un liquide de viscosité μ. Si un liquide s’écoule dans ce tuyau, c’est que la pression à l’entrée est supérieure à la pression à la sortie. Selon la loi de Poiseuille, le débit Q du liquide dans le tuyau est proportionnel à la différence de pression ΔP entre l’entrée et la sortie du tuyau et au rayon du tuyau à la puissance 4, et inversement proportionnel à la viscosité μ du liquide et à la longueur du tuyau, soit :
________________________________________________________________________________
Q=ΔP.π.r4/8.μ.L (loi de Poiseuille)
________________________________________________________________________________
En rapprochant cette loi de celle établie par Darcy quelques années plus tard qui dit que le débit est proportionnel à la différence de pression et inversement proportionnel à la résistance à l’écoulement (Q = ΔP/R), on en déduit que la résistance R est proportionnelle à la viscosité du liquide et à la longueur du tuyau et inversement proportionnelle au rayon du tuyau à la puissance 4 soit :
________________________________________________________________________________
R=8.μ.L/π.r4
________________________________________________________________________________
On voit ainsi que le calibre du tuyau dans lequel s’écoule le liquide est, de loin, le facteur le plus influent sur les résistances à l’écoulement : diviser par deux le rayon du tuyau conduit à augmenter 16 fois sa résistance. Transposée à l’anatomie du secteur artériel de la circulation systémique, cette équation indique que les résistances qui s’opposent au débit du sang dans les vaisseaux se situent au niveau des petites artères, artérioles et sphincters précapillaires (fig. 1.18).
________________________________________________________________________________

Figure 1.18.
Les vaisseaux de la circulation systémique, de l’aorte aux capillaires.
Nombre, diamètre, épaisseur et surface sectionnelle cumulée de l’aorte, des grosses artères, des artérioles et des capillaires. On voit que les artérioles, par leur diamètre et leur surface cumulée, représentent le principal élément résistif de la circulation systémique, ce d’autant qu’une vasoconstriction réduira encore leur diamètre. Au plan résistif, les capillaires ont certes le plus petit diamètre, mais ceci est compensé par leur grand nombre et la grande surface sectionnelle cumulée qu’ils représentent.
Ilustration due à l’obligeance du Dr Ph. Bonnin, UFR de médecine, Université de Paris.
________________________________________________________________________________
Au contraire de l’aorte et des grosses artères, ces artères possèdent une media riche en cellules musculaires lisses (voir Histologie) leur permettant de modifier leur diamètre au cours du temps, caractéristique appelée vasomotricité. La contraction des cellules musculaires lisses est responsable d’une vasoconstriction et leur relaxation d’une vasodilatation. Outre son rôle dans la régulation de la PA (voir chapitre 2.1), la vasomotricité permet de moduler la distribution du débit cardiaque aux différents tissus et organes en fonction de leurs besoins. Ceci est possible en raison de l’organisation de la circulation systémique ou les différentes circulations locales (cerveau, foie, reins, muscles, etc.) sont placées en parallèle – et non en série – les unes par rapport aux autres. Dans ces conditions, la résistance totale R n’est pas la somme des résistances individuelles de chaque circulation mais se calcule selon la formule : 1/R = 1/R1 + 1/R2 + 1/Rn.
Autorégulation et contrôle de la vasomotricité
Il existe à l’état basal un tonus vasomoteur qui résulte d’un équilibre entre un tonus vasoconstricteur et un tonus vasodilatateur. Il existe de plus au niveau de nombreux organes, dont le cerveau et le rein, un mécanisme appelé tonus myogénique (également appelé autorégulation) par lequel, dans certaines limites, le débit sanguin n’augmente pas – ou augmente peu – lorsque la pression de perfusion augmente. Ceci se fait grâce à une vasoconstriction réactionnelle dont le mécanisme moléculaire reste incomplètement élucidé. Ce mécanisme vise notamment à protéger les organes contre une augmentation excessive de la pression de perfusion.
À côté de ce mécanisme qui ne met pas en jeu de régulation neurohumorale proprement dite, les petites artères et les artérioles sont soumises à de nombreuses influences vasoconstrictrices ou vasodilatatrices. Le système sympathique est essentiellement vasoconstricteur via la stimulation des récepteurs α1 adrénergiques par la noradrénaline. Le système parasympathique a un rôle limité voire inexistant dans la vasomotricité artériolaire car, sauf de rares exceptions, il n’innerve pas la paroi des vaisseaux.
De nombreux facteurs humoraux, endocrines, paracrines et métaboliques participent également à la vasomotricité. L’angiotensine II, l’arginine-vasopressine et l’endothéline sont les principaux agents vasoconstricteurs. Le monoxyde d’azote (NO), la prostacycline et les peptides atriaux natriurétiques (ANP, BNP) sont les principaux agents vasodilatateurs. Le NO est produit de façon continue par les cellules endothéliales sous l’effet du frottement lié à l’écoulement du sang dans les vaisseaux (forces de cisaillement ou « shear stress »). Il diffuse vers les cellules musculaires lisses sous-jacentes dont il assure un tonus vasodilatateur à l’état basal.
Microcirculation et les échanges capillaires
La microcirculation est la partie de la circulation concernée par les échanges entre le sang et les tissus. Elle est constituée par la succession des artérioles, des vaisseaux capillaires et des veinules. Les capillaires forment un réseau vasculaire extrêmement ramifié entre les artérioles et les veinules dans l’interstitium des organes. Ils ont pour rôle de permettre les échanges entre le sang et les tissus. Les capillaires sont présents dans la circulation systémique et la circulation pulmonaire. Ils ne sont pas innervés, contrairement aux artérioles et aux veinules.
De par leur diamètre (30 à 20 μm), les artérioles sont les vaisseaux résistifs. La nature pulsatile de l’onde de pression y est conservée mais elle est très amortie dans les vaisseaux de diamètre < 50 μm. Leur média, riche en cellules musculaires lisses, est particulièrement développée et innervée. Dans leur partie terminale, elles sont peu innervées et leur vasomotricité dépend surtout des phénomènes locaux liés à l’activité métabolique tissulaire, notamment musculaire (effet relaxant de l’hypoxie, l’acidose, l’adénosine, du phosphate inorganique, du K+, etc.). Dans certains tissus, on peut observer un renforcement circonférentiel précapillaire de la média qui permet aux artérioles de fonctionner comme de véritables sphincters. Lorsque ces derniers s’ouvrent, le sang se dirige vers les capillaires puis les veinules. Si les sphincters sont fermés, le sang se déverse via un canal pour rejoindre directement les veinules qui sont également des vaisseaux résistifs.
Les capillaires présentent un diamètre de 8 à 5 μm, donc le plus souvent inférieur au diamètre des globules rouges qui doivent se déformer pour y circuler. Leur densité est extrêmement variable d’un organe à l’autre, de 300-700/mm2 dans le muscle squelettique à 3 500/mm2 au niveau du myocarde. Si une résistance importante peut être associée, du fait de son très petit rayon, à chaque capillaire pris individuellement, la résistance globale du réseau capillaire dans son ensemble est faible. En effet le nombre très élevé de capillaires – que l’on peut considérer comme un réseau de résistances en parallèles- induit une résistance équivalente globale faible. Cela explique que le gradient de pression entre les extrémités artériolaires et veinulaires du réseau capillaire est faible, l’essentiel du gradient de pression étant situé en amont du réseau capillaire, aux niveaux des artérioles. Les capillaires sont formés d’une lame basale et d’une couche de cellules endothéliales qui permet les échanges d’eau, de gaz dissous, d’ions et autres molécules entre le sang et les organes. La pression hydrostatique y est d’environ 35 mmHg à l’entrée et de 15 mmHg à la sortie. Le flux sanguin dans les capillaires est discontinu et lent. Les échanges entre l’interstitium et les capillaires s’effectuent par les phénomènes de diffusion et de filtration :
- le phénomène de diffusion dépend de la structure et du poids moléculaire des molécules ;
- le phénomène de filtration dépend de la pression capillaire, la pression du liquide interstitiel, la pression oncotique plasmatique et la pression oncotique du liquide interstitiel. Le phénomène de filtration est soumis à la loi de Starling (à ne pas confondre avec la loi de Frank-Starling). Au début du capillaire, la pression de filtration est positive, ce qui a pour conséquence une fuite de liquide du capillaire vers l’interstitium. Vers la sortie du capillaire, la pression de filtration est négative, ce qui permet la réabsorption de liquide de l’interstitium vers le capillaire.
Des modifications des pressions hydrostatiques – mais également oncotiques – tant à l’entrée qu’à la sortie des capillaires ont des conséquences physiologiques ou pathologiques importantes. Par exemple, si la pression hydrostatique de sortie s’accroît anormalement comme dans l’insuffisance cardiaque droite, une extravasation liquidienne des capillaires vers le tissu interstitiel survient, ce qui crée les œdèmes.
Veines
Les veines font suite aux veinules. Toutes les veines convergent ensuite vers deux gros troncs terminaux, les veines caves supérieure et inférieure, qui se jettent dans l’atrium droit. De par la structure de leur paroi, relativement pauvre en cellules musculaires lisses et riche en fibre élastiques, les veines systémiques ont une compliance bien plus grande que celle des artères. Elles contiennent ainsi une proportion importante du volume sanguin (3,5 l soit environ 65 % du volume sanguin total). Elles sont innervées par le système sympathique, favorisant donc la vasoconstriction.
Les vélocités veineuses sont faibles ; la vitesse moyenne du sang dans les veines est deux fois plus faible que dans les artères. Le débit veineux est continu et laminaire. Selon l’activité et la posture, les débits veineux peuvent varier de façon importante en périphérie. En décubitus, les pressions veineuses sont environ de 15 mmHg dans les veinules et 0 mmHg dans l’atrium droit.
Les veines assurent le retour du sang vers le cœur. La propagation du sang veineux vers le cœur appelé retour veineux se fait grâce à de multiples facteurs : l’énergie du ventricule gauche non encore dissipée, l’aspiration du sang par le ventricule droit lors de la diastole, l’aspiration du sang dans le thorax par abaissement de la pression intrathoracique lors de l’inspiration, etc. Enfin, la pression musculaire sur les veines lors de la contraction des muscles — la marche, notamment, est un élément important pour pulser le sang des membres inférieurs vers les veines du tronc, les valvules veineuses empêchant le sang de redescendre lors de la relaxation musculaire.
Le retour veineux doit être suffisant pour assurer un remplissage des ventricules (précharge) adéquat. Il augmente de façon importante lors de l’exercice aussi bien vers le cœur droit que vers le cœur gauche, ce qui augmente la précharge des ventricules. Cette augmentation est responsable d’une augmentation de leur force de contraction ce qui augmente le VES (loi de Frank-Starling), augmentation qui participe, avec l’effet inotrope positif et l’augmentation de la FC liée à la stimulation sympathique, à l’augmentation du débit cardiaque.
Lymphatiques
Les vaisseaux lymphatiques naissent au niveau des espaces péricapillaires et se jettent ensuite dans le réseau veineux. Le système lymphatique draine les 10 % du liquide filtré dans l’interstitium qui n’est pas réabsorbé en sortie des capillaires. Ils complètent le retour veineux en assurant le drainage des tissus interstitiels, notamment en y récupérant des grosses protéines d’origine plasmatique.
Les vaisseaux lymphatiques afférents rejoignent les ganglions lymphatiques. Ensuite, les vaisseaux lymphatiques efférents rejoignent la grande veine lymphatique ou le canal thoracique qui se jettent dans la veine cave supérieure.
Circulation pulmonaire
Organisation générale
La circulation pulmonaire, également appelée petite circulation, assure le passage obligatoire de la totalité du débit cardiaque du cœur droit vers le cœur gauche. Elle a une organisation générale identique à celle de la circulation systémique. Chaque poumon possède une artère et deux veines pulmonaires. Le tronc de l’artère pulmonaire fait suite au ventricule droit. Le sang artériel pulmonaire est pauvre en oxygène. Il chemine ensuite dans les capillaires, ce qui lui permet de s’enrichir en oxygène. Le sang est ensuite acheminé par les veines pulmonaires jusqu’à l’atrium gauche. Il existe également des lymphatiques. La circulation pulmonaire contient environ 600 ml de sang.
Particularités
La pression artérielle pulmonaire est beaucoup plus faible que la pression artérielle systémique. Elle est d’environ 25 mmHg pour la pression systolique et de 12 mmHg pour la pression diastolique (système à basse pression). Ces faibles pressions sont liées au fait que le système vasculaire pulmonaire possède des résistances basses et est globalement très compliant. En outre, quand le débit sanguin augmente, les résistances vasculaires pulmonaires baissent ce qui favorise le retour veineux vers le cœur gauche.
Des mécanismes passifs et actifs régulent la résistance vasculaire pulmonaire :
- les mécanismes passifs mis en jeux lors de l’exercice comprennent la distension des vaisseaux déjà ouverts et le recrutement de nouveaux vaisseaux. En effet, la faible augmentation de pression liée à l’augmentation du retour veineux a pour effet d’ouvrir de nouveaux capillaires, ce qui permet d’augmenter le débit global et les surfaces d’échanges sans augmentation des résistances donc de la pression ;
- les facteurs vasoconstricteurs sont essentiellement la baisse de la pression partielle en O2 (PaO2) : la vasoconstriction hypoxique est mise en route lorsque la PaO2 est inférieure à 60 mmHg. Les autres facteurs vasoconstricteurs sont l’augmentation de la pression partielle en CO2 (PaCO2), l’angiotensine II, l’endothéline, les thromboxanes, etc. ;
- les facteurs vasodilatateurs sont l’élévation de la PaO2, le NO, les prostacyclines, etc.
Les échanges au niveau des capillaires pulmonaires se font essentiellement avec les alvéoles pulmonaires, dans lesquelles le sang rejette du gaz carbonique et de la vapeur d’eau et prélève l’oxygène qui provient de l’air inspiré.
Les capillaires pulmonaires étant en continuité avec les veines pulmonaires et l’oreillette gauche, en fin de diastole la pression capillaire pulmonaire est identique à la PTDVG et représente ainsi la précharge du ventricule gauche. Il y a ainsi pratiquement, en fin de diastole, une égalité entre la pression diastolique des artères pulmonaires (PAD), la pression capillaire pulmonaire (PCP) et la PTDVG. Elle doit avoir un niveau de 8 à 12 mmHg pour que le remplissage et donc l’éjection du ventricule gauche soient satisfaisants :
- en deçà de ce niveau, la contraction ventriculaire est moins bonne et le VES diminue ;
- au-delà de ce niveau, la contraction du VG est plus forte (loi de Frank-Starling) ce qui augmente le VES, ce qui permet de maintenir la PTDVG proche de sa valeur normale. C’est ce qui se passe notamment lors de l’effort. Lors de l’insuffisance cardiaque gauche, le VG ne parvient plus à maintenir une PTDVG normale, notamment lors de l’effort ; si elle dépasse 26 mmHg survient l’œdème pulmonaire (voir chapitre 5).
Hémostase-coagulation
L’hémostase est l’ensemble des mécanismes qui concourent à l’arrêt des saignements ainsi qu’à la prévention des saignements spontanés et des thromboses. L’hémostase est composée de trois phases, l’hémostase primaire, la coagulation et la fibrinolyse. Ces phases sont parfaitement régulées et orchestrées les unes par rapport aux autres, et tout déséquilibre de ce système pourra s’accompagner de manifestations hémorragiques ou thrombotiques.
En situation physiologique c’est la survenue d’une brèche vasculaire qui va déclencher le processus hémostatique afin de limiter les pertes sanguines. La première réaction de l’organisme va être une vasoconstriction locale pour limiter le débit sanguin et les pertes sanguines. Puis l’hémostase primaire se déclenche avec formation d’un clou plaquettaire, encore appelé thrombus blanc, qui suffira pour arrêter le saignement dans la microcirculation. Cependant, dans les vaisseaux de plus gros calibre, ce clou plaquettaire, trop fragile pour supporter le flux sanguin, devra être consolidé par un réseau de fibrine issu de l’activation de la coagulation, pour donner le thrombus rouge. Enfin, une fois le vaisseau réparé, le caillot devenu inutile sera détruit grâce à la fibrinolyse.
Dans cette section, nous détaillerons les deux premières étapes de ce processus, l’hémostase primaire et la coagulation ainsi que les principaux tests utilisés en pratique clinique pour l’exploration de l’hémostase.
Hémostase primaire
L’hémostase primaire fait intervenir différents acteurs :
- des cellules sanguines, les plaquettes (encore appelés thrombocytes) ;
- des protéines plasmatiques, le facteur de Willebrand et le fibrinogène ;
- le vaisseau et en particulier le sous-endothélium.
Plaquettes
Ce sont des petites cellules anucléées issues de la fragmentation du cytoplasme de leurs précurseurs, les mégacaryocytes. Les plaquettes, au nombre de 150 à 400 giga/L dans le sang, sont les plus petites cellules sanguines.
Au repos, les plaquettes ont une forme discoïde. Leur activation entraîne un remaniement de leur cytosquelette constitué notamment de microfilaments d’actine et de myosine, avec changement de forme et émission de pseudopodes.
Lorsqu’elles sont observées sur un frottis sanguin, les plaquettes apparaissent très granuleuses. En effet, elles sont très riches en granulations de différentes natures, notamment les granules alpha et les granules denses. Les granules alpha sont les plus nombreux. Ils contiennent des protéines très variées dont certaines sont impliquées dans l’hémo-stase comme le facteur de Willebrand ou le fibrinogène. C’est également dans les granules alpha que l’on trouve une protéine spécifiquement plaquettaire, le PF4 (Platelet Factor 4) qui est impliquée dans la physiopathologie d’une complication redoutée d’un traitement anticoagulant, la thrombopénie induite à l’héparine (TIH).
Les granules denses sont beaucoup plus rares mais ont une importance majeure dans l’activation des plaquettes. Contrairement aux granules alpha, leur contenu n’est pas protéique, mais il est principalement composé d’ADP, de calcium ou encore de sérotonine.
Au cours de l’activation des plaquettes, le contenu de ces différents types de granulations pourra être déversé à l’extérieur de la plaquette grâce à un réseau de canaux appelé le système canaliculaire ouvert à la surface. Ce réseau est formé d’invaginations de la membrane externe de la plaquette qui pénètrent vers l’intérieur de la cellule. Ainsi, lorsque les plaquettes s’activent, on observe un remaniement du cytosquelette, avec fusion de la membrane des granules alpha et des granules denses au système canaliculaire ouvert à la surface et déversement de leur contenu vers l’environnement extérieur de la plaquette. Cette capacité de sécrétion des plaquettes est essentielle à leur activation et au bon fonctionnement de l’hémostase primaire.
Enfin, la membrane plaquettaire est constituée d’une bicouche phospholipidique asymétrique comme c’est le cas de la majorité des cellules. Ainsi, au repos, la phosphatidylsérine chargée négativement (anionique) est principalement présente au niveau du feuillet interne de la membrane. Elle est donc peu exposée à la surface de la plaquette. Par ailleurs, de nombreux récepteurs sont insérés dans la membrane des plaquettes. On distingue des récepteurs à sept domaines transmembranaires dont fait partie le PAR-1 (protease activable receptor-1). Comme son nom l’indique, l’activation du PAR-1 se fait lors du clivage de son extrémité extracellulaire par une protéase, en l’occurrence par la thrombine qui est l’enzyme centrale de la coagulation. Le récepteur P2Y12 est également un récepteur à 7 domaines transmembranaires dont le ligand est l’ADP, tout comme le TP récepteur (TP pour thromboxane prostanoid) qui est activé par le thromboxane A2. Des récepteurs de nature glycoprotéique sont également présents à la surface des plaquettes. Il s’agit du récepteur α2bβ3 (couramment appelé GPIIbIIIa) qui, une fois activé, peut lier le fibrinogène, mais également du récepteur GPIb-V-IX, récepteur du facteur de Willebrand. Enfin, le collagène possède lui aussi des récepteurs glycoprotéiques à la surface des plaquettes. Il s’agit des récepteurs α2β1 et GPVI.
Acteurs non cellulaires de l’hémostase primaire
Outre les plaquettes, le facteur de Willebrand, le fibrinogène et le sous-endothélium sont indispensables au bon déroulement de l’hémostase primaire.
Le facteur de Willebrand (WF) est une protéine multimérique produite par les mégacaryocytes et les cellules endothéliales. Ainsi, le WF se trouve localisé dans les granules alpha des plaquettes. Concernant la production endothéliale, le facteur de Willebrand va être sécrété soit au pôle basal de la cellule et s’accumuler dans le sous-endothélium, soit au pôle apical et être sécrété dans le plasma. Une partie sera également stockée dans des granulations des cellules endothéliales appelées corps de Weibel Palade. Le WF se trouve sous forme de multimères de très haut poids moléculaire très actifs dans le sous-endothélium, les corps de Weibel Palade et les granules alpha, alors que la forme plasmatique est clivée en fragments de plus bas poids moléculaire moins actifs. Dans tous les cas, le WF est sous une conformation globulaire, qui l’empêche d’exposer ses sites d’interaction avec la GPIb-V-IX et donc de s’y fixer en condition physiologique. Le WF a deux fonctions principales dans l’hémostase : il permet l’adhésion des plaquettes au sous-endothélium lésé, mais il joue également le rôle de transporteur d’un facteur de la coagulation, le FVIII dont le déficit est responsable de l’hémophilie A.
Le fibrinogène est une protéine plasmatique synthétisée par le foie, dont la concentration augmente au cours de la réaction inflammatoire.
Le fibrinogène est impliqué dans l’hémostase primaire et dans la coagulation. Il est le ligand principal du récepteur plaquettaire GPIIbIIIa et se trouve ainsi impliqué dans la formation du thrombus blanc (hémostase primaire). C’est également à partir du fibrinogène que la thrombine va engendrer la formation du réseau de fibrine et donc du thrombus rouge (coagulation).
Le sous-endothélium est un des éléments de l’intima au niveau de la paroi du vaisseau. Il est composé de nombreuses macromolécules dont certaines comme le collagène de type III ou le facteur de Willebrand sont très thrombogènes. Il est normalement recouvert d’une couche étanche de cellules endothéliales jointives qui évite ainsi tout contact entre le sang et le sous-endothélium pro-coagulant. Au repos, les cellules endothéliales ont elles-mêmes un phénotype anticoagulant qui participe au maintien de la fluidité du sang. Cependant, toute rupture de la continuité endothéliale (blessure du vaisseau) entraîne une exposition du sous-endothélium pro-coagulant au flux sanguin et une activation de l’hémostase.
Déroulement de l’activation des plaquettes
Tant que le vaisseau est intact, les plaquettes projetées par le flux sanguin contre la paroi vasculaire sont repoussées par la surface endothéliale. Mais en cas de brèche vasculaire, le sous-endothélium entre au contact du sang et le WF présent au niveau du sous-endothélium se trouve exposé aux cellules sanguines. Le WF est ancré au collagène du sous-endothélium par l’une de ses extrémités et, sous l’effet du flux sanguin et donc des forces de cisaillement qui en découlent, celui-ci se déroule et les sites d’interaction avec la GPIb-V-IX plaquettaire se trouvent exposés au flux sanguin.
Phase d’adhésion plaquettaire
Les plaquettes vont adhérer au sous-endothélium, tout d’abord en s’arrêtant sous l’effet de leur interaction avec le WF déroulé, puis en engageant d’autres liaisons directement avec le collagène du sous-endothélium via leurs récepteurs GPVI et α2β1 (voir plus haut). Ces nouvelles interactions entraînent un étalement des plaquettes et des signaux intracellulaires aboutissant à une augmentation de la concentration calcique dans le cytosol et donc à l’activation des plaquettes.
Phase d’activation plaquettaire
L’activation des plaquettes va se traduire par une cascade d’évènements (fig. 1.19). Elles changent de forme et émettent des pseudopodes qui permettront leur enchevêtrement et participeront à la formation du clou plaquettaire. De façon concomitante, elles sécrètent le contenu de leurs granules, permettant le recrutement de nouvelles plaquettes et donc l’amplification du phénomène. En effet, l’ADP des granules denses ainsi libéré peut se fixer à ses récepteurs plaquettaires dont le récepteur P2Y12 et ainsi activer de nouvelles plaquettes. Des inhibiteurs pharmacologiques du récepteur P2Y12 sont d’ailleurs utilisés en thérapeutique pour diminuer l’activabilité plaquettaire. La sérotonine sécrétée à partir de ces mêmes granules contribue par ailleurs à la vasoconstriction locale observée au niveau de la blessure vasculaire. L’activation plaquettaire s’accompagne également d’une modification de la répartition des phospholipides membranaires avec perte de l’asymétrie et exposition des phospholipides anioniques à la surface des plaquettes. Ces phospholipides sont essentiels à la coagulation et contribueront de façon majeure à la génération de thrombine, elle-même étant capable d’activer le récepteur PAR-1 et de contribuer à l’amplification de l’activation plaquettaire.
________________________________________________________________________________

Figure 1.19.
Principaux récepteurs impliqués dans l’activation des plaquettes.
L’augmentation de la concentration calcique cytosolique consécutive à l’adhésion des plaquettes entraîne la sécrétion des granules (l’ADP est sécrété à partir des granules denses), l’exposition de phospholipides anioniques et la libération d’acide arachidonique (AA) à partir de la membrane. L’AA étant ensuite transformé en thromboxane A2 (TXA2) qui diffuse en dehors de la plaquette. Il s’ensuit une amplification de l’activation plaquettaire médiée par l’activation du TP récepteur via le TXA2, du récepteur P2Y12 par l’ADP et du PAR-1 par la thrombine. Enfin, la transconformation du récepteur GPIIbIIIa va lui permettre de fixer le fibrinogène pour faire des ponts entre les plaquettes.
________________________________________________________________________________
Enfin, l’augmentation du Ca2 + intra-cytosolique, à l’origine de l’activation des plaquettes, s’accompagne également de l’activation de diverses enzymes dont le phospholipase A2. Cette enzyme libère, à partir des phospholipides de la membrane de la plaquette, de l’acide arachidonique qui, sous l’action d’une cyclo-oxygénase puis de la thromboxane A2 synthase, produira du thromboxane A2. Ce thromboxane A2 diffuse à l’extérieur de la plaquette et contribue à l’amplification du phénomène d’activation en se fixant au TP récepteur. L’importance de cette voie est attestée par l’efficacité de l’aspirine, inhibiteur de la cyclo-oxygénase, comme agent anti-plaquettaire.
Phase d’agrégation plaquettaire
C’est le dernier événement de l’hémostase primaire. À ce stade, l’enchevêtrement des plaquettes doit encore être consolidé par la formation de ponts entre les plaquettes. Cette consolidation est rendue possible grâce au changement de conformation du récepteur GPIIbIIIa qui est sous forme repliée sur les plaquettes au repos. Cette transconformation permet l’exposition des sites de liaison du récepteur au fibrinogène qui, en se fixant au récepteur GPIIbIIIa de deux plaquettes voisines, permet la formation ponts inter-plaquettaires (= agrégation plaquettaire) et donc du thrombus blanc.
Coagulation
La coagulation est le résultat de réactions enzymatiques en cascade qui font intervenir des protéines plasmatiques et des surfaces cellulaires (provenant des plaquettes, des cellules endothéliales ou des monocytes activés), l’objectif étant d’aboutir à la formation d’un thrombus issu de la transformation du fibrinogène soluble en fibrine insoluble. C’est la thrombine, enzyme centrale de l’hémostase, qui est responsable de la transformation du fibrinogène en fibrine. La thrombine circule sous la forme d’un précurseur inactif, la prothrombine, qui va être activée localement, à la surface des membranes cellulaires et en présence de Ca2 +, afin de renforcer le clou plaquettaire par la formation d’un thrombus rouge. Ce thrombus, plus solide, persiste jusqu’à cicatrisation complète de la brèche vasculaire.
Facteurs de la coagulation
Les facteurs de la coagulation sont synthétisés principalement par le foie. Certains d’entre eux nécessitent pour leur synthèse finale de la vitamine K (cofacteur de la γ-glutamyl carboxylase), dont le rôle est de transformer certains acides glutamiques de ces protéines en acide γ-carboxy-glutamique qui permettent d’ancrer ces facteurs de la coagulation aux surfaces phospholipidiques (membranes) par chélation du Ca2 +. Les facteurs vitamine K dépendants sont les facteurs II, VII, IX et X. Ils sont la cible d’une classe thérapeutique, les anti-vitamines K qui, en empêchant ce mécanisme, ont une action anticoagulante. Le tableau 1.2 liste les facteurs de la coagulation et leur fonction. Les facteurs de la coagulation sont nommés par des chiffres romains lorsqu’ils sont inactifs (on parle également de « zymogènes », c’est-à-dire de la forme non activée de l’enzyme), auxquels on ajoute un « a » après le chiffre romain quand ils sont activés et acquièrent des fonctions enzymatiques (enzymes de la famille des sérine-protéases).
Tableau 1.2.
Les facteurs de coagulation et leurs principales fonctions
| Classification et nom | Fonction |
| Facteurs vitamine K dépendants* | |
| Prothrombine (II) | Le IIa (thrombine) transforme le fibrinogène en fibrine, active les plaquettes, le VIII, le V, le XIII, le XI, la protéine C. |
| La proconvertine (VII) | Le VIIa active la voie extrinsèque, avec le facteur tissulaire en présence de phospholipides |
| Facteur antihémophilique B (IX) | Le IXa active le X au sein du complexe tenase avec le VIIIa |
| Facteur Stuart (X) | Le Xa active le II au sein du complexe prothrominase avec le Va |
| Cofacteurs | |
| Facteur tissulaire (FT) | Cofacteur du VIIa, déclenche la voie extrinsèque |
| Proaccélérine (V) | Cofacteur du Xa au sein du complexe prothrombinase |
| Facteur antihémophilique A (VIII) | Cofacteur du IXa au sein du complexe tenase |
| Facteurs de la phase contact | |
| Facteur XII
Prékallicréine (PK) Kininogène de haut poids moléculaire (KHPM) |
Activent le XI |
| Facteur Rosenthal (XI) | Le XIa active le facteur IX |
| Facteurs formant le thrombus | |
| Fibrinogène (I) | Précurseur de la fibrine (polymérisation des monomères) |
| Facteur stabilisant la fibrine (XIII) | Stabilise la fibrine |
| Phospolipides membranaires | |
| Des plaquettes
Des cellules endothéliales Des monocytes activés |
Support des réactions de coagulation en présence de Ca 2+ pour VII + FT, complexes tenases et prothrombinase et PCa + PS |
| Inhibiteurs de la coagulation | |
| Antithrombine (AT) | Inhibiteur des serine-protéases : IIa, IXa, Xa, Xia |
| Protéine C (PC) | La PCa inhibe les Va et VIIIa en presence de PS |
| Protéine S (PS) | Cofacteur de la PCa |
| Tissue factor pathway inhibitor (TFPI) | Inhibe le Xa et le complexe FT-VIIa |
Les protéines C et S sont également vitamine K dépendants
La prothrombine (FII), la proconvertine (FVII), le facteur antihémophilique B (FIX), le facteur Stuart (FX), le facteur XI (FXI), le facteur Hageman (FXII) et le facteur stabilisant de la fibrine (FXIII) sont des enzymes qui circulent sous forme de zymogène et qui vont être activés localement suite à des réactions enzymatiques successives. L’objectif est d’entraîner, localement et de façon concentrée, une formation de thrombine (ou FIIa) exponentielle permettant la formation de fibrine et la stabilisation du thrombus. La fibrinoformation est ainsi un mécanisme local, très finement régulé de façon à ne pas entraîner un thrombus trop important et une occlusion complète des vaisseaux. Cette régulation est liée d’une part au flux circulatoire qui entraîne une dilution des facteurs de la coagulation mais aussi à des inhibiteurs de la coagulation.
Deux facteurs de la coagulation sont des cofacteurs et jouent un rôle majeur dans l’accélération des réactions enzymatiques ; les facteurs VIIIa et Va, respectivement cofacteurs du FIXa (au sein du complexe Tenase) et du FXa (au sein du complexe prothrombinase). Le facteur tissulaire (FT) est une glycoprotéine membranaire, fixée aux phospholipides. Son exposition au flux sanguin lors d’une brèche vasculaire permet la fixation du FVII et son auto-activation en FVIIa.
Physiologie de la coagulation
Classiquement la génération de thrombine s’effectue par deux voies dites extrinsèque et intrinsèque (fig. 1.20), qui aboutissent toutes les deux à la formation d’un complexe enzymatique commun appelé le complexe prothrombinase (FXa + FVa + Ca2 + + phospholipides anioniques) après activation du FX en FXa. La prothrombinase permet l’activation de la prothrombine en thrombine (IIa). La thrombine est l’enzyme centrale de la coagulation. En effet elle est responsable de la fibrinoformation par clivage du fibrinogène, mais elle a également des rôles multiples comme la sécrétion endothéliale de WF, l’activation des plaquettes (par le PAR-1) et également l’activation des facteurs V, VIII, XI et XIII.
________________________________________________________________________________

Figure 1.20.
Schéma simplifié de la coagulation.
Physiologiquement, lors d’une brèche vasculaire, c’est la voie extrinsèque qui est déclenchée (1 et 2). À ce stade, les quantités de thrombine générées sont insuffisantes pour permettre la formation du caillot de fibrine. Cette dernière nécessite l’amplification de la coagulation par l’activation des cofacteurs V et VIII (3) et celle du facteur XI (4).
________________________________________________________________________________
Le fibrinogène, très abondant dans le plasma, est une protéine fibrillaire et trinodulaire constitué de trois chaînes Aα, Bβ et γ, qui forment un nodule D à chaque extrémité et un nodule E au centre. La thrombine active le fibrinogène en monomères de fibrine par clivage de deux peptides appelés fibrinopeptides A et B, qui permet ainsi une polymérisation de la fibrine, par l’intermédiaire du nodule E qui se fixe à quatre monomères différents de fibrine par l’intermédiaire de leurs nodules D (fig. 1.21). Cette polymérisation, stabilisée par l’action du FXIIIa, aboutit à un important réseau insoluble dont les fibrilles sont résistantes au stress mécanique du vaisseau.
________________________________________________________________________________

Figure 1.21.
Schéma de la fibrinoformation.
La thrombine active le fibrinogène en monomères de fibrine par clivage de deux peptides appelés fibrinopeptides A et B, qui permet ainsi une polymérisation de la fibrine, par l’intermédiaire du nodule E qui se fixe à quatre monomères différents de fibrine par l’intermédiaire de leurs nodules D. Cette polymérisation est ensuite stabilisée par l’action du FXIIIa.
________________________________________________________________________________
Physiologiquement, lors d’une brèche vasculaire, c’est initialement la voie extrinsèque qui est déclenchée (fig. 1.20). Le facteur tissulaire en présence de FVII et de phospholipides va entraîner localement la génération de faibles quantités de FVIIa. Le FVIIa ainsi produit va alors activer le FX en FXa, qui à son tour active la prothrombine en thrombine. Le FVIIa produit peut également activer un peu de FIX en FIXa (boucle de Josso), qui participe également à l’activation du FX en FXa puis du FII en FIIa. Cependant, à ce stade, les quantités de thrombine générées sont insuffisantes pour permettre la formation du caillot de fibrine.
Une étape d’amplification est indispensable qui va impliquer la formation de complexes d’amplification. Ainsi, les premières traces de thrombine participent à l’activation des plaquettes et vont permettre l’exposition de phospholipides anioniques. La thrombine active égale- ment les deux cofacteurs de la coagulation, les FVa et FVIIIa. Il se forme alors deux complexes enzymatiques à la surface de ces phospholipides anioniques et en présence de Ca2 + : le complexe ténase qui aboutit à la formation de FXa après activation par le FIXa et en présence de FVIIIa ; et le complexe prothrombinase qui s’accompagne de la génération de thrombine par clivage de la prothrombine par le FXa, en présence de FVa. Les activités enzymatiques au sein de ces complexes sont accélérées d’un facteur 200 000 environ.
Une dernière voie d’amplification va contribuer à la génération explosive de thrombine. Ainsi, la thrombine va également amplifier sa propre production en activant le FXI en FXIa (voie intrinsèque) qui active alors le FIX en FIXa puis le FX en FXa et enfin le FII en thrombine. Ces systèmes d’auto-amplification permettent d’avoir un système d’activation de la coagulation qui peut en quelques minutes entraîner localement une génération de thrombine explosive afin d’assurer une hémostase efficace. Le corollaire de ce mécanisme, est la nécessité d’avoir un mécanisme contre-régulateur efficace de façon à limiter localement la génération de thrombine, sans quoi une trop grande propagation du thrombus et une thrombose intempestive pourraient survenir, ou encore une coagulation intravasculaire disséminée.
La coagulation plasmatique peut aussi, dans certaines conditions (infection, inflammation), être activée par des surfaces chargées négativement comme des endotoxines bactériennes mais également des surfaces artificielles (cathéters, circuits de dialyse…) ou in vitro sur un tube en verre. Ce système d’activation est appelé « phase contact » qui met en jeu plusieurs protéines de la voie intrinsèque (facteurs XII, XI, kininogène, prékallicréine) n’est pas le mécanisme principal du déclenchement de la coagulation.
Régulation de l’hémostase
Tout d’abord le flux sanguin participe à la dilution des facteurs activés puis à leur élimination, ce qui explique que la stase sanguine favorise la survenue de thrombose. Soulignons également le fait que les réactions de la coagulation s’effectuent à la surface des membranes cellulaires (plaquettes activées, cellules endothéliales activées) restreint la coagulation au niveau de la brèche vasculaire.
La thrombine, si elle est un puissant activateur plaquettaire, provoque aussi au niveau endothélial la sécrétion de prostacycline, puissant antiagrégant plaquettaire. Elle active également la protéine C qui, en présence de son cofacteur, la protéine S, est un puissant inhibiteur des cofacteurs Va et VIIIa.
L’antithrombine joue également un rôle majeur dans la régulation de la coagulation en inhibant la thrombine et aussi d’autres sérine-protéases de la coagulation et les facteurs IXa, Xa, XIa. Son activité inhibitrice est considérablement accélérée en présence de médicaments anticoagulants de la famille des héparines.
Le TFPI (tissue factor pathway inhibitor) empêche le déclenchement intempestif de la coagulation en se liant aux différents facteurs de l’initiation (FXa puis au FT-FVIIa) et en inhibant leur activité. Ce système est, cependant, vite dépassé pour permettre à la coagulation de démarrer effectivement lorsqu’une véritable brèche vasculaire survient.
Le caillot de fibrine lui-même participe également à restreindre dans l’espace la formation du thrombus, en localisant à sa surface (par adsorption) la thrombine, sans l’inactiver.
Enfin, le système de la fibrinolyse contribue bien sûr aussi à la régulation de l’hémostase et à la dissolution du thrombus quand ce dernier a rempli sa mission initiale de colmater une brèche vasculaire et que la réparation du vaisseau sous-jacent est achevée.
Exploration de l’hémostase
Hémostase primaire
PFA ou temps d’occlusion plaquettaire
Le PFA (platlet function analyzer) est un test d’exploration globale de l’hémostase primaire qui s’est largement substitué à un ancien test, le temps de saignement réalisé in vivo. Il s’agit d’un système qui mime in vitro des conditions de flux de la microcirculation et permet ainsi l’exploration de l’adhésion et de l’agrégation plaquettaire. En pratique, on mesure le temps d’occlusion d’un orifice réalisé sur une membrane recouverte de collagène et au travers duquel passe le sang à tester. Les plaquettes de l’échantillon sanguin sont exposées à différents activateurs plaquettaires au cours du test. Ce test est très sensible aux anomalies du facteur de Willebrand et, dans une moindre mesure, aux anomalies plaquettaires.
Coagulation
TCA (temps de céphaline + activateur)
Ce test explore la coagulation à partir de la voie intrinsèque. Dans ce test, la coagulation est déclenchée par l’ajout de calcium, de phospholipides anioniques et d’un activateur, un composé chargé négativement comme la silice ou le kaolin. Les résultats sont exprimés en seconde par rapport à un témoin. La valeur normale du temps malade/témoin est de 1 et doit rester ≤ 1,2 chez le sujet normal.
En dehors de la prise d’anticoagulants, un allongement du TCA peut être lié à un déficit en facteurs VIII, IX, XI, XII, PK (prékallicréine), KHPM (kininogène de haut poids moléculaire), X, V, II, fibrinogène ou à la présence d’un inhibiteur pathologique comme un anticoagulant circulant lupique. Il est sensible aux anomalies de la fibrinoformation.
Temps de Quick – TQ (ou TP – taux de prothrombine)
Ce test explore en fait l’ensemble des facteurs de la voie extrinsèque. Dans ce test, la coagulation est déclenchée par l’ajout de calcium, de phospholipides anioniques et de facteur tissulaire. Ses résultats sont exprimés en secondes par rapport à un plasma témoin (normale ≤ 1,2) et il est souvent exprimé en pourcentage par rapport à un plasma normal (valeurs normales 70 à 100 %). Lorsque le TQ est utilisé surveiller un traitement par AVK, il est exprimé par l’INR. Un allongement du TQ peut être lié à un déficit en facteurs II, V, VII, X. Il peut être allongé par un anticoagulant circulant et il est sensible aux anomalies de la fibrinoformation.
L’hypocoagulation visée chez les patients sous AVK est exprimée en INR, aux fins de standardisation
________________________________________________________________________________
Points importants
- Le système cardiovasculaire comprend le cœur et les vaisseaux.
- Son rôle est d’apporter à toutes les cellules de l’organisme l’oxygène et les nutriments nécessaires à leur bon fonctionnement, tant au repos qu’à l’effort.
- La pompe cardiaque n’assure pas un débit continu mais un débit discontinu, pulsatile, où se succèdent une phase de remplissage ventriculaire suivie d’une phase d’éjection dans les artères, assurant le débit et la pression.
- Le cœur est un muscle strié creux formé de quatre cavités, deux atriums (droit et gauche) et deux ventricules (droit et gauche), situés dans le médiastin antérieur. Il pèse 250 à 300 g.
- Il a une forme de pyramide triangulaire avec trois faces (ventrale, inférieure, gauche), une base et un apex ou pointe du cœur.
- L’atrium droit est assimilé à un cube à six faces à grand axe vertical : face supérieure, inférieure, latérale, médiale ou septale, dorsale ou postérieure et ventrale ou antérieure.
- Le ventricule droit à une forme de pyramide à trois faces, ventrale ou antérieure, sternocostale, inférieure ou diaphragmatique et interne ou septale et une base formée de l’ostium atrioventriculaire droit et du tronc pulmonaire.
- L’atrium gauche a une forme arrondie à six faces : latérale, médiale, supérieure et inférieure, dorsale ou postérieure et ventrale ou antérieure.
- Le ventricule gauche a une forme de cône aplati avec un sommet à la pointe du cœur, une base en bas à gauche occupée par l’ostium atrioventriculaire gauche et en haut à droite par l’ostium aortique. Il comporte une face gauche ou latérale et une face droite ou médiale.
- Les ostiums atrioventriculaires sont fermés par des valves atrioventriculaires, mitrale à gauche et tricuspide à droite.
- Le tissu nodal et de conduction, ou système nerveux intrinsèque du cœur, est responsable de l’automatisme cardiaque et de la transmission de celui-ci aux cellules musculaires du cœur.
- Le nœud sinu-atrial est situé dans la paroi postérieure de l’atrium droit, entre l’orifice de la veine cave supérieure et l’auricule droite.
- Le nœud atrioventriculaire est situé sur le plancher de l’atrium droit, contre la cloison interatriale.
- La vascularisation artérielle du cœur est assurée par les artères coronaires droite et gauche et la vascularisation veineuse par les veines coronaires.
- Le système artériel de la circulation systémique est sous la dépendance de l’aorte. L’embryologie cardiaque répond à une cinétique précise lors des quatre premières semaines de l’embryogenèse.
- La complexité des processus de développement cardiaque chez l’embryon explique la relative fréquence des malformations cardiaques congénitales, avec une incidence proche de 9 pour 1 000 nouveau-nés.
- La paroi du cœur est composée de 3 tuniques, de l’intérieur vers l’extérieur, endocarde, myocarde et péricarde.
- L’endocarde est plus épais dans les oreillettes que dans les ventricules et est composé d’un endothélium qui repose sur une lame basale et une couche sous endothéliale.
- Le myocarde est composé de trois types cellulaires principaux : cardiomyocytes ou cellules musculaires contractiles, cellules myoendocrines et cellules cardionectrices, disposées dans un tissu conjonctif riche en capillaires.
- L’épicarde tapisse l’extérieur du cœur et représente le feuillet viscéral du péricarde qui se réfléchit au niveau des gros troncs artériels pour se continuer par le feuillet postérieur ou médiastinal du péricarde.
- On distingue trois tuniques dans l’arbre vasculaire, concentrique, de la lumière vers la périphérie, l’intima, la média et l’adventice.
- Ces trois tuniques sont décrites tout au long de l’arbre vasculaire, à l’exception des capillaires, où la structure est réduite à un endothélium, une lame basale et une fine couche de tissu conjonctif sous-endothélial.
- Les artères élastiques correspondent aux plus gros vaisseaux, aorte, artères pulmonaires, carotides et subclavières.
- Les artères musculaires font suite aux artères élastiques, ont un calibre moindre, une lumière arrondie et une paroi relativement épaisse par rapport à leur diamètre.
- Les capillaires sont les vaisseaux les plus fins de l’organisme, dépourvus de média et de limitante élastique.
- Les veines comportent, de manière générale, une lumière plus large et une paroi plus mince que les artères.
- Le drainage lymphatique fonctionne de façon unidirectionnelle, drainant le liquide interstitiel des tissus pour l’évacuer vers la circulation sanguine.
- Le cycle cardiaque enchaîne systole et diastole. La systole, commence par le premier bruit du cœur généré par la fermeture des valves atrioventriculaires droite et gauche, et se termine avec le second bruit du cœur, B2, généré par la fermeture des valves sigmoïdes aortique et pulmonaire. La diastole commence avec B2 et se termine avec B1.
- Le cycle du ventricule gauche peut être décrit dans un diagramme où le volume figure en abscisse et la pression en ordonnée, réalisant une boucle de rotation antihoraire. Chez un individu normal, le volume télédiastolique est de 110 ml et le volume télésystolique de 40 ml.
- Le volume d’éjection systolique correspond au volume de sang éjecté par les ventricules à chaque systole (VTD – VTS).
- Le débit cardiaque est défini par le produit du volume d’éjection systolique par la fréquence cardiaque.
- La fraction d’éjection est définie comme le rapport VES/VTD. Elle est normalement de 65 % pour le ventricule gauche et de 45 % pour le ventricule droit.
- La contraction des oreillettes complète le remplissage ventriculaire à hauteur de 10 à 20 % du retour veineux.
- La pression artérielle est la résultante des effets de la contraction des ventricules à l’origine du débit cardiaque et des résistances vasculaires qui s’y opposent.
- Le débit cardiaque s’adapte aux besoins de l’organisme grâce à la variabilité de ses deux composantes, volume d’éjection systolique et fréquence cardiaque.
- La précharge est la pression qui règne dans les ventricules en fin de diastole (pression télédiastolique du ventricule gauche).
- La loi de Frank-Starling indique que plus la quantité de sang qui revient aux ventricules est importante, plus la PTDVG est élevée, et plus la contraction des ventricules est puissante et ainsi plus le VES est important.
- La postcharge est définie comme la pression qui règne dans la racine de l’aorte au moment de l’ouverture de la valve aortique puis au cours de l’éjection ventriculaire. Elle dépend de la valeur des résistances vasculaires et de la rigidité des gros troncs artériels, qui augmentent avec le vieillissement.
- La contractilité ou inotropisme définit le niveau de performance contractile inhérent aux ventricules, ne dépendant ni de la précharge ni de la postcharge.
- L’adaptation à l’exercice physique se fait par la modulation de la fréquence cardiaque et du volume d’éjection systolique.
- La circulation systémique qui comporte des artères, des capillaires, des veines et des lymphatiques se décompose en systèmes de distribution (aorte et ramifications, grosses artères), à résistance variable (artérioles et sphincter pré capillaires), d’échange (capillaires) et collecteurs (veines).
- L’onde artérielle, ou onde de pouls, se propage à l’arbre artériel et est perçue lors de la prise de pouls.
- La vitesse de propagation de l’onde artérielle ou onde de pouls est de 3 à 5 m/s chez le sujet jeune, et elle est proportionnelle à la rigidité de la paroi (s’altérant avec l’âge).
- La pression artérielle différentielle ou pression pulsée est définie par la différence entre le pic de pression artérielle et la pression artérielle en fin de diastole.
- Les petites artères, artérioles et sphincters précapillaires, à la différence des grosses artères, possèdent une média riche en cellules musculaires lisses leur permettant de modifier leur diamètre au cours du temps (vasomotricité).
- Le système sympathique est essentiellement vasoconstricteur via la stimulation des récepteurs alpha-1 adrénergiques.
- La microcirculation fait partie de la circulation concernée dans les échanges entre le sang et les tissus.
- La pression artérielle pulmonaire systolique est d’environ 25 mmHg et la pression artérielle diastolique est d’environ 12 mmHg (système à basse pression).
- La résistance vasculaire pulmonaire est régulée par des mécanismes passifs comprenant la distension des vaisseaux, le recrutement de nouveaux vaisseaux et des facteurs vasoconstricteurs, essentiellement vasoconstriction hypoxique.
- Face à une brèche vasculaire survient une vasoconstriction locale puis l’hémostase primaire se déclenche avec formation d’un clou plaquettaire, appelé thrombus blanc.
- Dans les vaisseaux de plus gros calibre, le clou plaquettaire est consolidé par un réseau de fibrine, issu de l’activation de la coagulation, pour donner un thrombus rouge.
- Une fois le vaisseau réparé, le thrombus (rouge) devenu inutile est détruit grâce à la fibrinolyse.
- L’hémostase primaire fait intervenir les plaquettes, des protéines plasmatiques, dont le facteur Willebrand, le fibrinogène et le vaisseau, en particulier le sous-endothélium.
- Le facteur Willebrand est une protéine multimérique produite par les mégacaryocytes et les cellules endothéliales.
- Le fibrinogène est une protéine plasmatique synthétisée par le foie dont la concentration augmente au cours de la réaction inflammatoire.
- En cas de brèche vasculaire survient d’abord une phase d’adhésion plaquettaire, puis une phase d’activation plaquettaire et, enfin, une phase d’agrégation plaquettaire, dernier événement de l’hémostase primaire.
- La membrane plaquettaire est constituée d’une bicouche phospholipidique asymétrique comme pour la majorité des cellules.
- La coagulation est le résultat de réactions enzymatiques en cascade, faisant intervenir des protéines plasmatiques et des surfaces cellulaires provenant des plaquettes, des cellules endothéliales ou des monocytes activées, aboutissant à la formation d’un thrombus.
- Le thrombus est issu de la transformation de fibrinogène soluble en fibrine insoluble.
- La thrombine est responsable de la transformation de fibrinogène en fibrine.
- Les facteurs de la coagulation sont principalement synthétisés par le foie.
- Les facteurs de la coagulation comprennent les facteurs vitamine K dépendant, les cofacteurs, les facteurs de la phase contact, les facteurs formant le thrombus, les phospholipides membranaires et les inhibiteurs de la coagulation (antithrombine, protéine C, protéine S, tissue factor pathway inhibitor ou TFPI).
- Lors d’une brèche vasculaire, la voie extrinsèque est déclenchée physiologiquement. L’étape d’amplification est indispensable et aboutit à la génération de thrombine.
- La thrombine amplifie sa propre production en activant les facteurs (F) XI et XIa (voie intrinsèque) qui active alors le facteur IX en IXa, puis le X en Xa, le X en Xa et enfin le II en thrombine.
- Ces systèmes d’auto-amplification permettent d’avoir un système d’activation de la coagulation qui peut entraîner localement, en quelques minutes, une génération explosive de la thrombine afin d’assurer une hémostase efficace.
- La thrombine, puissant activateur plaquettaire, provoque la sécrétion de prostacyclines par l’endothélium, puissant antiagrégant plaquettaire, ainsi que la protéine C, qui en présence de son cofacteur, la protéine S, est un puissant inhibiteur des cofacteurs Va et VIIIa.
- L’exploration de l’hémostase primaire repose sur le temps d’occlusion plaquettaire ou PFA.
- L’exploration de la coagulation repose sur le TCA, ou temps de céphaline plus activateur, et l’INR chez les seuls patients sous AVK.
________________________________________________________________________________
Exercices en ligne
Les exercices relatifs à ce chapitre sont disponibles en ligne à l’adresse suivante : http://www.em-consulte.com/e-complement/475848


