Suivez-nous sur les réseaux sociaux !
Publications
Chapitre 05 – Item 339 : Syndromes coronariens aigus
I. Définitions
II. Épidémiologie
III. Physiopathologie
IV. Diagnostic
V. Traitement
VI. Évolution et complications
VII. Prise en charge au long cours après hospitalisation pour un SCA
Situations de départ
4 Douleur abdominale.
42 Hypertension artérielle.
50 Malaise/perte de connaissance.
159 Bradycardie.
161 Douleur thoracique.
162 Dyspnée.
165 Palpitations.
166 Tachycardie.
185 Réalisation et interprétation d’un électrocardiogramme (ECG).
204 Élévation des enzymes cardiaques.
208 Hyperglycémie.
231 Demande d’un examen d’imagerie.
239 Explication préopératoire et recueil de consentement d’un geste invasif diagnostique ou thérapeutique.
247 Prescription d’une rééducation.
248 Prescription et suivi d’un traitement anticoagulant et/ou antiagrégant.
252 Prescription d’un hypolipémiant.
259 Évaluation et prise en charge de la douleur aiguë.
285 Consultation de suivi et éducation thérapeutique d’un patient avec un antécédent cardiovasculaire.
314 Prévention des risques liés au tabac.
316 Identifier les conséquences d’une pathologie/situation sur le maintien d’un emploi.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé |
|---|---|---|
| Définition | Connaître la définition de l’infarctus du myocarde | |
| Définition | Connaître la définition d’un syndrome coronarien aigu (SCA) non ST + et ST + | |
| Épidémiologie | Connaître la prévalence du SCA et sa mortalité | |
| Physiopathologie | Connaître la physiopathologie des SCA (NST et ST +) et de l’angor stable | |
| Diagnostic positif | Connaître les éléments de l’interrogatoire et de l’examen clinique d’une douleur angineuse et ses présentations atypiques, du SCA et de ses complications | |
| Diagnostic positif | Connaître les signes électrocardiographiques d’un SCAST + et confirmer sa localisation ; connaître les signes électrocardiographiques d’un SCANST | |
| Examens complémentaires | Connaître les indications de l’électrocardiogramme (ECG) devant toute douleur thoracique ou suspicion de SCA ; connaître les indications et interpréter le dosage de la troponine | |
| Examens complémentaires | Connaître l’apport de la coronarographie et du coroscanner | |
| Identifier une urgence | Reconnaître l’urgence et savoir appeler (SAMU-Centre 15 en extrahospitalier) en cas de douleur thoracique | |
| Prise en charge | Connaître les modalités de revascularisation coronarienne | |
| Prise en charge | Connaître les principes et stratégie thérapeutiques depuis la prise en charge par le SAMU du SCAST +, du SCANST, de l’angor stable | |
| Prise en charge | Connaître les principes de la stratégie thérapeutique au long cours devant un angor stable |
I Définitions
A Syndromes coronariens aigus
![]() L’expression clinique des syndromes coronariens aigus (SCA) est très variée.
L’expression clinique des syndromes coronariens aigus (SCA) est très variée.
Une douleur thoracique aiguë ou un équivalent, survenant dans un contexte prédisposant, justifie d’évoquer ce diagnostic.
L’électrocardiogramme (ECG) enregistré dès le premier contact avec le patient permet de définir deux entités : avec et sans sus-décalage persistant du segment ST.
1 SCA avec sus-décalage persistant du segment ST (SCAST +) ou infarctus du myocarde (IDM) avec sus-décalage persistant du segment ST (IDMST +)
La douleur thoracique est persistante depuis plus de 20 minutes. L’ECG identifie un sus-décalage du segment ST. Douleur et sus-décalage persistent après la prise de trinitrine (TNT) sublinguale.
L’origine de l’ischémie aiguë transmurale est une occlusion coronarienne aiguë par un thrombus fibrinocruorique. Le traitement repose sur une désobstruction immédiate de l’artère occluse, soit mécanique (intervention coronarienne percutanée – ICP), soit chimique par administration intraveineuse d’un fibrinolytique (FIV).
2 SCA sans sus-décalage persistant du segment ST (SCANST)
La douleur thoracique spontanée ou survenant pour des efforts modérés est de durée variable mais transitoire. L’ECG peut mettre en évidence un sous-décalage transitoire ou persistant, des anomalies de l’onde T, ou bien être normal. Un sus-décalage percritique du segment ST peut être identifié mais il régresse spontanément ou après TNT.
Dans la majorité des cas, la troponine augmente dans les suites de la crise, permettant de poser le diagnostic d’IDM sans sus-décalage persistant du segment ST (IDMNST). Lorsqu’elle n’augmente pas, le diagnostic d’angor instable est retenu.
La surveillance monitorée étroite permet le diagnostic immédiat d’une éventuelle complication (trouble du rythme ventriculaire), et de définir le délai de réalisation de la coronarographie.
B Infarctus du myocarde
L’IDM est défini par une nécrose des cardiomyocytes secondaire à une ischémie myocardique aiguë.
Le diagnostic repose sur l’association d’une élévation suivie d’une décroissance de la troponine ultrasensible (Tn-us) à l’un des critères suivants :
• symptomatologie clinique en faveur d’une ischémie myocardique aiguë ;
• apparition d’anomalies de la repolarisation ou d’une onde Q sur un ECG ;
• constatation d’une perte de myocarde viable (identifiée par imagerie par résonance magnétique nucléaire) dans un territoire présentant une réduction de sa contractilité (identifiée par échocardiographie) ;
• visualisation d’une image évocatrice de thrombus endoluminal (lors d’une coronarographie).
On distingue 5 types d’IDM :
• l’IDM de type 1 est la conséquence d’une rupture, ulcération, fissuration ou érosion d’une plaque athéromateuse induisant la formation d’un thrombus soit occlusif, soit réduisant la lumière artérielle et/ou emboligène dans la partie distale de l’artère concernée. La lésion sous-jacente est le plus souvent sévère mais elle est mineure dans 5–10 % des cas ;
• l’IDM de type 2 définit un IDM sans relation avec une éventuelle instabilité athéromateuse. Le déséquilibre entre apport et demande en oxygène du myocarde peut être la conséquence d’une hyper- ou hypotension, d’une tachy- ou bradycardie, d’une arythmie, d’une anémie ou d’une hypoxémie. Sont rattachés à cette définition le spasme coronarien, la dissection coronarienne spontanée, l’embolie coronarienne d’origine cardiaque ou aortique, la dysfonction microvasculaire coronarienne ;
• ![]() l’IDM de type 3 caractérise l’IDM compliqué d’une mort subite lorsque le dosage de la troponine n’est pas disponible ;
l’IDM de type 3 caractérise l’IDM compliqué d’une mort subite lorsque le dosage de la troponine n’est pas disponible ;
• les IDM de types 4 et 5 sont « iatrogènes », secondaires à une ICP (type 4) ou à un pontage aortocoronarien (type 5).
C Angor stable
![]() L’angor stable, nouvellement appelé syndrome coronarien chronique, n’a pas de définition propre. L’angor ou angine de poitrine est un signe d’ischémie myocardique, survenant lorsque les besoins en oxygène du cœur sont supérieurs aux apports par un défaut d’irrigation sanguine du muscle cardiaque par les artères coronaires, soit par obstruction (athérosclérose le plus souvent), soit par spasme artériel. L’angor stable survient exclusivement à l’effort, toujours lors du même type d’effort. Il peut survenir comme première manifestation de la maladie coronarienne ou secondairement chez un patient ayant présenté au préalable un évènement cornarien aigu.
L’angor stable, nouvellement appelé syndrome coronarien chronique, n’a pas de définition propre. L’angor ou angine de poitrine est un signe d’ischémie myocardique, survenant lorsque les besoins en oxygène du cœur sont supérieurs aux apports par un défaut d’irrigation sanguine du muscle cardiaque par les artères coronaires, soit par obstruction (athérosclérose le plus souvent), soit par spasme artériel. L’angor stable survient exclusivement à l’effort, toujours lors du même type d’effort. Il peut survenir comme première manifestation de la maladie coronarienne ou secondairement chez un patient ayant présenté au préalable un évènement cornarien aigu.
II Épidémiologie
![]() L’incidence européenne de l’IDMST + est évaluée entre 43 et 144/100 000 par an. Le registre suédois, plus exhaustif, donnait un chiffre de 58/100 000 en 2015.
L’incidence européenne de l’IDMST + est évaluée entre 43 et 144/100 000 par an. Le registre suédois, plus exhaustif, donnait un chiffre de 58/100 000 en 2015.
En France, plus de 60 000 personnes sont hospitalisées pour un IDM chaque année. Alors que l’incidence de l’IDMST + est en décroissance, celle de l’IDMNST croît, probablement car l’utilisation de la Tn-us permet de l’identifier plus facilement.
L’IDMST + est plus fréquent chez les sujets plus jeunes et chez les hommes.
La mortalité hospitalière de l’IDMST + varie en Europe entre 4 et 12 % et serait à un an proche de 10 %. La mortalité est plus élevée chez les patients plus âgés ou diabétiques, insuffisants rénaux, insuffisants cardiaques, présentant des antécédents d’IDM, une altération de la fonction ventriculaire gauche, une atteinte coronarienne diffuse, ou dont le délai de prise en charge est long.
Bien que la maladie coronarienne se développe chez la femme avec un retard de 7 à 10 ans par rapport à l’homme, l’IDM est une cause fréquente de décès dans cette population. Les SCA sont 4 fois plus fréquents chez l’homme avant 60 ans mais plus fréquents chez la femme après 75 ans. La symptomatologie serait plus souvent atypique chez les femmes et leur hospitalisation serait plus tardive. Bien qu’une augmentation des risques iatrogènes de la reperfusion et du traitement antithrombotique chez la femme soit évoquée, la prise charge d’un SCA doit être identique chez les deux sexes.
III Physiopathologie
Malgré des présentations cliniques différentes, les SCA partagent la même physiopathologie. La rupture ou érosion de la plaque athéromateuse vulnérable (que l’on peut comparer à un abcès) induit la formation à son contact d’un thrombus qui peut se fragmenter et migrer (embolie) dans la partie distale de l’artère concernée avec pour conséquence une diminution de la perfusion myocardique.
L’athérosclérose est une maladie chronique qui touche simultanément à des degrés divers les artères de moyen (coronaires) ou gros calibre (aorte). L’accumulation de lipides dans la paroi artérielle induit une réponse inflammatoire puis fibrotique proliférative.
La maladie coronarienne peut schématiquement évoluer de deux manières (cf. item 221 – chapitre 1) :
• la réduction progressive sur plusieurs années de la lumière artérielle (athérosclérose) à l’origine de l’angor stable ;
• la rupture brutale imprévisible d’une plaque d’athérome instable et l’expression de la thrombose associée (accident athérothrombotique) sous la forme d’un SCA.
L’identification d’un SCA permet d’en prévenir le risque principal qui est la mort subite rythmique, conséquence de l’ischémie myocardique aiguë. La compréhension de la physiopathologie est la base du traitement d’un SCA.
A Sténose athérothrombotique
La plaque d’athérome vulnérable est composée d’un cœur lipidique entouré par une fine chape fibreuse. Le cœur lipidique est nécrotique, renferme des cellules musculaires lisses provenant de la média et des cellules inflammatoires. La chape est constituée en grande partie de collagène de type I.
La plaque vulnérable peut se rompre ou simplement se fissurer (érosion) et induire la formation à son contact d’un thrombus. Un thrombus de petite taille, riche en plaquettes (thrombus blanc), non occlusif, est à l’origine d’un SCANST. Le thrombus peut être volumineux, fibrinocruorique (thrombus rouge), et occlure la lumière artérielle à l’origine d’un SCAST +.
Le thrombus peut régresser du fait d’une fibrinolyse physiologique, puis à nouveau augmenter de volume. Il peut se fragmenter et migrer en aval de la lésion dans les artérioles et les capillaires distaux, induisant la nécrose de territoires myocardiques de petite taille à l’origine d’une élévation de la troponine.
B Ischémie myocardique aiguë
Elle survient lorsque les apports ne compensent pas la demande en oxygène du myocarde. Elle peut être responsable de troubles du rythme ventriculaire mortels (morts subites par fibrillation ventriculaire).
La constitution d’une sténose athérothrombotique induit une diminution brutale des apports. Cette sténose est dynamique. En effet, la libération par les plaquettes activées de substances prothrombotiques et vasoconstrictrices (sérotonine, thromboxane A2, ADP [adénosine diphosphate]), favorise sa majoration paroxystique et la survenue d’épisodes ischémiques transitoires.
Une occlusion coronarienne aiguë totale est à l’origine d’une ischémie transmurale dont la traduction ECG est un sus-décalage du segment ST. Lorsqu’elle est secondaire à une vasoconstriction, elle régresse rapidement ou sous l’effet de l’administration d’un vasodilatateur (trinitrine), se traduisant par une régression du sus-décalage du segment ST (angor de Prinzmetal, SCANST). Lorsqu’elle est la conséquence d’une thrombose occlusive, elle persiste malgré l’administration d’un vasodilatateur (SCAST + ou IDMST +).
Des facteurs surajoutés peuvent favoriser l’ischémie myocardique, par :
• augmentation de la consommation myocardique en oxygène : hyperthermie, tachycardie, tachyarythmie, hyperthyroïdie, émotion ou toute cause d’hyperadrénergie, augmentation de la post-charge ventriculaire gauche (poussée hypertensive, sténose valvulaire aortique) ;
• diminution des apports en oxygène du myocarde : anémie, hypoxémie, méthémoglobinémie (secondaire à une consommation de poppers par exemple).
C Patient vulnérable et facteurs déclenchants
Chez un patient présentant un SCA, l’instabilité artérielle n’est pas limitée à la seule plaque rompue. Elle touche l’ensemble de l’arbre artériel justifiant un traitement médicamenteux dont l’effet est multifocal (aspirine par exemple).
Les facteurs de vulnérabilité (risque d’instabilité) sont en particulier l’hypercholestérolémie, l’intoxication tabagique, l’hyperfibrinémie.
Un exercice physique violent, un manque de sommeil, un excès alimentaire ou une infection aiguë peuvent être des facteurs déclenchants d’un accident coronarien.
D Sténose athérosléreuse (fixe)
La plaque athéromateuse est constituée d’un amas cellulaire nécrotique entouré d’une capsule fibreuse. Elle peut être assimilée à un abcès développé dans la paroi artérielle. Initialement, elle n’induit pas de réduction de calibre de la lumière artérielle du fait d’un remodelage excentrique compensateur de la paroi qui s’épaissit.
L’abcès peut se rompre ou se fissurer à l’origine d’un SCA.
L’abcès peut cicatriser. Fibrose et calcification favorisent la rétraction de l’artère et la réduction progressive du calibre de sa lumière. La sténose fibreuse stable et fixe est la cause principale de l’angor stable.
E Ischémie myocardique inductible (d’effort)
L’ischémie myocardique traduit un déséquilibre entre les apports et les besoins en oxygène du myocarde. Elle induit de manière chronologique :
• une augmentation de la concentration en H+ et K+ dans le sang veineux drainant le territoire ischémique ;
• une anomalie de la cinétique segmentaire du ventricule gauche en diastole puis en systole ;
• des modifications ECG du segment ST et de l’onde T ;
• une douleur thoracique (favorisée par la libération de métabolites de l’ischémie qui stimulent les terminaisons nerveuses) qui peut être absente pour des raisons non élucidées.
La tachycardie, l’augmentation de l’inotropisme (force contractile) myocardique et l’élévation de la pression artérielle augmentent la consommation en oxygène du myocarde (effort).
La réduction fixe du calibre d’une artère coronaire (sténose fibreuse) réduit son débit et les apports en oxygène au segment myocardique qu’elle vascularise.
Lors de l’effort, la vasodilatation du réseau capillaire en aval de la sténose réduit les résistances à l’écoulement sanguin et retarde l’apparition de l’ischémie.
![]() Une sténose est classiquement susceptible d’induire une ischémie d’effort lorsqu’elle réduit d’au moins 70 % le calibre de l’artère coronaire.
Une sténose est classiquement susceptible d’induire une ischémie d’effort lorsqu’elle réduit d’au moins 70 % le calibre de l’artère coronaire.
Cette dernière notion est en fait remise en cause car l’ischémie n’est pas toujours proportionnelle à la sévérité des lésions angiographiques.
IV Diagnostic
A Présentation clinique
1 Symptômes suspects
![]() La douleur angineuse typique est rétrosternale en barre, constrictive, à type de pression ou de poids. Elle irradie vers le bras gauche, les deux bras ou le bras droit, le cou, la mâchoire. Elle peut être intermittente, le plus souvent prolongée durant quelques minutes, ou persistante. Elle peut être associée à une sudation, des nausées, une gêne épigastrique, une dyspnée ou un malaise lipothymique, voire une syncope.
La douleur angineuse typique est rétrosternale en barre, constrictive, à type de pression ou de poids. Elle irradie vers le bras gauche, les deux bras ou le bras droit, le cou, la mâchoire. Elle peut être intermittente, le plus souvent prolongée durant quelques minutes, ou persistante. Elle peut être associée à une sudation, des nausées, une gêne épigastrique, une dyspnée ou un malaise lipothymique, voire une syncope.
La présentation clinique peut être atypique : par le siège des douleurs (la douleur peut être également épigastrique ou absente, la symptomatologie pouvant mimer une indigestion), se limiter aux irradiations (bras, mâchoire), son type (brûlure thoracique), sa faible intensité, ou se limiter à une dyspnée ou une asthénie.
Une présentation atypique est plus fréquente chez les patients âgés, de sexe féminin, diabétiques, insuffisants rénaux ou atteints d’une démence.
L’exacerbation des symptômes lors d’un effort physique et leur régression à l’arrêt de l’effort est en faveur d’une origine ischémique myocardique.
La régression des symptômes après la prise de trinitrine sublinguale est évocatrice mais non spécifique.
2 Critères cliniques en faveur d’une instabilité
Une douleur angineuse persistante non résolutive après administration de trinitrine sublinguale est en faveur du diagnostic de SCAST + (ou IDMST +). Le diagnostic doit être immédiatement confirmé par la réalisation d’un ECG (12 ou 18 dérivations).
Sont en faveur d’un SCANST :
• une douleur thoracique spontanée prolongée (> 20 minutes) ;
• une douleur angineuse inaugurale récente (< 1 mois) survenant à l’effort pour des efforts modérés (classes II ou III de la classification CCS – Canadian Cardiovascular Society) ;
• l’aggravation récente d’un angor d’effort (angor crescendo) ;
• l’apparition d’un angor au décours d’un IDM.
3 Facteurs de risque de survenue d’un accident coronarien
La mise en évidence d’un terrain à risque cardiovasculaire accroît la probabilité diagnostique. Sont particulièrement exposés les patients plus âgés, de sexe masculin, tabagiques, rapportant une hérédité coronarienne, présentant un diabète, une dyslipidémie, une hypertension artérielle, une insuffisance rénale chronique, ou qui ont déjà été identifiés comme ayant une coronaropathie, une artériopathie périphérique ou une atteinte des troncs supra-aortiques.
4 Facteurs favorisant la déstabilisation
Certaines circonstances peuvent favoriser l’apparition d’un SCA comme une anémie, une infection, un syndrome inflammatoire, une hyperthermie, une poussée hypertensive, un accès de colère, une émotion forte ou un dérèglement métabolique ou endocrine comme l’hyperthyroïdie, une anesthésie générale, une intervention chirurgicale.
5 Angor
Angor typique
Il est décrit comme une douleur de siège rétrosternal en barre, d’un pectoral à l’autre (le patient montre sa poitrine du plat de la main), parfois verticale, plus rarement précordiale. Elle peut irradier dans les deux épaules, les avant-bras, les poignets et les mâchoires, parfois dans le dos. Elle est constrictive (sensation « de poitrine serrée dans un étau »), angoissante (angor). Son intensité est variable : de la simple gêne thoracique à la douleur insoutenable, syncopale. Elle est provoquée par l’effort. Elle cède très rapidement à l’arrêt de l’effort ou après la prise de trinitrine sublinguale.
L’angor est stable lorsque la douleur survient exclusivement à l’effort et toujours pour le même type d’effort. Cette notion de stabilité est parfois difficile à affirmer a priori, notamment en cas d’angor de novo, qui doit être considéré comme un SCA jusqu’à preuve du contraire.
La sévérité de l’angor est classiquement par ailleurs définie par la Société canadienne de cardiologie (CCS) (cf. tableau 5.1).
Autres présentations cliniques
La douleur angineuse peut être atypique par son siège épigastrique ou limitée aux irradiations.
Il peut s’agir d’une blockpnée d’effort, impossibilité de vider l’air lors de l’expiration, qui est un équivalent parfois difficile à différencier de la dyspnée.
Les palpitations d’effort peuvent traduire l’existence d’un trouble du rythme d’origine ischémique.
Les manifestations d’insuffisance ventriculaire gauche peuvent être observées si l’ischémie est étendue.
L’ischémie myocardique inductible par l’effort peut être indolore (silencieuse), habituellement détectée lors d’un test fonctionnel de dépistage, ou dans le cadre du suivi d’un patient coronarien.
Dans tous les cas, la survenue des signes à l’effort et leur disparition à l’arrêt de l’effort ont une grande valeur diagnostique.
Tableau 5.1. ![]() Classification de l’angor en fonction de sa sévérité (Canadian Cardiovascular Society – CCS).
Classification de l’angor en fonction de sa sévérité (Canadian Cardiovascular Society – CCS).
| Classe 1 | Activités quotidiennes non limitées. L’angor survient lors d’efforts soutenus, abrupts ou prolongés. |
| Classe 2 | Limitation discrète lors des activités quotidiennes. L’angor survient à la marche rapide ou en côte (lors de la montée rapide d’escaliers), en montagne, après le repas, par temps froid, lors d’émotions, au réveil. |
| Classe 3 | Limitation importante de l’activité physique. L’angor survient au moindre effort (marche à plat sur une courte distance, 100 à 200 m, ou lors de l’ascension à pas lents de quelques escaliers). |
| Classe 4 | Impossibilité de mener la moindre activité physique sans douleur. |
Patient à risque
L’identification de facteurs de risque de maladie coronarienne renforce l’hypothèse diagnostique en particulier lorsque la symptomatologie est atypique.
• Facteurs de risque d’athérome : âge, sexe masculin, hérédité précoce au 1er degré, tabagisme actif, dyslipidémie, HTA, diabète, excès pondéral.
• Athérome connu : antécédents coronariens, lésions des troncs supra-aortiques ou des artères des membres inférieurs.
B Examen physique
L’examen physique est habituellement sans particularité en l’absence de complication.
Il est néanmoins nécessaire de rechercher des manifestations d’insuffisance cardiaque congestive et un souffle systolique (cf. VI. Évolution et complications).
Il permet d’orienter vers une autre cause cardiovasculaire ou extra-cardiaque à la symptomatologie, et comprend la mesure de la pression artérielle aux deux bras (cf. D. Diagnostic différentiel).
Si un angor est suspecté, l’examen clinique est le plus souvent négatif mais recherche :
• un souffle aortique faisant évoquer une sténose aortique qui peut être responsable d’un angor en l’absence de lésion coronarienne ;
• un souffle vasculaire (carotides, fémorales, etc.) qui témoigne d’une autre localisation de la maladie athéroscléreuse ;
• une hypertension artérielle ;
• un excès pondéral.
C Examens complémentaires
1 Électrocardiogramme
L’ECG 12 dérivations doit être pratiqué sans délai dès lors que le diagnostic de SCA est suspecté, soit au domicile lorsque le patient ou son entourage ont contacté le centre 15, soit dans les 10 minutes suivant l’admission en service d’accueil des urgences (SAU) lorsque le patient s’y présente spontanément ou y est adressé par une ambulance non médicalisée. Outre son intérêt diagnostique, il permet de détecter une arythmie ventriculaire susceptible de se dégrader rapidement en tachycardie ou fibrillation ventriculaire (TV ou FV).
En cas d’angor, l’ECG est le plus souvent normal. Il peut mettre en évidence une onde Q de nécrose ancienne, une hypertrophie ventriculaire gauche par exemple chez l’hypertendu, ou un trouble de la conduction intracardiaque indépendant type bloc de branche.
SCAST + : sus-décalage persistant du segment ST et équivalents
Chez un patient présentant une douleur angineuse persistante, l’ECG percritique confirme l’occlusion coronarienne aiguë lorsqu’il met en évidence, dans au moins deux dérivations contiguës, un sus-décalage (onde de Pardee), classiquement convexe vers le haut, du segment ST supérieure ou égale à 2 mm (≥ 2,5 mm chez les hommes de moins de 40 ans, ≥ 1,5 mm chez les femmes) en V2-V3, supérieure ou égale à 1 mm dans les autres dérivations, en l’absence de bloc de branche gauche ou d’hypertrophie ventriculaire gauche (cf. fig. 5.1).
Lorsque le sus-décalage est identifié en dérivations inférieures (D2, D3, VF), un sus-décalage doit être recherché en dérivations droites (V3R, V4R) en faveur d’une extension de l’infarctus au ventricule droit (cf. fig. 5.2).
Fig. 5.1. ![]() Électrocardiogramme d’un infarctus du myocarde antérieur
Électrocardiogramme d’un infarctus du myocarde antérieur
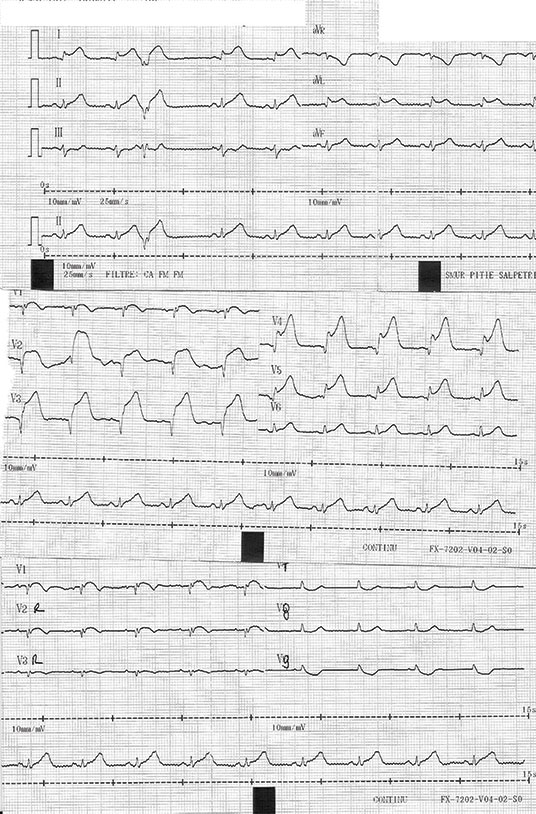
A. Électrocardiogramme (ECG) 12 dérivations avec sus-décalage de ST en D2D3aVf associé à une petite onde Q avec sus-décalage en miroir en D1aVl et de V2 à V6. B. ECG du même patient avec les dérivations droites V3R et V4R et postérieures V7V8V9 : on observe aussi un sous-décalage de ST faisant suspecter une extension au ventricule droit. C. ECG du même patient après intervention coronarienne percutanée : régression du sus-décalage de ST.
Un sous-décalage du segment ST en dérivations antérieures (V1-V3) chez un patient décrivant un angor (ou équivalent) persistant justifie d’enregistrer des dérivations postérieures (V7-V9). Un sus-décalage du segment ST supérieur ou égal à 0,5 mm dans ces dérivations confirme le diagnostic. Le sous-décalage antérieur est alors considéré comme une « image en miroir ».
Blocs de branche et stimulation ventriculaire
Si la suspicion clinique est forte (angor persistant), la présence d’un bloc de branche gauche (BBG), qu’il soit récent ou non, doit être considérée comme équivalent d’un sus-décalage du segment ST. À l’inverse, l’identification d’un BBG supposé récent dans un contexte non évocateur (patient asymptomatique lors de l’enregistrement) n’a pas de valeur diagnostique.
Le bloc de branche droit (BBD), marqueur de pronostic péjoratif lorsqu’il est associé à ischémie myocardique (parce que souvent en lien avec une atteinte du territoire antérieur), doit également être considéré comme équivalent d’un sus-décalage du segment ST.
La stimulation ventriculaire (pacemaker) ne permet pas d’identifier un sus-décalage du segment ST.
| D’une manière générale, lorsqu’un patient présente une symptomatologie angineuse prolongée persistante, ou équivalent, et que l’ECG n’est pas contributif, une coronarographie doit être réalisée le plus rapidement possible. Lorsque l’examen clinique évoque en premier lieu un diagnostic différentiel en 1re intention (tako-tsubo dans un contexte de stress, myocardite ou péricardite au décours d’un épisode infectieux), cet examen reste indiqué en urgence dès lors que le patient présente un terrain à risque d’accident coronarien (âge, sexe, facteurs de risque, antécédents vasculaires) pour ne pas passer à côté du diagnostic. |
SCANST : absence de sus-décalage persistant du segment ST
L’ECG post-critique est normal chez plus de 30 % des patients admis pour un SCANST.
Les anomalies ECG en faveur du diagnostic sont le sous-décalage du segment ST, le sus-décalage transitoire et les anomalies de l’onde T (cf. fig. 5.3 et fig. 5.4).
La comparaison avec un tracé ECG antérieur peut aider au diagnostic.
L’ECG doit être enregistré dès la prise en charge du patient bien qu’il soit le plus souvent asymptomatique, et renouvelé si la douleur récidive ou à titre systématique 1 à 2 heures plus tard à la recherche d’une modification par comparaison à l’ECG initial.
Fig. 5.3. ![]() Électrocardiogramme avec ondes T négatives en antéro-septo-apical de V1 à V4.
Électrocardiogramme avec ondes T négatives en antéro-septo-apical de V1 à V4.
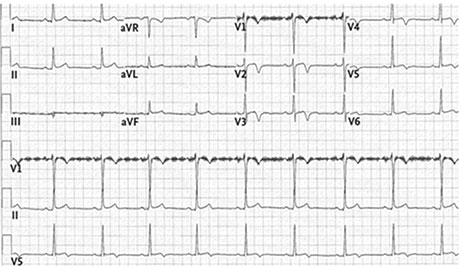
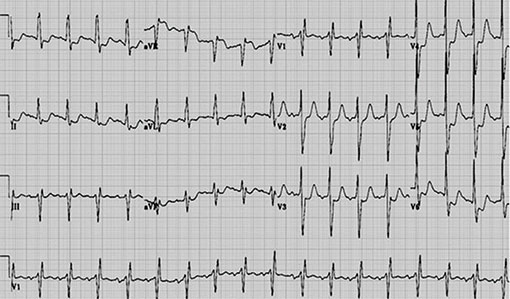
Fig. 5.4. ![]() Électrocardiogramme avec sous-décalage du segment ST en D1aVl et de V4 à V6.
Électrocardiogramme avec sous-décalage du segment ST en D1aVl et de V4 à V6.
Blocs de branche et stimulation ventriculaire
La présence d’un BBG est sans valeur diagnostique si le patient est asymptomatique lors de l’enregistrement de l’ECG.
En présence d’un BBD, chez un patient symptomatique, la mise en évidence d’un sous-décalage du segment ST en D1-VL et V5-V6 est en faveur d’un SCANST.
Chez près de la moitié des patients porteurs d’un bloc de branche, gauche ou droit, hospitalisés pour douleur thoracique suspecte, le diagnostic final est un SCA.
L’ECG n’apporte pas d’aide au diagnostic en cas de stimulation ventriculaire.
2 Troponine
| C’est un marqueur essentiel pour confirmer le diagnostic d’un IDMNST. |
Le dosage de la troponine n’a pas sa place dans la stratégie diagnostique et thérapeutique du SCAST +.
À l’inverse, c’est un marqueur biologique indispensable pour confirmer le diagnostic d’un IDMNST et en évaluer le risque à court terme (pronostic).
La Tn-us est plus sensible et spécifique d’une lésion des cardiomyocytes que la créatinine-kinase (CK), son isoenzyme (CK-MB) ou la myoglobine. Son élévation est par ailleurs précoce par rapport au début des symptômes.
Lorsque le contexte clinique est évocateur d’ischémie myocardique aiguë, l’élévation dynamique (croissance ou décroissance) de la Tn-us au-delà du seuil de normalité défini est en faveur d’un IDM.
Habituellement, la Tn-us croît rapidement dans l’heure qui suit la crise angineuse et demeure élevée durant plusieurs jours.
Cependant, la valeur diagnostique de ce marqueur est limitée car son élévation peut être observée dans de nombreuses situations autres qu’un SCA : tachyarythmie, insuffisance cardiaque, poussée hypertensive, urgence vitale, myocardite, valvulopathie, embolie pulmonaire, dissection aortique, tako-tsubo, etc.
![]() D’autres biomarqueurs ont été proposés mais leur utilisation est marginale, comme la copeptine, peu spécifique.
D’autres biomarqueurs ont été proposés mais leur utilisation est marginale, comme la copeptine, peu spécifique.
• La sensibilité des CK-MB (enzymes libérées par le myocyte nécrosé) est insuffisante pour permettre un diagnostic précoce, mais sa décroissance étant plus rapide que celle de la troponine, une réascension, dans un contexte clinique évocateur (récidive angineuse) plaide en faveur d’une récidive d’IDM.
• L’élévation du BNP, marqueur d’une insuffisance ventriculaire gauche, n’a qu’une valeur pronostique.
| Algorithme décisionnel : confirmer/récuser rapidement le diagnostic
Pour confirmer le diagnostic Pour récuser le diagnostic |
3 Autres données biologiques
Un bilan standard est justifié incluant glycémie, bilan lipidique, créatininémie et numération formule sanguine. Il permet d’identifier un terrain à risque et des anomalies dont il faut tenir compte lors de la prescription d’examens paracliniques ou de traitements médicamenteux.
4 Échocardiographie transthoracique
L’échocardiographie transthoracique (ETT) est le plus souvent normale, elle a surtout pour objectif d’identifier une pathologie associée (valvulopathie), une hypertrophie myocardique, d’évaluer la fraction d’éjection ventriculaire gauche (normale > 60 %), et éventuellement de rechercher des troubles de cinétique segmentaire pouvant évoquer un antécédent de nécrose myocardique passé inaperçu.
5 Examens paracliniques fonctionnels
Principes généraux
Ces examens sont habituellement réalisés à visée diagnostique en cas de suspicion d’un angor stable. Ils sont habituellement contre-indiqués en cas de SCA récent.
L’effort ou l’administration de médicaments augmentant la fréquence et l’inotropisme (puissance de contraction) cardiaque révèle le déséquilibre entre apport et consommation en oxygène du myocarde. Les tests fonctionnels reposent sur ce principe.
Un examen de qualité technique optimal peut être faussement positif ou faussement négatif. L’indication et l’interprétation justifient une évaluation préalable de la probabilité que le patient concerné présente une maladie coronarienne. Elle dépend de son âge, de son sexe et des caractéristiques de la douleur. La probabilité est forte chez un homme de plus de 40 ans décrivant un angor d’effort typique et faible chez une femme de moins de 50 ans rapportant des précordialgies atypiques.
Le choix du test est influencé par sa sensibilité et sa spécificité.
Électrocardiogramme d’effort (cf. fig. 5.5)
Fig. 5.5. ![]() Mise en évidence d’une ischémie myocardique par l’électrocardiogramme d’effort (sur bicyclette ou tapis roulant).
Mise en évidence d’une ischémie myocardique par l’électrocardiogramme d’effort (sur bicyclette ou tapis roulant).
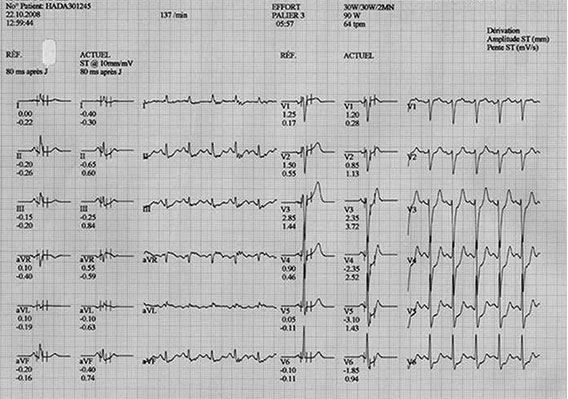
Dans cet exemple, noter le sous-décalage de ST en V5 qui atteint 3,1 mm avec une pente faiblement positive de 1,43 mV/s. Ce test est considéré comme positif.
Principe
![]() L’ischémie myocardique induit des modifications de l’ECG et en particulier du segment ST.
L’ischémie myocardique induit des modifications de l’ECG et en particulier du segment ST.
Réalisation
L’examen consiste à faire pratiquer un effort d’intensité croissante sur bicyclette ou tapis roulant. La surveillance est clinique (douleur thoracique, dyspnée), tensionnelle et électrocardiographique (12 dérivations enregistrées).
La charge augmente progressivement (toutes les 2–3 minutes : soit en actionnant un frein sur le pédalier de la bicyclette, soit en augmentant la vitesse et la pente du tapis roulant) suivant un protocole préétabli (protocole de Bruce). La charge appliquée est exprimée en watts dans le premier cas et en MET (multiples de la consommation en oxygène au repos) dans le second.
Les critères d’arrêt de l’épreuve d’effort sont les suivants :
• mauvaise tolérance (dyspnée majeure, angor typique, hypotension) ;
• pression artérielle systolique > 210 mmHg ;
• identification par l’ECG d’un trouble du rythme ventriculaire répétitif ;
• fréquence cardiaque maximale théorique atteinte = (220 – âge du patient) ;
• résultat positif.
Interprétation
L’épreuve d’effort est dite positive si un sous-décalage du segment ST supérieur à 1 mm horizontal ou descendant apparaît, associé ou non à une douleur thoracique ou équivalent.
Elle permet d’évaluer la tolérance de l’ischémie (PA, troubles du rythme ventriculaire), son seuil de positivité. Ainsi, l’apparition d’une ischémie pour un faible niveau d’effort, une chute tensionnelle, la survenue de troubles du rythme ventriculaire témoignent le plus souvent d’une ischémie étendue (atteinte pluritronculaire et/ou du tronc commun).
Limites
• L’examen est interprétable lorsque l’ECG de repos est anormal (bloc de branche, pacemaker).
• La sensibilité et la spécificité de l’ECG d’effort sont inférieures à celles des autres examens fonctionnels (scintigraphie, échographie ou IRM de stress). Cet examen est donc de moins en moins pratiqué à visée diagnostique.
Contre-indications absolues
• IDM récent < 48 heures ou SCA non stabilisé.
• Sténose connue du tronc coronaire.
• Rétrécissement aortique serré symptomatique.
• Troubles du rythme ventriculaire ou de la conduction non contrôlés.
• Insuffisance cardiaque non contrôlée.
• Embolie pulmonaire récente.
• Myocardite aiguë, etc.
Avantage
L’examen est peu coûteux.
Tomoscintigraphie myocardique de perfusion d’effort ou équivalent (injection de dipyridamole) (cf. fig. 5.6)
Fig. 5.6. ![]() Mise en évidence d’une ischémie myocardique par la scintigraphie myocardique au thallium, sensibilisée par injection de Persantine® (dipyramidole).
Mise en évidence d’une ischémie myocardique par la scintigraphie myocardique au thallium, sensibilisée par injection de Persantine® (dipyramidole).
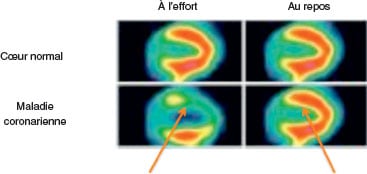
Les acquisitions sont faites à l’effort puis au repos. Le code de couleur rouge indique une fixation normale du radiotraceur ; le code de couleur jaune indique une ischémie. Cet examen permet par ailleurs de localiser et préciser l’étendue de l’ischémie. Une hypofixation du traceur à l’effort se normalisant au repos traduit une ischémie. Une hypofixation du traceur à l’effort et au repos traduit une nécrose.
Principe
![]() L’examen consiste à étudier la perfusion myocardique à l’aide d’un traceur isotopique injecté par voie IV au maximum d’un effort et en récupération. Ce traceur (le plus souvent thallium 201) a la propriété de se fixer au niveau du myocarde fonctionnel plus ou moins rapidement selon que la vascularisation est normale ou réduite. Une diminution de la captation du traceur au niveau d’un territoire myocardique au cours de l’effort traduit une baisse de la perfusion.
L’examen consiste à étudier la perfusion myocardique à l’aide d’un traceur isotopique injecté par voie IV au maximum d’un effort et en récupération. Ce traceur (le plus souvent thallium 201) a la propriété de se fixer au niveau du myocarde fonctionnel plus ou moins rapidement selon que la vascularisation est normale ou réduite. Une diminution de la captation du traceur au niveau d’un territoire myocardique au cours de l’effort traduit une baisse de la perfusion.
Réalisation
![]() Une gammacaméra permet l’acquisition d’images représentant différentes coupes du ventricule gauche (coupes longitudinale, transversale, sagittale). Une première série d’images est enregistrée immédiatement après l’effort maximal et une seconde au repos 4 heures plus tard.
Une gammacaméra permet l’acquisition d’images représentant différentes coupes du ventricule gauche (coupes longitudinale, transversale, sagittale). Une première série d’images est enregistrée immédiatement après l’effort maximal et une seconde au repos 4 heures plus tard.
Interprétation
Le ventricule gauche est divisé en 17 segments. La comparaison des 2 séries d’images permet d’identifier les segments normaux (fixation normale à l’effort et en récupération), les segments ischémiques (diminution de la fixation à l’effort, normalisation en récupération) et les zones nécrotiques (absence de captation à l’effort et en récupération).
Limites
L’existence d’un BBG rend l’interprétation de la scintigraphie d’effort aléatoire.
L’obésité induit également fréquemment des images artefactuelles.
Il s’agit d’un examen plus coûteux que l’épreuve d’effort et irradiant pour le patient.
Avantages
La sensibilité et la spécificité sont supérieures à celles de l’épreuve d’effort. L’injection de dipyridamole (vasodilatateur favorisant une redistribution de la vascularisation vers les territoires normoperfusés) est une alternative (ou un complément) à l’effort lorsqu’il ne peut être réalisé ou est insuffisant mais elle est contre-indiquée chez l’asthmatique.
La scintigraphie permet de localiser et d’évaluer l’étendue de l’ischémie myocardique.
Échocardiographie d’effort ou équivalent (échocardiographie de stress sous dobutamine) (cf. vidéo 5.1)
Principe
L’examen consiste à étudier la cinétique et de l’épaississement pariétal des différents segments du ventricule gauche au repos et au cours du stress (effort ou dobutamine).
Réalisation
L’analyse est réalisée par échocardiographie en plusieurs incidences au repos et au cours de l’effort.
Interprétation
Le ventricule gauche est divisé en 17 segments. Une diminution (hypokinésie, akinésie) de la cinétique ou de l’épaississement pariétal d’un segment myocardique au cours de l’effort qui s’améliore au repos suggère une ischémie et donc une baisse de la perfusion dans ce segment.
Limites
Le résultat est très dépendant de l’expérience de l’opérateur.
Avantages
La sensibilité et la spécificité sont supérieures à celles de l’épreuve d’effort et voisines de celles de la scintigraphie. L’examen ne justifie pas l’injection d’un marqueur radioactif. L’administration intraveineuse de dobutamine (inotrope positif qui augmente la fréquence cardiaque et la contractilité du cœur) peut être une alternative à l’effort s’il n’est pas réalisable (trouble locomoteur, AOMI). Le coût est très inférieur à celui d’un examen isotopique.
Imagerie par résonance magnétique nucléaire (IRM) de stress
Principe
L’apparition de trouble de cinétique segmentaire ou d’une anomalie de perfusion est évaluée au cours d’un stress (soit après injection d’adénosine ou de dobutamine).
Réalisation
L’effort n’étant pas envisageable sur une table d’IRM, il est remplacé par l’administration de dobutamine pour analyser la cinétique ou d’adénosine pour évaluer la perfusion. L’acquisition des images est faite en début et fin d’examen.
Interprétation
Elle suit les mêmes modalités que l’échocardiographie et la scintigraphie.
Limites
La disponibilité des plateaux technique est limitée. Les contre-indications sont celles de l’épreuve d’effort et celles de l’IRM.
Avantages
L’IRM peut suppléer à l’échocardiographie lorsqu’elle n’est pas réalisable (patient anéchogène) et à la scintigraphie lorsque l’injection d’adénosine est contre-indiquée et l’effort non réalisable. L’examen ne justifie pas l’injection d’un marqueur radioactif.
Coronarographie (cf. fig. 5.7, vidéos 5.2, 5.3, 5.4 et 5.5)
Fig. 5.7. ![]() Coronarographie retrouvant une sténose de l’artère interventriculaire antérieure moyenne (A–C) et une coronaire droite angiographiquement normale (D).
Coronarographie retrouvant une sténose de l’artère interventriculaire antérieure moyenne (A–C) et une coronaire droite angiographiquement normale (D).
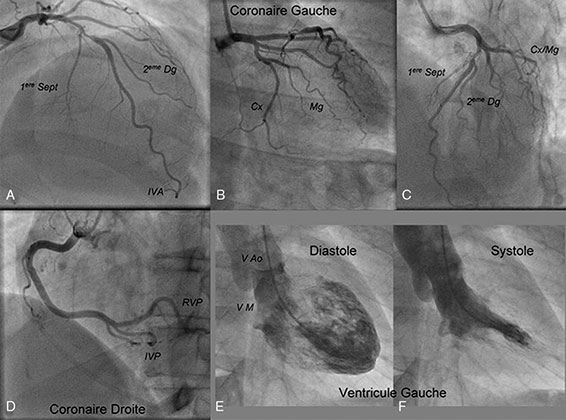
L’examen est ici complété par une ventriculographie (E–F) à la recherche de trouble de la cinétique segmentaire et permettant de calculer la fraction d’éjection ventriculaire gauche.
Principe
![]() Elle identifie directement une sténose coronarienne. L’injection d’un produit de contraste dans l’artère permet d’obtenir une image correspondant à un moulage de la lumière artérielle (luminographie).
Elle identifie directement une sténose coronarienne. L’injection d’un produit de contraste dans l’artère permet d’obtenir une image correspondant à un moulage de la lumière artérielle (luminographie).
Réalisation
L’examen est pratiqué dans une salle de cardiologie interventionnelle et dans des conditions d’asepsie rigoureuse. Le patient est installé sur une table d’angiographie disposant d’un capteur rotatif permettant l’acquisition d’images en plusieurs incidences. Sous anesthésie locale, une ponction artérielle est pratiquée (le plus souvent radiale). Un cathéter est introduit et avancé dans l’arbre artériel jusqu’à l’ostium coronaire. La forme du cathéter est adaptée à l’artère analysée, gauche ou droite. Après administration d’un dérivé nitré (vasodilatation coronarienne), un produit de contraste iodé est injecté de manière sélective. L’enregistrement est pratiqué du début de l’injection à la vidange complète de l’artère dans le système veineux coronarien. Il est renouvelé dans plusieurs incidences. La ou les sténoses sont identifiées et évaluées en pourcentage de réduction du diamètre artériel rapporté au diamètre de référence d’amont.
Limites
L’examen est invasif et expose aux complications rénales (chez l’insuffisant rénal ou le diabétique), anaphylactiques (allergie dépistée par l’interrogatoire) liées aux produits de contraste iodés, infectieuses (locales), vasculaires (hématome, dissection, ischémie périphérique), emboliques (cérébrale ou périphérique) et rythmiques. La prévention justifie le respect de conditions d’asepsie strictes (champ opératoire), et les complications peuvent être réduites par l’expérience de l’opérateur, l’utilisation de sondes de cathéters de petit calibre et l’abord artériel radial plutôt que fémoral. Les troubles du rythme ventriculaire peuvent justifier une cardioversion immédiate. Chez l’insuffisant rénal, une hyperhydratation préalable à l’examen et la réduction du volume ou du nombre d’injections de produit de contraste sont préconisées.
Avantages
La coronarographie visualise la sténose responsable de l’angor. Lorsque sa sévérité angiographique est incertaine (notamment en l’absence de test de dépistage d’ischémie ou si les résultats sont incertains), l’examen peut être complété par un test fonctionnel invasif, l’étude de la FFR. Un guide muni d’un capteur de pression est poussé au-delà de la sténose. La pression en amont est obtenue par le cathéter porteur. L’injection d’un dérivé nitré et d’adénosine, en dilatant l’artère et les capillaires (diminution des résistances périphériques), reproduit les conditions d’effort. Les pressions sont alors enregistrées en aval et en amont de la sténose. La FFR est le rapport pression distale sur proximale. Elle est positive (sténose critique induisant une ischémie à l’effort) si inférieure à 0,8. La coronarographie peut être suivie du traitement de la sténose par une intervention coronarienne percutanée.
Scanner coronarien ou coroscanner (cf. fig. 5.8)
Principe
![]() Comme la coronarographie, il identifie la sténose et permet de plus une analyse de la plaque athéromateuse (pariétographie).
Comme la coronarographie, il identifie la sténose et permet de plus une analyse de la plaque athéromateuse (pariétographie).
Réalisation
Il s’agit d’un angioscanner mais les acquisitions sont couplées à un ECG de surface après ralentissement éventuel de la fréquence cardiaque (administration d’un bêtabloquant). Le produit de contraste est injecté par voie veineuse. Les séquences sont acquises en télédiastole. Les images brutes sont reconstruites à l’aide d’un logiciel dédié qui permet d’individualiser l’arbre coronarien. La sténose identifiée est mesurée.
Limites
L’examen est difficilement interprétable si la fréquence cardiaque est trop rapide ou irrégulière (fibrillation atriale), si les artères coronaires sont calcifiées, en particulier en regard de la sténose. Les artères de petit calibre (distales) sont plus difficilement analysables. Il impose une irradiation dont il faut tenir compte en particulier chez les femmes (risque mammaire). Il est par ailleurs difficile d’évaluer la présence ou non d’une sténose à l’intérieur d’un stent. L’examen est en revanche très performant pour évaluer la perméabilité d’un pontage coronarien.
Avantages
C’est un examen peu invasif qui peut être utile lorsque les tests fonctionnels sont douteux ou non réalisables. Il a surtout une excellente valeur prédictive négative.
D Diagnostic différentiel
![]() Le diagnostic d’une précordialgie aiguë est abordé dans l’item 230 (chapitre 6).
Le diagnostic d’une précordialgie aiguë est abordé dans l’item 230 (chapitre 6).
Chez des individus non sélectionnés se présentant dans un SAU avec une douleur thoracique, la prévalence attendue de la maladie est la suivante : 5–10 % IDMST +, 15–20% IDMNST, 10 % angor instable, 15 % autres affections cardiaques, 50 % affections non cardiaques.
Par ailleurs, la coronarographie peut identifier un mécanisme particulier du SCA, parfois suspectée par le contexte et pouvant justifier une prise en charge spécifique.
1 Accidents cardiovasculaires non coronariens
• Dissection aortique.
• Embolie pulmonaire.
• Myocardite/péricardite.
• Syndrome de tako-tsubo (sus-décalage du segment ST parfois absent).
Une instabilité hémodynamique justifie la réalisation d’une échocardiographie urgente à la recherche d’éléments en faveur de ces diagnostics.
2 Accidents extra-cardiaques
• Pneumothorax, pleurésie.
• Pneumopathie.
• Fracture de côte.
• Douleurs articulaires ou musculaires bénignes.
• Pancréatite, cholécystite.
• Gastrite, œsophagite, reflux gastro-œsophagien.
La répétition de l’interrogatoire et de l’examen physique est indispensable afin de justifier la demande d’examens paracliniques dédiés.
3 Diagnostics différentiels « angiographiques »
Certains patients présentent un authentique IDM « à coronaires saines ». Cette entité est décrite par les Anglo-Saxons par le terme de MINOCA (Myocardial Infraction with Non-Obstructive Coronary Arteries).
Cette entité clinique est définie par l’association des critères d’IDM (élévation de la troponine et symptômes d’ischémie et/ou modification ECG) + absence de lésion obstructive (> 50 %) à la coronarographie ou au coroscanner (pas de diagnostic différentiel).
Cette entité clinique représente environ 6 % des SCA.
La présentation est plus fréquemment sous la forme d’un IDMNST chez des patients plus jeunes, avec environ 40 % de femmes.
L’IRM et l’imagerie endocoronarienne ont une place importante dans la démarche diagnostique.
![]() Les principales étiologies sont :
Les principales étiologies sont :
• des causes « coronariennes » :
– la coronarographie est normale mais l’imagerie endoluminale (échographie endocoronarienne par exemple) identifie une rupture ou fissuration d’une plaque athéromateuse mineure à l’origine de la thrombose endoluminale. La prise en charge initiale est celle d’un SCA,
– il peut s’agir d’un spasme coronarien. Il peut être identifié lors de la coronarographie lorsqu’une sténose coronarienne disparaît après administration d’un dérivé nitré ou démasqué par l’injection de Méthergin® (méthylergométrine). Un spasme occlusif induit un sus-décalage régressif qui régresse avec la douleur après administration sublinguale de trinitrine. Un spasme non occlusif se traduit une modification moins franche de l’ECG (sous-décalage de ST ou ondes T négatives). En l’absence de spasme spontané, en cas de contexte évocateur, il peut être objectivé par injection intracoronarienne ou intraveineuse de Méthergin® (méthylergométrine) lors d’une coronarographie. Le spasme est le plus souvent la conséquence d’une hyperactivité plaquettaire secondaire à une rupture ou fissuration d’une plaque athéromateuse. Plus rarement, il traduit une dysfonction endothéliale dans l’angor spastique et dans ce dernier cas, en l’absence de phénomène thrombotique associé, n’induit habituellement pas d’élévation de la troponinémie. Un contexte migraineux ou la notion d’un phénomène de Raynaud, la répétition d’épisodes douloureux spontanés durant plusieurs mois ou années sont en faveur du diagnostic,
– la dissection coronarienne touche plus volontiers les femmes et sa physiopathologie est encore mal connue. Le diagnostic est évoqué par l’aspect « inhabituel » de la lésion coronarienne identifiée au décours d’un SCA. L’imagerie endocoronarienne permet d’évoquer ce diagnostic dans certaines situations,
– l’embolie coronarienne à point de départ non coronarien est une autre étiologie de MINOCA, en cas de fibrillation atriale (thrombus) ou d’une endocardite infectieuse (végétation) ;
• des causes « non coronariennes ». Ce sont en fait les diagnostics différentiels de douleur thoracique avec modification ECG et élévation de troponine (myocardite, tako-tsubo, cardiomyopathies notamment hypertrophiques, traumatisme, embolie pulmonaire, médicamenteuses, etc.).
E Diagnostic de gravité
![]() L’IDMST + justifie la réalisation d’une coronarographie immédiate.
L’IDMST + justifie la réalisation d’une coronarographie immédiate.
Le diagnostic de l’accident coronarien est plus difficile en l’absence de sus-décalage du segment ST. Le degré d’urgence de la coronarographie dépend du niveau de risque évalué sur la base de données cliniques et paracliniques.
1 Facteurs cliniques
• Instabilité hémodynamique : hypotension artérielle, tachycardie (très haut risque).
• Œdème pulmonaire (stades 2 ou 3 de Killip) (très haut risque).
• Choc cardiogénique (stade 4 de Killip) (très haut risque) .
• Douleur persistante ou récurrente sous traitement y compris en l’absence de modification de l’ECG (très haut risque).
• Complication mécanique (cf. infra) (très haut risque).
• Arrêt cardiaque réanimé (haut risque).
2 Électrocardiogramme
Sus-décalage du segment ST
La mise en évidence d’un sus-décalage du segment ST dans un contexte approprié confirme le diagnostic d’occlusion coronarienne.
Sous décalage du segment ST
L’importance du sous-décalage et sa diffusion sont corrélées au pronostic. Le nombre de dérivations enregistrant un sous-décalage du segment ST témoigne de l’étendue de l’ischémie myocardique.
La mise en évidence de variations du segment ST, symptomatiques ou non, est un marqueur de haut risque.
![]() Un sous-décalage supérieur à 1 mm sur plus de 5 dérivations associé à un sus-décalage isolé en aVr et/ou V1 chez un patient instable est en faveur de lésions tritronculaires et constitue un marqueur de très haut risque.
Un sous-décalage supérieur à 1 mm sur plus de 5 dérivations associé à un sus-décalage isolé en aVr et/ou V1 chez un patient instable est en faveur de lésions tritronculaires et constitue un marqueur de très haut risque.
Trouble du rythme ventriculaire
![]() Quel que soit le tracé ECG, la mise en évidence d’une extrasystolie ventriculaire polymorphe et répétitive, voire de salves de tachycardie ventriculaire, est un marqueur de très haut risque.
Quel que soit le tracé ECG, la mise en évidence d’une extrasystolie ventriculaire polymorphe et répétitive, voire de salves de tachycardie ventriculaire, est un marqueur de très haut risque.
3 Marqueurs biologiques
Troponine
Le risque de décès est corrélé à l’étendue de la nécrose myocardique, dont témoigne le niveau le plus élevé de la troponinémie.
L’élévation de la troponinémie est un marqueur de haut risque.
Autres marqueurs
L’insuffisance rénale (créatininémie) est un marqueur de mauvais pronostic.
L’élévation des peptides natriurétiques (BNP et NT-proBNP) témoigne d’une augmentation des conditions de charge du ventricule gauche qui augmente le risque d’insuffisance cardiaque aiguë et de décès.
Score de GRACE
![]() Ce score de risque est applicable aux SCANST.
Ce score de risque est applicable aux SCANST.
Il intègre dans son calcul :
• 4 variables continues : âge, pression artérielle systolique, fréquence cardiaque, créatininémie ;
• 3 variables binaires : arrêt cardiaque à l’admission, élévation de la troponine, sous-décalage du segment ST ;
• 1 variable catégorielle : stade Killip (classification du degré d’insuffisance cardiaque dans un contexte d’IDM) à l’admission.
Le calcul du score requiert l’accès au site internet https://www.outcomes-umassmed.org/risk_models_grace_orig.aspx.
Un score de GRACE supérieur à 140 est un marqueur de haut risque.
V Traitement
A Médicaments
1 Trithérapie antithrombotique
![]() Une trithérapie associant l’aspirine, un inhibiteur des récepteurs P2Y12 et un anticoagulant est indiquée dans les SCA en l’absence de contre-indication hémorragique.
Une trithérapie associant l’aspirine, un inhibiteur des récepteurs P2Y12 et un anticoagulant est indiquée dans les SCA en l’absence de contre-indication hémorragique.
![]() Les facteurs de risque de survenue d’un accident hémorragique sont : un âge supérieur à 75 ans, le sexe féminin, une insuffisance rénale, une diathèse hémorragique, un AVC ancien, un poids inférieur à 65 kg, une chirurgie ou un traumatisme sévère récents. Néanmoins, aucun score de risque hémorragique n’est actuellement validé et l’évaluation reste empirique.
Les facteurs de risque de survenue d’un accident hémorragique sont : un âge supérieur à 75 ans, le sexe féminin, une insuffisance rénale, une diathèse hémorragique, un AVC ancien, un poids inférieur à 65 kg, une chirurgie ou un traumatisme sévère récents. Néanmoins, aucun score de risque hémorragique n’est actuellement validé et l’évaluation reste empirique.
Inhibiteur du thromboxane A2 : acide acétylsalicylique (aspirine)
![]() Le traitement est habituellement initié par injection IVD de 250 mg suivie d’une dose quotidienne de 75–100 mg per os, associée à un inhibiteur de la pompe à protons (ex : oméprazole).
Le traitement est habituellement initié par injection IVD de 250 mg suivie d’une dose quotidienne de 75–100 mg per os, associée à un inhibiteur de la pompe à protons (ex : oméprazole).
Inhibiteurs des récepteurs P2Y12
• Le clopidogrel (Plavix®) est prescrit lorsque le prasugrel et le ticagrélor sont contre-indiqués (risque hémorragique, antécédent d’AVC, insuffisance hépatique sévère). Il est moins efficace et son délai d’action après une dose de charge est plus long.
• Le prasugrel (Efient®) est contre-indiqué en cas d’antécédent d’AVC et n’est pas recommandé chez les patients après 75 ans et/ou si le poids est inférieur à 60 kg.
• Le ticagrélor (Brilique®) peut induire une bradycardie et une dyspnée réversibles à l’arrêt du traitement.
Ils sont administrés de la manière suivante :
• clopidogrel : dose de charge per os de 600 mg suivie d’une dose quotidienne de 75 mg ;
• prasugrel : dose de charge per os de 60 mg suivie d’une dose quotidienne de 10 mg ;
• ticagrélor : dose de charge de 180 mg suivie d’une dose quotidienne de 90 mg matin et soir.
Anticoagulants
Le type et les modalités d’administration sont choisis en fonction du contexte.
Intervention coronarienne percutanée immédiate
• Héparine non fractionnée (HNF) : 60–70 UI/kg IVD (≤ 5 000 UI).
• Héparine de bas poids moléculaire (HBPM) : énoxaparine 0,5 mg/kg IVD.
Intervention coronarienne percutanée différée
• Énoxaparine (Lovenox®) : 1 mg/kg sous-cutanée matin et soir.
• Fondaparinux (Arixtra®) : 2,5 mg/j sous-cutanée (complété par un bolus d’HNF lors de la réalisation de la coronarographie).
L’anticoagulant est habituellement interrompu après la réalisation de l’intervention coronarienne percutanée ou du pontage coronarien.
2 Médicaments symptomatiques et anti-ischémiques
Médicaments symptomatiques
• Antalgique : une douleur persistante invalidante peut justifier l’administration d’un antalgique (chlorhydrate de morphine).
![]() L’effet antalgique s’accompagne d’une réduction de l’activation du système sympathique potentiellement arythmogène. Néanmoins, les morphiniques ralentissent l’absorption des antiplaquettaires.
L’effet antalgique s’accompagne d’une réduction de l’activation du système sympathique potentiellement arythmogène. Néanmoins, les morphiniques ralentissent l’absorption des antiplaquettaires.
• ![]() Anxiolytique : un traitement léger est adapté à la demande (benzodiazépine).
Anxiolytique : un traitement léger est adapté à la demande (benzodiazépine).
• Oxygénothérapie : elle est réservée aux patients présentant une hypoxémie (SaO2 < 90 % ou PaO2 < 60 mmHg), l’hyperoxie pouvant être délétère.
Médicaments anti-ischémiques
Dérivés nitrés
Ils peuvent être prescrits par voie intraveineuse (dinitrate d’isosorbide 2 mg/h) à visée antalgique, antihypertensive ou comme traitement d’une insuffisance cardiaque congestive. La dose est augmentée si la PA est élevée et inversement.
![]() Ils sont contre-indiqués si le patient a absorbé les 24–48 heures précédentes un inhibiteur de la phosphodiestérase 5 (sildénafil).
Ils sont contre-indiqués si le patient a absorbé les 24–48 heures précédentes un inhibiteur de la phosphodiestérase 5 (sildénafil).
Bêtabloquants
![]() Ils diminuent la consommation en oxygène du myocarde par leur effet bradycardisant, hypotenseur et inotrope négatif.
Ils diminuent la consommation en oxygène du myocarde par leur effet bradycardisant, hypotenseur et inotrope négatif.
![]() Ils sont indiqués si l’angor est réfractaire en l’absence de contre-indication. Ils sont contre-indiqués lorsqu’un spasme coronarien est suspecté (prise au long cours d’un traitement antimigraineux), après consommation de cocaïne ou si au moins deux éléments prémonitoires de choc cardiogénique sont identifiés (FC > 110 bpm, PA < 120 mmHg, âge > 70 ans). Ils ne doivent pas être interrompus si le patient est traité au long cours (si le stade de Killip est < 3) (ex : aténolol 50 mg per os éventuellement renouvelé).
Ils sont indiqués si l’angor est réfractaire en l’absence de contre-indication. Ils sont contre-indiqués lorsqu’un spasme coronarien est suspecté (prise au long cours d’un traitement antimigraineux), après consommation de cocaïne ou si au moins deux éléments prémonitoires de choc cardiogénique sont identifiés (FC > 110 bpm, PA < 120 mmHg, âge > 70 ans). Ils ne doivent pas être interrompus si le patient est traité au long cours (si le stade de Killip est < 3) (ex : aténolol 50 mg per os éventuellement renouvelé).
B Revascularisation
1 Intervention coronarienne percutanée
![]() Un cathéter est introduit par voie artérielle (radiale ou fémorale) et positionné jusqu’à ce que son extrémité atteigne l’ostium de l’artère coronaire concernée.
Un cathéter est introduit par voie artérielle (radiale ou fémorale) et positionné jusqu’à ce que son extrémité atteigne l’ostium de l’artère coronaire concernée.
Un produit de contraste radio-opaque est injecté dans l’artère par l’intermédiaire de ce cathéter.
La coronarographie permet d’identifier la (les) lésion(s) coronarienne(s) coupable(s).
La lésion est franchie par un guide sur lequel coulisse un cathéter à ballonnet. Le ballonnet est gonflé au niveau de la lésion sténosante. Une endoprothèse métallique (stent) peut être sertie sur le ballonnet et impactée dans la paroi artérielle au niveau de la lésion cible lors de l’inflation du ballonnet qui est ensuite retiré.
Pour prévenir la thrombose du cathéter (activation de facteurs contacts de la coagulation), une HNF ou une HBPM est administrée au moment de la procédure.
L’abord artériel radial est préféré à l’abord artériel fémoral car le risque de complication hémorragique est beaucoup plus faible.
L’implantation d’un stent impose une bithérapie antiplaquettaire durant 6–12 mois selon l’indication. Cette bithérapie a classiquement une durée de 6 mois quand l’angioplastie est réalisée en cas d’angor stable et de 12 mois en cas de SCA (le délai peut être réduit ou augmenté selon le risque ischémique et hémorragique du patient).
2 Revascularisation chirurgicale : pontage coronarien
Sous anesthésie générale, l’ouverture du thorax par sternotomie permet de visualiser les artères coronaires. Le cœur est arrêté et une circulation extracorporelle est instaurée.
Le greffon utilisé est de préférence artériel (artères mammaires) mais peut être veineux, prélevé au niveau du mollet (veine saphène). Le greffon est suturé en aval de la lésion et sur l’aorte ascendante s’il s’agit d’une veine. La ou les lésions athéromateuses coronariennes ne sont pas abordées. Le pontage contourne la ou les lésions en dérivant le sang de la subclavière (mammaire) ou de l’aorte (veine) vers l’artère en aval de la sténose critique.
C Traitement du SCANST
La stratégie thérapeutique est adaptée à la présentation clinique et selon le niveau de risque.
L’aspirine est indiquée dès que le diagnostic est suspecté.
L’administration d’un inhibiteur des récepteurs P2Y12 n’est indiquée qu’après confirmation du diagnostic par une coronarographie, si une revascularisation chirurgicale n’est pas envisagée.
L’anticoagulation est recommandée dès le diagnostic évoqué. L’énoxaparine (Lovenox®) et le fondaparinux (Arixtra®) sont habituellement utilisés. L’énoxaparine est habituellement indiquée si une coronarographie doit être rapidement réalisée et le fondaparinux si la coronarographie est différée.
Le délai de réalisation de la coronarographie dépend de l’évaluation du niveau de risque.
1 Très haut risque : coronarographie immédiate (< 2 heures après admission)
La coronarographie doit être réalisée dans les 2 heures dans les situations suivantes :
• instabilité hémodynamique ;
• choc cardiogénique ;
• angor réfractaire (persistant) ou récidivant sous traitement médical ;
• arythmie ventriculaire menaçante (ESV [extrasystoles ventriculaires] polymorphes, salves de TV) ;
• complication mécanique ;
• insuffisance cardiaque ;
• sous-décalage du segment ST > 1 mm dans plus de 5 dérivations et sus-décalage du segment ST en aVr/VL.
Si un patient est hospitalisé dans un centre ne disposant pas d’un plateau de cardiologie interventionnelle, il doit être immédiatement transféré.
2 Haut risque : coronarographie rapide (< 24 heures après admission)
La coronarographie doit être réalisée dans les 24 heures dans les situations suivantes :
• diagnostic confirmé ;
• modifications dynamiques du segment ST ou de l’onde T (avec ou sans signe clinique associé à la modification) ;
• élévation de la troponine ;
• arrêt cardiaque réanimé ;
• score de GRACE > 140.
3 Bas risque : coronarographie optionnelle (absence de critères de risque sus-cités)
La coronarographie n’est pas systématique en l’absence de critères à très haut ou à haut risque.
D Traitement de l’IDMST
1 Stratégies de reperfusion
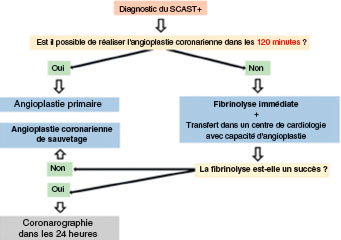
![]() Dès que le diagnostic d’un IDMST + est posé, le plus souvent au domicile du patient, une stratégie de reperfusion myocardique doit être envisagée, passant généralement par une revascularisation (désobstruction de l’artère coronaire occluse).
Dès que le diagnostic d’un IDMST + est posé, le plus souvent au domicile du patient, une stratégie de reperfusion myocardique doit être envisagée, passant généralement par une revascularisation (désobstruction de l’artère coronaire occluse).
Deux stratégies de reperfusion peuvent être proposées : la fibrinolyse et la stratégie interventionnelle.
Fibrinolyse
La reperfusion est réalisée par l’administration intraveineuse d’un agent fibrinolytique, en sus du traitement antiplaquettaire et anticoagulant.
Le fibrinolytique (fibrino-spécifique) de référence est la ténectéplase prescrite par voie IV à une dose adaptée au poids et à l’âge.
Elle est contre-indiquée si le risque hémorragique est jugé trop élevé (antécédent hémorragique ou d’AVC, traumatisme récent, chirurgie récente, âge ≥ 75 ans, traitement anticoagulant en cours).
Elle est réservée à l’impossibilité d’envisager une reperfusion mécanique par angioplastie rapide mais justifie en parallèle un transfert immédiat vers un centre de coronarographie. La coronarographie doit être réalisée systématiquement après la fibrinolyse dans des délais variables :
• immédiatement si la douleur et le sus-décalage du segment ST persistent (échec du traitement fibrinolytique), ou récidivent. Elle est suivie de la réalisation d’une ICP (dite « de sauvetage ») ;
• secondairement si la douleur régresse et le sus-décalage revient à la ligne isoélectrique. Elle est suivie d’une revascularisation adaptée (ICP ou pontage).
Stratégie interventionnelle
On procède au transfert immédiat du patient en centre de coronarographie pour désobstruction mécanique grâce à une intervention coronarienne percutanée primaire (ICP-P). La stratégie est résumée dans la figure 5.9.
Choix de la stratégie
Il dépend de l’estimation du délai de transfert vers une salle de coronarographie (disponible 24 h/24).
• Si le délai entre le diagnostic et la réalisation d’une angioplastie coronarienne est < 120 minutes : la stratégie interventionnelle est privilégiée (ICP-P). • Si le délai entre le diagnostic et la réalisation d’une angioplastie coronarienne est > 120 minutes : on procède à une fibrinolyse.
• Lorsque le diagnostic est posé en SAU d’un hôpital disposant d’une salle de coronarographie, la stratégie interventionnelle est adoptée.
Fig. 5.9. ![]() Stratégie de reperfusion dans le syndrome coronarien aigu avec sus-décalage du segment ST (SCAST +) en fonction des délais de prise en charge.
Stratégie de reperfusion dans le syndrome coronarien aigu avec sus-décalage du segment ST (SCAST +) en fonction des délais de prise en charge.
2 Antithrombotiques en fonction de la stratégie de reperfusion
Stratégie interventionnelle (ICP-P)
L’aspirine est indiquée dès le diagnostic suspecté.
Un inhibiteur des récepteurs P2Y12 est habituellement administré en pré-hospitalier, notamment si le délai de transfert vers la salle de coronarographie est supérieur à 60 minutes (délai empirique). Le prasugrel est actuellement préféré en l’absence de contre-indication.
Un anticoagulant, HNF ou HBPM, est administré par voie intraveineuse. Il n’est pas renouvelé au décours d’une désobstruction mécanique (hors situation particulière).
Fibrinolyse intraveineuse
L’aspirine est indiquée dès le diagnostic suspecté.
Le clopidogrel est le seul inhibiteur des récepteurs P2Y12 autorisé en association au fibrinolytique. (Une dose de charge de 300 mg est administrée uniquement chez les patients d’âge < 75 ans).
Un anticoagulant est administré jusqu’à la réalisation d’une coronarographie. L’énoxaparine par voie sous-cutanée est habituellement préférée à l’HNF mais les deux molécules peuvent être utilisées.
E Traitement de l’angor stable
1 Stratification du risque
La prise en charge doit tenir compte de la stratification du risque.
L’objectif est de préciser le niveau de risque de survenue d’un infarctus du myocarde ou d’un décès.
Les patients sont classés dans l’une des 3 catégories en fonction du risque annuel de décès :
• bas risque : mortalité < 1 % ; • risque intermédiaire : ≥ 1 % et ≤ 3 % ; • haut risque : > 3 %.
L’évaluation du risque tient compte des données cliniques, de la fraction d’éjection du ventricule gauche, et des résultats des tests fonctionnels.
Les critères de haut risque sont les suivants :
• angor de classe 3 ou 4 ;
• fraction d’éjection ventriculaire gauche diminuée ;
• épreuve d’effort précocement positive (≤ 6 minutes) ;
• ischémie d’effort étendue à plus de 10 % du ventricule gauche (données obtenues par échocardiographie, scintigraphie ou IRM à l’effort ou équivalent).
La stratification peut identifier des situations à haut risque telles qu’une sténose du tronc coronaire gauche ou de l’interventriculaire antérieure gauche proximale, ou des sténoses tritronculaires proximales.
2 Moyens thérapeutiques médicamenteux
Correction des facteurs de risque
• L’arrêt définitif de l’intoxication tabagique est impératif, de même que le maintien d’une activité physique régulière et la perte d’un éventuel excès pondéral.
• L’hypertension artérielle (> 135/85 mmHg en automesure) est traitée en 1re intention par un inhibiteur de l’enzyme de conversion, un antagoniste des récepteurs de l’angiotensine 2 ou un bêtabloquant.
• Le diabète justifie un régime et un traitement.
• La dyslipidémie (même modérée) justifie la prescription d’une statine éventuellement associée à l’ézétimibe et l’objectif est d’obtenir un taux de LDL-cholestérol < 0,55 g/L (prévention secondaire).
Traitement de la crise angineuse
L’administration de trinitrine sublinguale, par son effet vasodilatateur artériel, est efficace en quelques secondes. Les effets indésirables peuvent être des céphalées et une chute de la pression artérielle qui justifie de conseiller au patient de s’asseoir ou de s’allonger au moment de la prise.
Le médicament est actuellement prescrit sous forme de spray.
Médicaments anti-ischémiques au long cours
Le traitement médicamenteux vise à rétablir l’équilibre entre l’apport et les besoins en oxygène du myocarde en favorisant la réduction des besoins à l’effort ou la vasodilatation coronarienne.
Bêtabloquants
Ils diminuent la consommation en oxygène du myocarde en réduisant la fréquence cardiaque, l’inotropisme et la pression artérielle.
Ils sont contre-indiqués dans l’asthme, la BPCO très sévère (bronchoconstricteurs), le phénomène de Raynaud (vasoconstricteurs), en cas de bradycardie sévère (< 50/min) ou de BAV du 2e ou 3e degré.
Inhibiteurs calciques
Ils réduisent l’inotropisme cardiaque et la pression artérielle et, pour certains, la fréquence cardiaque au repos et à l’effort.
Le principal effet secondaire est la survenue d’œdèmes des membres inférieurs, surtout avec les dihydropyridines.
• Les inhibiteurs calciques bradycardisants (diltiazem, vérapamil) sont prescrits lorsque les bêtabloquants sont contre-indiqués ou mal tolérés. Les inhibiteurs calciques non bradycardisants sont prescrits en 1re intention en cas de contre-indication aux bêtabloquants ou en cas d’angor résiduel sous bêtabloquants en 2e intention.
• Les inhibiteurs calciques non bradycardisants (dihydropyridines) sont prescrits en association aux bêtabloquants ou si la fréquence cardiaque est spontanément basse (< 60 bpm).
Dérivés nitrés à libération prolongée et assimilés
• Ils favorisent la sécrétion de monoxyde d’azote (NO), substance vasodilatatrice au niveau coronarien et au niveau veineux.
• Ils sont prescrits per os ou sous forme de timbre transdermique posé 18 h/j dans les formes cliniques invalidantes.
• Ils sont contre-indiqués en association aux médicaments des troubles de l’érection (inhibiteurs des phosphodiestérases de type V comme le sildénafil).
• Les principaux effets indésirables sont les céphalées et l’échappement thérapeutique.
• Ils sont habituellement prescrits en 3e intention chez les patients restants symptomatiques sous bêtabloquants et/ou inhibiteur calciques.
• La molsidomine a un mode d’action semblable à celui des dérivés nitrés avec les mêmes effets indésirables et contre-indications.
Nicorandil
• C’est un activateur des canaux potassiques ATP-dépendants, c’est un vasodilatateur qui aurait de plus un effet protecteur sur le myocarde vis-à-vis de l’ischémie (préconditionnement).
• L’effet secondaire principal est l’apparition d’ulcérations péribuccales, intestinales et périanales.
• Comme les dérivés nitrés à libération prolongée, il est habituellement prescrit en 3e intention.
Ivabradine
Ce médicament était indiqué dans le traitement symptomatique de l’angor stable chronique chez l’adulte coronarien en rythme sinusal ayant une fréquence cardiaque supérieure ou égale à 70 bpm. Ce traitement n’est pratiquement plus utilisé dans cette indication.
• L’ivrabadine réduit de manière spécifique la fréquence cardiaque au repos et à l’effort par effet direct sur le nœud sinusal (inhibiteur du canal If).
• Son principal effet secondaire est visuel (phosphènes) et transitoire mais peut justifier l’arrêt.
• Elle est prescrite lorsque les bêtabloquants sont contre-indiqués ou mal tolérés et peut leur être associée. Elle est inefficace si le rythme cardiaque n’est pas sinusal (fibrillation atriale).
Antiagrégants plaquettaires
Aspirine
• Elle inhibe de manière irréversible la cyclo-oxygénase-1 plaquettaire (Cox-1) et, de ce fait, la production de thromboxane.
• Les effets délétères gastro-intestinaux mais non l’effet antiplaquettaire augmentent avec la dose.
• L’indication est systématique chez tout coronarien en l’absence de contre-indication (allergie, gastralgie) à une posologie de 75 à 100 mg/j.
Inhibiteurs des P2Y12
• Les thiénopyridines agissent comme antagoniste des récepteurs plaquettaires P2Y12 de l’ADP.
• Le clopidogrel est indiqué en cas de contre-indication à l’aspirine ou en association à l’aspirine durant 6 mois après implantation d’une prothèse endocoronarienne active (stent). Elle est parfois préférée à l’aspirine, notamment chez les patients polyartériels ayant par ailleurs une artériopathie périphérique.
• Les nouveaux inhibiteurs ne sont pas indiqués après intervention coronarienne dans l’angor stable.
3 Revascularisation myocardique
La revascularisation myocardique peut être proposée à visée fonctionnelle, lorsque les symptômes persistent malgré un traitement anti-ischémique optimal, ou à visée pronostique, chez les patients à haut risque tel que précédemment définis. De nombreuses études ont démontré qu’une revascularisation systématique n’était pas supérieure à un traitement médical optimal dans l’angor stable.
Intervention coronarienne percutanée ou angioplastie coronarienne (cf. vidéo 5.6).
Elle est précédée d’une coronarographie de l’artère concernée qui permet de localiser la sténose et d’en apprécier la longueur, ainsi que le diamètre de l’artère concernée qui déterminent le choix du matériel. L’inflation d’un ballonnet introduit dans l’artère coronaire en regard de la sténose refoule la lésion en périphérie et en modifie la structure (angioplastie coronarienne par ballonnet). Elle est complétée de l’implantation d’une prothèse endocoronarienne (stent) qui réduit le risque de resténose immédiate (recul élastique de la paroi artérielle) et de complication (dissection occlusive de la plaque). Les prothèses actives (enduites d’un traitement antimitotique) réduisent le risque de resténose secondaire à une cicatrisation exubérante. L’implantation d’un stent justifie la poursuite d’une double antiagrégation plaquettaire par aspirine et clopidogrel durant 6 mois.
Intervention coronarienne percutanée ou angioplastie coronarienne (cf. vidéo 5.6). Elle est précédée d’une coronarographie de l’artère concernée qui permet de localiser la sténose et d’en apprécier la longueur, ainsi que le diamètre de l’artère concernée qui déterminent le choix du matériel. L’inflation d’un ballonnet introduit dans l’artère coronaire en regard de la sténose refoule la lésion en périphérie et en modifie la structure (angioplastie coronarienne par ballonnet). Elle est complétée de l’implantation d’une prothèse endocoronarienne (stent) qui réduit le risque de resténose immédiate (recul élastique de la paroi artérielle) et de complication (dissection occlusive de la plaque). Les prothèses actives (enduites d’un traitement antimitotique) réduisent le risque de resténose secondaire à une cicatrisation exubérante. L’implantation d’un stent justifie la poursuite d’une double antiagrégation plaquettaire par aspirine et clopidogrel durant 6 mois.
Pontages coronariens
Ils sont pratiqués habituellement sous circulation extracorporelle (arrêt cardiaque, dérivation transitoire du flux sanguin vers un cœur artificiel) ou plus rarement à cœur battant.
Le pontage fait appel de préférence aux artères mammaires internes, qui naissent des artères subclavières et dont l’extrémité distale est implantée sur l’artère coronaire en aval de la sténose.
Les pontages aortocoronariens consistent à suturer un conduit sur l’aorte et en aval de la sténose. Ce conduit peut être une veine saphène prélevée au mollet ou une artère radiale.
4 Stratégie thérapeutique (grands principes)
• La correction des facteurs de risque et la prescription d’aspirine et de statines sont systématiques.
• Le traitement médicamenteux anti-ischémique est prescrit à visée symptomatique.
• La coronarographie est indiquée en vue d’une revascularisation lorsque le diagnostic est posé après réalisation de tests fonctionnels ou d’emblée si l’angor est sévère (classe ≥ 3, cf. tableau 5.1) ou la fonction ventriculaire gauche altérée.
• La revascularisation est indiquée à visée symptomatique lorsque l’angor persiste malgré la prescription d’un traitement médical ou à visée pronostique chez les sujets à haut risque.
• Le choix du type de revascularisation (angioplastie ou pontage) tient compte de la diffusion des lésions, de leur localisation, de considérations techniques, de l’évaluation du risque opératoire (EuroSCORE et STS score), de l’âge et des comorbidités.
• D’une manière générale, le pontage est préféré lorsque les lésions sont diffuses, notamment chez le diabétique, et incluent le tronc coronaire gauche et l’interventriculaire antérieure proximale sous réserve que le lit d’aval des artères sténosées soit accessible mais l’ICP peut être une alternative si la chirurgie est contre-indiquée (comorbidités, âge).
VI Évolution et complications
A Unité de soins intensifs coronariens
1 Organisation
L’unité de soins intensifs coronariens et/ou cardiologiques (USIC) est équipée de moniteurs permettant l’enregistrement en continu de l’ECG. L’équipe médico-paramédicale est formée à la prise en charge des complications rythmiques, hémodynamiques, et autres (cf. infra) des SCA.
L’objectif est de dépister et prendre en charge une complication précoce, en particulier rythmique, et d’évaluer les séquelles myocardiques de l’accident coronarien.
Le patient alité bénéficie d’une surveillance continue :
• clinique : mesure de la PA et auscultation cardiopulmonaire biquotidienne ;
• électrocardiographique : monitorage ECG continu (rythme) et ECG 12 dérivations biquotidien si la douleur récidive ;
• biologique : troponine, glycémie, créatininémie, NFS quotidiennes ;
• échocardiographique : ETT (échographie transthoracique) le jour de l’admission et en fonction de l’évolution.
2 Critères d’admission
Les patients ayant un SCAST + sont admis après revascularisation, transférés de la salle de coronarographie vers laquelle ils ont été dirigés d’emblée par le service mobile d’urgence et de réanimation (SMUR).
Les patients ayant un SCANST sont habituellement admis en unité de soins intensifs. Certains hôpitaux disposent d’une unité douleur thoracique (UDT) dédiée notamment à la prise en charge des SCANST non compliqués. Ces unités accueillent les patients ayant présenté une douleur thoracique suspecte et/ou chez qui un dosage de la troponine prélevé en SAU est élevé. La mise en évidence d’une complication justifie un transfert en USIC.
3 Durée d’hospitalisation
Les patients présentant un SCANST sortent habituellement au domicile ou sont transférés en chambre conventionnelle envisageable le jour suivant la réalisation de la coronarographie et le traitement (ICP) de la lésion « coupable » (responsable du SCA). La sortie de l’hôpital est habituellement réalisée, en l’absence de complication, 24–48 heures après revascularisation par ICP.
Pour les SCAST +, les durées d’hospitalisation sont adaptées. En cas d’évolution précoce non compliquée, la reperfusion (par fibrinolyse ou ICP-P) se traduit généralement par une régression rapide de la douleur et du sus-décalage du segment ST. L’onde Q (> 0,04 s et ≥ 1 mm) est un signe direct de nécrose constituée. Elle apparaît en moyenne à la 6e–12e heure. Elle n’est pas systématique et n’a pas de valeur pronostique. L’élévation de la troponine est systématique et persiste durant environ 15 jours. Sa persistance est d’autant plus longue que le pic est élevé. La sortie de l’hôpital peut être envisagée entre le 3e et le 5e jour. Un transfert peut être éventuellement réalisé dans un centre de réadaptation immédiatement après l’IDM ou le plus souvent à distance en ambulatoire.
B Complications précoces
1 Troubles du rythme et de la conduction
Troubles du rythme ventriculaire
Ils sont extrêmement fréquents et indépendants de l’étendue de la zone ischémique.
Par ordre de gravité croissante, il peut s’agir d’extrasystoles ventriculaires, d’une tachycardie ventriculaire non soutenue ou soutenue, ou d’une fibrillation ventriculaire.
La FV est responsable de la plupart des morts subites et peut survenir d’emblée (mort subite pré-hospitalière). Elle n’est jamais réversible spontanément et nécessite l’administration immédiate d’un choc électrique externe.
Troubles du rythme supraventriculaire
La fibrillation atriale peut être à l’origine d’une décompensation hémodynamique et justifier une cardioversion électrique immédiate, ou bien être responsable d’accidents thromboemboliques dont la traduction clinique peut être au premier plan (AVC ischémique) et qui peuvent être prévenus par anticoagulation.
Troubles de la conduction
• Le bloc atrioventriculaire (BAV) nodal répond à l’administration d’atropine. Il est habituellement transitoire et survient habituellement dans l’IDMST + inférieur.
• Le BAV infranodal (ou hissien) est le plus souvent mal toléré. Il ne répond pas à l’administration d’atropine et justifie l’implantation d’une sonde d’entraînement électrosystolique ou d’un stimulateur cardiaque externe provisoire. Il est le plus souvent définitif et survient plus volontairement dans l’IDMST + antérieur, associé à une nécrose myocardique étendue, et indique l’implantation d’un stimulateur cardiaque permanent.
• L’hypertonie vagale (bradycardie ou dysfonction sinusale, hypotension artérielle) répond à l’injection d’atropine et au remplissage macromoléculaire. Elle est fréquente dans l’IDMST + inférieur.
2 Complications hémodynamiques
Insuffisance ventriculaire gauche
L’insuffisance ventriculaire gauche (IVG) peut être la conséquence directe de l’étendue de la nécrose myocardique, être favorisée par la survenue d’une arythmie ou traduire une complication mécanique (qu’il faut systématiquement rechercher par la réalisation d’une échographie).
Le traitement repose sur les diurétiques, les inhibiteurs de l’enzyme de conversion et les inhibiteurs des récepteurs aux minéralocorticoïdes.
La sévérité de l’IVG est définie par la classification de Killip (cf. tableau 5.2).
Choc cardiogénique
Il est habituellement associé à une nécrose étendue du VG (nécrose antérieure ou récidive de nécrose).
La coronarographie retrouve alors le plus souvent une occlusion proximale de l’interventriculaire antérieure et/ou des lésions pluritronculaires et du tronc commun.
Il peut aussi être la conséquence d’une complication mécanique qu’il faut systématiquement rechercher par une échographie.
Tableau 5.2. ![]() Classification de Killip.
Classification de Killip.
| Stade d’insuffisance ventriculaire gauche | Description |
|---|---|
| 1 | Absence de râles crépitants à l’auscultation pulmonaire |
| 2 | Râles crépitants aux bases ne dépassant pas la moitié des champs pulmonaires |
| 3 | Râles crépitants dépassant la moitié des champs pulmonaires (œdème aigu pulmonaire), galop auscultatoire |
| 4 | Choc cardiogénique |
Il peut être inaugural ou s’installer progressivement en 24 à 48 heures, précédé d’un état de préchoc caractérisé par une hypotension artérielle (systolique < 90 mmHg) mal tolérée, ne répondant pas au remplissage macromoléculaire (qui élimine une hypovolémie), persistante après correction d’une éventuelle bradycardie d’origine vagale, plus volontiers associée à une tachycardie. À ce stade, la revascularisation rapide ou la correction chirurgicale d’une complication mécanique peuvent être bénéfiques.
Au stade constitué apparaissent des signes d’hypoperfusion périphérique (extrémités froides, oligurie, confusion). Le traitement repose sur l’administration de médicaments inotropes positifs (dobutamine) et rapidement, si le terrain le permet, l’implantation d’un système d’assistance circulatoire.
Le pronostic hospitalier est très sombre avec une mortalité de plus de 70 %.
Infarctus du ventricule droit
Il complique classiquement les infarctus du myocarde dans le territoire inférieur.
Il peut prendre le masque d’un choc cardiogénique mais son traitement est très différent.
La triade symptomatique classique associe, chez un patient présentant un IDMST + inférieur, une hypotension artérielle, des champs pulmonaires clairs et une turgescence jugulaire.
L’ECG peut identifier un sus-décalage du segment ST en V3R-V4R (dérivations précordiales droites, symétriques des dérivations gauches par rapport au sternum, qu’il faut penser à enregistrer dans ce cas).
L’ETT met en évidence une dilatation et une hypokinésie du ventricule droit (VD), une dilatation de l’oreillette droite et une insuffisance tricuspidienne par dilatation de l’anneau et restriction valvulaire.
L’infarctus du VD est souvent compliqué d’une fibrillation atriale qui compromet l’hémodynamique et doit être rapidement réduite. Il contre-indique l’administration de vasodilatateurs.
3 Complications mécaniques
Rupture de la paroi libre du ventricule gauche
Elle peut être aiguë, responsable d’un collapsus avec dissociation électromécanique et rapidement fatale, ou subaiguë. Son pronostic est alors très sombre.
La recrudescence de la douleur et la ré-élévation du segment ST en cours de normalisation, associées à une hypotension artérielle brutale et prolongée, imposent la réalisation immédiate de l’ETT. En cas de doute diagnostique, le scanner cardiaque peut parfois aider.
L’identification d’un hémopéricarde impose un geste chirurgical immédiat.
Rupture septale
Elle entraîne une communication interventriculaire.
Elle est rarement inaugurale mais survient dans les 24–48 heures.
Elle est plus fréquente en l’absence de revascularisation précoce et chez les sujets âgés.
Le souffle précordial systolique est typiquement « en rayon de roue » et le diagnostic est confirmé par l’ETT.
La survenue d’une rupture septale est de mauvais pronostic.
Le traitement est chirurgical ou interventionnel (fermeture par voie percutanée). Les meilleurs résultats sont habituellement obtenus s’il peut être différé de quelques jours durant lesquels le traitement de l’insuffisance cardiaque est médical.
Rupture (totale ou partielle) de pilier mitral
La nécrose d’un pilier mitral (le plus souvent postéromédian en raison de sa vascularisation unique généralement par l’artère coronaire droite) ou d’un chef de pilier mitral induit une insuffisance mitrale massive et se traduit par une IVG brutale, et l’apparition d’un souffle systolique souvent peu intense. En cas de rupture totale, un tableau de choc cardiogénique s’installe habituellement rapidement.
Le diagnostic doit être évoqué en cas d’IDM inférieur compliqué d’un OAP et il s’agit le plus souvent d’une rupture partielle.
Le diagnostic est posé par l’ETT.
Le traitement est chirurgical (suture du pilier ou remplacement valvulaire) urgent. Certains patients ont pu être traités par voie percutanée (Mitraclip®).
4 Complications thrombotiques
Thrombose veineuse et embolie pulmonaire
C’est une complication devenue rare car les patients reçoivent en phase aiguë des anticoagulants et sont ensuite rapidement mobilisés.
Elle justifie une anticoagulation préventive si un alitement prolongé est justifié.
Thrombus intra-VG et embolies systémiques
Le thrombus est habituellement associé à une nécrose myocardique étendue et complique plus volontiers l’IDMST + antérieur.
Le thrombus est dépisté par l’ETT qui doit être pratiquée dans les 48 heures suivant l’admission en USIC.
L’IRM est plus sensible que l’ETT pour en faire le diagnostic.
En raison du risque d’embolisation systémique, il indique une anticoagulation curative.
L’embolie systémique peut également être d’origine atriale ou auriculaire gauche favorisée par une fibrillation atriale, qui justifie une anticoagulation curative.
5 Autres complications précoces
Péricardite précoce
La péricardite est habituellement inflammatoire et associée à un IDM étendu.
Elle peut être responsable d’une douleur thoracique de caractéristiques sémiologiques différentes de la douleur angineuse.
Récidive ischémique
La récidive angineuse peut être secondaire à la réocclusion de l’artère désobstruée (SCAST +) ou à une ischémie controlatérale à la nécrose chez les patients pluritronculaires (SCAST + et SCANST).
C Complications tardives
1 Péricardite tardive
Le syndrome de Dressler survient classiquement la 3e semaine suivant un IDM étendu.
L’épanchement péricardique peut s’accompagner d’un épanchement pleural, d’arthralgies, d’une hyperthermie.
Le syndrome inflammatoire est en général important.
L’évolution est en règle favorable sous traitement anti-inflammatoire.
2 Insuffisance ventriculaire gauche
Elle complique l’infarctus du myocarde étendu, notamment en l’absence de revascularisation ou si elle a été réalisée tardivement.
Elle peut être secondaire à un phénomène de remodelage progressif du VG (dilatation) ou à la constitution d’un anévrisme (déformation diastolique du VG en regard de la zone nécrosée). Le traitement est celui de l’insuffisance cardiaque.
3 Troubles du rythme ventriculaire tardifs
Ils sont d’autant plus fréquents que la fonction VG est altérée.
La prévention d’un décès par tachycardie ou fibrillation ventriculaire repose sur l’implantation d’un défibrillateur automatique lorsque la FEVG (fraction d’éjection ventriculaire gauche) reste inférieure à 35 % à distance de l’IDM (au moins 6 semaines), après optimisation du traitement médical.
Chez les patients ayant une FEVG inférieure à 35 % à la phase précoce, une lifevest est habituellement proposée en attendant de voir si la FEVG s’améliore secondairement après revascularisation (sidération) et après instauration d’un traitement médical. Une réévaluation par échographie est habituellement réalisée au bout de quelques semaines. Un défibrillateur automatique implantable est proposé chez les patients dont la FEVG reste inférieure à 35 %.
VII Prise en charge au long cours après hospitalisation pour un SCA
A Traitement au long cours
1 Antithrombotiques
L’aspirine est recommandée au long cours.
Un inhibiteur des récepteurs P2Y12 est habituellement associé à l’aspirine durant 12 mois.
Si un anticoagulant oral est justifié (fibrillation atriale, thrombus VG), il est prescrit à plaine dose. Afin d’éviter une complication hémorragique sous trithérapie (double antiagrégation plaquettaire et anticoagulant), il est actuellement recommandé de privilégier par défaut une bithérapie (associant un inhibiteur des récepteurs PY12, en l’occurrence le clopidogrel, et un anticoagulant à pleine dose) pendant 12 mois. Au bout d’un an, une anticoagulation seule est recommandée. Dans certains cas, une trithérapie peut être indiquée pendant une durée limitée (habituellement 1 mois).
2 Inhibiteurs de la pompe à protons
Ils sont prescrits si un risque d’hémorragie gastro-intestinale élevé est identifié (âge ≥ 65 ans, antécédent d’ulcère, corticothérapie au long cours, etc.), en association à l’aspirine, éventuellement avec un autre antiplaquettaire et/ou un anticoagulant oral.
En pratique, ils sont largement prescrits.
3 Hypolipémiants (cf. item 223 – chapitre 3)
Les statines sont prescrites en 1re intention à forte dose (ex : atorvastatine 80 mg ou rosuvastatine 20 mg).
L’objectif est une réduction d’au moins 50 % du taux de LDL-C et l’atteinte d’un taux inférieur à 0,55 g/L.
Si l’objectif n’est pas atteint après 4 semaines, à la dose maximale tolérée, une dose de 10 mg d’ézétimibe est associée.
Si l’objectif n’est toujours pas atteint, l’adjonction d’un inhibiteur des PCSK9 est justifiée et remboursée en France si le LDL-C est supérieur à 0,7 g/L.
4 Inhibiteurs de l’enzyme de conversion ou antagonistes des récepteurs de l’angiotensine 2
Leur prescription n’est pas systématique.
Ils sont particulièrement indiqués chez les patients qui présentent une FEVG inférieure ou égale à 40 %, un diabète, une insuffisance rénale chronique.
5 Bêtabloquants
Leur prescription n’est plus systématique mais ils restent en pratique largement prescrits, notamment après un SCAST +.
Ils sont formellement indiqués en cas de FEVG inférieure ou égale à 40 %.
6 Inhibiteurs des récepteurs des minéralocorticoïdes
Ils sont prescrits si la FEVG est inférieure ou égale à 40 % et associée à des manifestations d’insuffisance cardiaque congestive ou un diabète, après introduction d’un bêtabloquant et d’un IEC, en l’absence d’insuffisance rénale (créatininémie > 221 μmol/L) et d’hyperkaliémie (cf. item 234 – chapitre 18).
7 Autres mesures
Une réadaptation cardiovasculaire est recommandée et proposée à tous les patients ayant présenté un SCA.
Elle peut être réalisée soit en hospitalisation conventionnelle dans les suites du séjour en cardiologie, soit en ambulatoire.
Elle a pour but de vérifier la bonne évolution sous surveillance médicale, comprend généralement une éducation thérapeutique (signes d’alerte, suivi des traitements, mode de vie, etc.), et la reprise d’une activité physique.
Elle est assurée par une prise en charge pluridisciplinaire comprenant des médecins, des infirmiers, des diététiciens, des éducateurs sportifs, des psychologues.
B Suivi médical
Après hospitalisation pour SCA, le patient bénéficie d’un suivi régulier conjointement par son médecin référent et par un cardiologue.
La fréquence du suivi et ses modalités dépendent de la sévérité de la maladie coronarienne et de l’existence d’une altération de la FEVG (ex : consultation cardiologique 1 mois après l’hospitalisation, puis 2 fois/an et consultation du médecin référent à la sortie de l’hôpital, puis tous les 4 mois).
Le suivi a pour but de s’assurer :
• du contrôle des facteurs de risque (cf. item 221 – chapitre 2) et de la tolérance des traitements :
– sevrage tabagique,
– reprise d’une activité physique,
– adaptation du régime alimentaire (méditerranéen),
– LDL-C dans les objectifs et absence de toxicité de la statine (hépatique et musculaire),
– contrôle de la glycémie chez le diabétique,
– contrôle de la pression artérielle chez l’hypertendu ;
• d’identifier d’autres localisations athéromateuses :
– échodoppler des troncs supra-aortiques,
– échographie de l’aorte abdominale à la recherche d’un anévrisme,
– échodoppler des artères des membres inférieurs ;
• de la bonne observance du traitement médicamenteux et de l’absence d’effet indésirable ;
• de l’absence de complication tardive :
– récidive ischémique (interrogatoire et tests fonctionnels) ;
– dégradation de la fonction VG (interrogatoire, examen, ECG, échocardiographie).
Points-clés
| • Sous la dénomination SCA sont regroupées toutes les manifestations cliniques traduisant l’ischémie myocardique aiguë. • L’ischémie myocardique est la conséquence d’un déséquilibre entre les apports et les besoins en oxygène du myocarde. • L’ischémie aiguë peut être unique ou récurrente sur quelques heures à jours et par convention, le premier épisode date de moins d’un mois lorsque le patient est pris en charge pour la première fois. • En pratique, un accident ischémique peut être responsable d’une mort subite (par fibrillation ventriculaire), d’un angor spontané résistant au traitement médicamenteux et dans ce cas habituellement associé à un SCAST +, d’un angor spontané souvent récidivant ou d’effort d’aggravation progressive (SCANST), ou de manifestations plus trompeuses. • La cause la plus fréquente est un accident athérothrombotique associant la rupture ou fissuration d’une plaque athéromateuse instable et la formation d’un thrombus endocoronarien qui peut être plaquettaire et fibrinocruorique. • Le diagnostic d’un SCAST + est habituellement facile, fondé sur la clinique (douleur persistante) et l’ECG (sus-décalage de ST). Il est le plus souvent posé par le médecin urgentiste dès le domicile du patient qui a contacté le centre de régulation des appels d’urgence car il présente une douleur intense et incessante. L’origine est une occlusion coronarienne complète et brutale par un thrombus. Le traitement repose sur la désobstruction mécanique (intervention coronarienne percutanée) réalisée en salle de coronarographie. Si cette intervention ne peut être réalisée dans les 2 heures du fait de l’éloignement du patient, la désobstruction peut être obtenue par administration intraveineuse d’un agent fibrinolytique dès le domicile. Le patient doit être ensuite transféré dans un centre disposant d’une salle de coronarographie. • Le diagnostic d’un SCANST est beaucoup plus difficile. Le patient est habituellement asymptomatique lorsqu’il est admis en service d’accueil des urgences. Le principe est de retenir ce diagnostic chez toute personne décrivant une douleur angineuse ou équivalente, récente, non expliquée par une autre étiologie évidente (traumatique par exemple), survenant dans un contexte approprié (facteurs de risque, antécédents vasculaires). Il peut être confirmé par la mise en évidence de modifications de l’ECG enregistré à l’occasion d’une récidive douloureuse et plus simplement par la mise en évidence d’une élévation de la troponine (ultrasensible) qui est dosée à l’admission et 1 à 2 heures plus tard. À ce stade, il est important de rechercher des signes de gravité pour établir dans quels délais réaliser une coronarographie. Le diagnostic est confirmé par une coronarographie qui met en évidence une sténose (athérothrombotique). Elle est traitée le plus souvent par implantation d’un stent. La coronarographie doit être pratiquée très rapidement (< 2 heures) si le tableau clinique l’impose (œdème pulmonaire, douleur récurrente, trouble du rythme ventriculaire menaçant). Elle peut être différée à 24 heures dans le cas contraire. • La suspicion d’un SCA justifie la prescription d’aspirine et d’un anticoagulant. La confirmation impose l’adjonction d’un inhibiteur des récepteurs P2Y12. La trithérapie antithrombotique est adaptée au risque hémorragique évalué dès la prise en charge du patient. • L’accident ischémique est la complication principale de la maladie coronarienne dont une autre expression clinique est l’angor d’effort stable. L’angor stable est la conséquence d’une sténose athéromateuse fibrocalcaire stable. Il induit une ischémie myocardique lors de l’effort qui peut être indolore (ischémie silencieuse inductible). Le diagnostic repose sur la réalisation de tests fonctionnels reposant sur la réalisation d’une épreuve d’effort progressive sur bicyclette ou tapis roulant. Elle de préférence associée à une imagerie cardiaque (échocardiographie, scintigraphie myocardique, imagerie par résonance magnétique nucléaire). Ces examens permettent de confirmer le diagnostic et de prédire l’existence de sténoses coronariennes sévères ou multiples qui justifieront la réalisation d’une revascularisation myocardique soit interventionnelle (implantation de stents coronariens), soit chirurgicale (pontage coronarien). Les données en faveur sont une épreuve d’effort précocement positive, un trouble de la cinétique du ventricule gauche étendu a plusieurs segments, une ischémie isotopique. • Quelle que soit la présentation clinique de la maladie coronarienne, elle impose l’instauration de mesures hygiénodiététiques appropriées (perte de poids, activité physique, arrêt d’une intoxication tabagique), la prescription d’un traitement hypolipémiant (objectif : LDL-C < 0,55 g/L), le dépistage et le traitement des autres facteurs de risque (HTA, diabète) si nécessaire. • Les SCA sont les complications les plus redoutées de la maladie coronarienne et la cause principale des décès précoces (la mort subite peut compliquer toutes les formes cliniques) et tardifs (lorsque le traitement n’a pas permis d’éviter la constitution d’un infarctus du myocarde étendu). • La prévention repose sur un dépistage des facteurs de risque et de localisations athéromateuses débutantes chez des patients identifiés à risque. • La prédiction de la survenue d’un SCA n’est pas possible (bien que certaines situations comme l’effort physique violent puissent le favoriser). • L’amélioration du pronostic du SCA repose sur une prise en charge adaptée très précoce qui impose de savoir évoquer le diagnostic dès les premiers signes et d’organiser une prise en charge immédiate médicalisée. |
Notions indispensables et inacceptables
Notions indispensables
Un syndrome coronarien aigu doit être évoqué :
• devant une symptomatologie douloureuse thoracique suspecte (angor ou équivalent) ;
• chez un patient présentant un terrain à risque (facteurs de risque ou antécédents vasculaires artériels) ;
• lorsque l’angor est spontané ou d’effort récent et/ou d’aggravation rapide (crescendo).
Un sus-décalage du segment ST persistant :
• confirme de diagnostic d’occlusion coronarienne aiguë ;
• pose le diagnostic d’infarctus avec sus-décalage de ST (IDMST +) ;
• impose une revascularisation immédiate par intervention coronarienne percutanée ou à défaut, en l’absence de contre-indication, par fibrinolyse intraveineuse.
En l’absence de sus-décalage persistant :
• la persistance d’une douleur angineuse justifie la réalisation d’une coronarographie rapide (< 2 heures) ;
• l’élévation de la troponine dosée a l’admission et 1 à 2 heures plus tard confirme le diagnostic d’infarctus (IDMNST) ;
• la mise en évidence de signes de gravité (ECG, troponine, score de GRACE) justifie la réalisation d’une coronarographie (< 24 heures) ;
• l’absence d’élévation de la troponine n’exclut pas le diagnostic de syndrome coronarien aigu (SCANST). La clinique permet d’évoquer le diagnostic d’angor instable.
Le traitement antithrombotique comprend :
• aspirine dès la suspicion ;
• un anticoagulant avant la réalisation de la coronarographie ;
• un inhibiteur des récepteurs P2Y12 avant la réalisation de la coronarographie dans l’IDMST + ;
• un inhibiteur des récepteurs P2Y12 après la réalisation de la coronarographie dans (IDMNST et angor instable).
Au décours d’un SCA, sont prescrits pour 1 an :
• aspirine ;
• inhibiteur des récepteurs P2Y12 ;
• statine à forte dose ;
• ± bêtabloquant et IEC ;
• traitement des facteurs de risque.
Notions inacceptables
Oublier les principes de la stratégie diagnostique dans les SCA :
• évoquer le diagnostic dès l’interrogatoire incluant l’analyse des symptômes et la prise en compte du terrain ;
• réaliser immédiatement un ECG pour poser le diagnostic d’IDMST + justifiant une revascularisation immédiate ;
• doser la troponine à l’admission et 1 à 2 heures plus tard ;
• évaluer la gravité du SCA qui conditionne le délai de réalisation d’une coronarographie.
Oublier au décours du SCA :
• de prescrire ne double antiagrégation plaquettaire ;
• de prescrire une statine ;
• de prendre en charge les facteurs de risque au décours d’un SCA (tabagisme, sédentarité, surcharge pondérale, HTA, diabète).
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

Le Journal du CCF - Numéro 24 Retrouvez les sujets brûlants en cardiologie dans [...]

CARDIOLOGIE PÉDIATRIQUE Closure of Secundum Atrial Septal Defect and Risk of Incident and Recurrent [...]


