Suivez-nous sur les réseaux sociaux !
Sommaire du chapitre :
Dernières publications
Publications
Chapitre 09 – Item : 152 Endocardite infectieuse
I. Définition
II. Épidémiologie
III. Micro-organismes en cause
IV. Physiopathologie
V. Diagnostic
VI. Complications et pronostic
VII. Traitement
VIII. Prévention
Situations de départ
18 Découverte d’anomalies à l’auscultation cardiaque.
20 Découverte d’anomalies à l’auscultation pulmonaire.
21 Asthénie.
44 Hyperthermie/fièvre.
50 Malaise/perte de connaissance.
54 Œdème localisé ou diffus.
58 Splénomégalie.
89 Purpura/ecchymose/hématome.
102 Hématurie.
121 Déficit neurologique sensitif et/ou moteur.
160 Détresse respiratoire aiguë.
161 Douleur thoracique.
162 Dyspnée.
165 Palpitations.
166 Tachycardie.
178 Demande/prescription raisonnée et choix d’un examen diagnostique.
185 Réalisation et interprétation d’un électrocardiogramme (ECG).
186 Syndrome inflammatoire aigu ou chronique.
187 Bactérie multirésistante à l’antibiogramme.
190 Hémoculture positive.
199 Créatinine augmentée.
203 Élévation de la protéine C-réactive (CRP).
217 Baisse de l’hémoglobine.
226 Découverte d’une anomalie du cerveau à l’examen d’imagerie médicale.
228 Découverte d’une anomalie osseuse et articulaire à l’examen d’imagerie médicale.
232 Demande d’explication d’un patient sur le déroulement, les risques et les bénéfices attendus d’un examen d’imagerie.
238 Demande et préparation aux examens endoscopiques (bronchiques, digestifs).
239 Explication préopératoire et recueil de consentement d’un geste invasif diagnostique ou thérapeutique.
248 Prescription et suivi d’un traitement par anticoagulant et/ou antiagrégant.
253 Prescrire des diurétiques.
255 Prescrire un anti-infectieux.
271 Prescription et surveillance d’une voie d’abord vasculaire.
285 Consultation de suivi éducation thérapeutique d’un patient avec un antécédent cardiovasculaire.
311 Prévention des infections liées aux soins.
320 Prévention des maladies cardiovasculaires.
352 Expliquer un traitement au patient (adulte/enfance/adolescent).
354 Évaluation de l’observance thérapeutique.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé |
|---|---|---|
| Définition | Connaître la définition d’une endocardite infectieuse (EI) | |
| Épidémiologie | Connaître l’épidémiologie de l’EI | |
| Épidémiologie | Connaître les situations à risque d’EI (cardiopathie du groupe A, présence de matériel intracardiaque, bactériémie à cocci Gram positif) | |
| Étiologies | Connaître les principaux agents infectieux à l’origine d’EI (bactéries, levures) | |
| Physiopathologie | Connaître les portes d’entrée en fonction de l’agent infectieux | |
| Physiopathologie | Connaître les cardiopathies à risque d’EI du groupe B | |
| Diagnostic positif | Connaître les signes cliniques évocateurs EI | |
| Diagnostic positif | Connaître la démarche initiale du diagnostic microbiologique | |
| Diagnostic positif | Connaître la démarche du diagnostic microbiologique quand les hémocultures initiales sont négatives | |
| Diagnostic positif | Connaître la démarche initiale du diagnostic échocardiographie en cas de suspicion d’EI | |
| Diagnostic positif | Connaître les arguments échocardiographiques du diagnostic d’EI | |
| Examens complémentaires | Savoir hiérarchiser les examens complémentaires en fonction de l’état clinique du patient (hémocultures, échocardiographie, autres examens complémentaires) | |
| Examens complémentaires | Connaître les principales localisations emboliques en cas d’EI | |
| Identifier une urgence | Savoir quand une antibiothérapie probabiliste est indiquée en cas de suspicion d’EI | |
| Prise en charge | Connaître les principes du traitement antibiotique de l’EI | |
| Prise en charge | Connaître les modalités de prise en charge la porte d’entrée d’une EI | |
| Prise en charge | Connaître les principes d’éducation à la santé après un épisode d’EI | |
| Prise en charge | Connaître les principes de l’antibioprophylaxie de l’EI (groupe de cardiopathie à risque, gestes à risque) | |
| Suivi et/ou pronostic | Connaître les principales complications des EI : complications cardiaques, complications emboliques, complications infectieuses |
I Définition
![]() L’endocardite infectieuse (EI) est une infection de l’endocarde touchant le plus souvent une ou plusieurs valves cardiaques natives mais pouvant également intéresser l’endocarde pariétal ou tout matériel intracardiaque implanté (prothèses valvulaires, sondes de stimulateurs, sondes de défibrillateurs, assistances ventriculaires, cathéter veineux central). Le micro-organisme (germe) en cause est une bactérie ou plus rarement un champignon (agent fongique). Il existe des endocardites non infectieuses beaucoup plus rares qui peuvent être liées à des cancers (endocardites marastiques) ou des maladies auto-immunes (lupus [lésions de Libman-Sacks], syndrome des anticorps antiphospholipides).
L’endocardite infectieuse (EI) est une infection de l’endocarde touchant le plus souvent une ou plusieurs valves cardiaques natives mais pouvant également intéresser l’endocarde pariétal ou tout matériel intracardiaque implanté (prothèses valvulaires, sondes de stimulateurs, sondes de défibrillateurs, assistances ventriculaires, cathéter veineux central). Le micro-organisme (germe) en cause est une bactérie ou plus rarement un champignon (agent fongique). Il existe des endocardites non infectieuses beaucoup plus rares qui peuvent être liées à des cancers (endocardites marastiques) ou des maladies auto-immunes (lupus [lésions de Libman-Sacks], syndrome des anticorps antiphospholipides).
II Épidémiologie
L’incidence de l’EI n’a pas diminué au cours des dernières décennies mais le profil des patients atteints ainsi que la répartition des micro-organismes en cause se sont modifiés. En effet, avec le vieillissement de la population, les progrès médicaux, la modification des modes de vie et la régression des valvulopathies post-rhumatismales, les patients atteints sont désormais plus âgés et/ou présentent d’autres situations exposant à l’EI comme :
• ![]() les valvulopathies dégénératives (fibrose, prolapsus mitral) ;
les valvulopathies dégénératives (fibrose, prolapsus mitral) ;
• l’augmentation des procédures de soins à risque : chirurgie sous circulation extracorporelle, cathéters veineux, cathétérisme cardiaque, hémodialyse, implantation de stimulateur/défibrillateur cardiaque, ponction articulaire, chambre implantable sous-cutanée pour perfusions intraveineuses, etc. ;
• la toxicomanie intraveineuse.
III Micro-organismes en cause
![]() Il s’agit le plus souvent d’une bactérie et plus rarement d’un champignon qui infecte l’endocarde à partir d’une porte d’entrée infectieuse (cf. tableau 9.1). Les cocci Gram + en amas (Staphylococcus aureus et staphylocoques coagulase négative) et en chaînettes (streptocoques et entérocoques) sont les micro-organismes le plus souvent retrouvés. Les staphylocoques représentent actuellement la cause la plus fréquente.
Il s’agit le plus souvent d’une bactérie et plus rarement d’un champignon qui infecte l’endocarde à partir d’une porte d’entrée infectieuse (cf. tableau 9.1). Les cocci Gram + en amas (Staphylococcus aureus et staphylocoques coagulase négative) et en chaînettes (streptocoques et entérocoques) sont les micro-organismes le plus souvent retrouvés. Les staphylocoques représentent actuellement la cause la plus fréquente.
Tableau 9.1 ![]() Micro-organismes le plus souvent en cause dans l’endocardite infectieuse avec leurs portes d’entrée potentielles.
Micro-organismes le plus souvent en cause dans l’endocardite infectieuse avec leurs portes d’entrée potentielles.
| Micro-organisme (germe) | Fréquence (%) | Porte d’entrée |
|---|---|---|
| Staphylococcus aureus | 30 | Cutanée (plaies, cathéter veineux, cathéter de dialyse, toxicomanie IV, peropératoire, stimulateur/défibrillateur implantables, etc.) |
| Streptocoques oraux (S. sanguis, S. mitis, S. salivarius, S. mutans) | 20 | Buccodentaire |
| Streptocoques du groupe D (S. gallolyticus ou bovis) |
13 | Digestive (cancer, polypes, diverticules coliques) |
| Staphylocoques coagulase négative (S. epidermidis, S. lugdunensis, etc.) |
10 | Cutanée (plaies, cathéter veineux, cathéter de dialyse, toxicomanie IV, peropératoire, stimulateur/défibrillateur implantables, etc.) |
| Entérocoques (E. faecalis, E. faecium) |
10 | Digestive (cancer, polypes, diverticules coliques) Urinaires |
| Bactéries du groupe HACEK | 5 | Bucco-dentaire |
| Candida et autres champignons | < 5 | Cutanée (immunosuppression, cathéter veineux, cathéter de dialyse, toxicomanie IV, peropératoire, stimulateur/défibrillateur implantables, etc.) |
| Autres (Coxiella burnetii, Bartonella, Brucella, Chlamydia, Tropheryma whipplei, etc.) |
< 5 | Spécifique à chaque germe |
| Non retrouvé par différentes techniques | 5–10 | – |
HACEK : Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae ; IV : intraveineux.
IV Physiopathologie
La séquence du mécanisme général responsable de l’apparition d’une EI est la suivante et résumée dans la figure 9.1.
Fig. 9.1 ![]() Résumé de la séquence du mécanisme général responsable de l’apparition d’une endocardite infectieuse (EI) et de ses complications.
Résumé de la séquence du mécanisme général responsable de l’apparition d’une endocardite infectieuse (EI) et de ses complications.
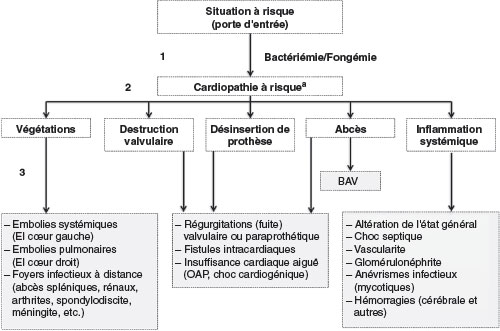
BAV : bloc atrioventriculaire ; OAP : œdème aigu du poumon. A. Certaines EI surviennent en l’absence de cardiopathie à risque.
• Une bactériémie (ou fongémie) importante et/ou répétée survient à partir d’une porte d’entrée infectieuse (situation à risque).
• Les micro-organismes qui ont pénétré dans la circulation sanguine peuvent coloniser et infecter des lésions préexistantes de l’endocarde. Ces lésions préexistantes constituent ce que l’on appelle les cardiopathies à risque d’EI, qui parfois n’étaient pas préalablement connues ou absentes (50 % des cas). Il peut s’agir de valvulopathies (dégénératives, bicuspidie, post-rhumatismales, etc.), de cardiopathies congénitales ou de matériel intracardiaque. Ces cardiopathies sont classées en fonction de leur degré de risque (cf. encadré 9.1). Parfois, lorsque le micro-organisme est très virulent (ex : Staphylococcus aureus), l’infection survient sur un endocarde préalablement sain.
• Les lésions infectieuses endocardiques et systémiques suivantes peuvent ensuite apparaître :
– végétations : lésions élémentaires proliférantes de l’EI, elles sont constituées d’un amas de fibrine, de plaquettes, de cellules inflammatoires et de micro-organismes. Elles peuvent être à l’origine d’embolies pouvant créer des accidents ischémiques systémiques (EI du cœur gauche), des embolies pulmonaires septiques (EI du cœur droit) et des foyers infectieux à distance. Rarement, elles peuvent obstruer l’orifice valvulaire ;
– destructions valvulaires : mutilations, perforations valvulaires ou ruptures de cordages ou de sigmoïdes de bioprothèse pouvant être responsables de régurgitation (fuites) aiguës et d’insuffisance cardiaque ;
– abcès : collection de pus pouvant créer un bloc atrioventriculaire lorsqu’il est localisé près des voies de conduction (abcès septal des EI aortiques), se rompre et créer un faux anévrisme ou une fistule intracardiaque ;
– désinsertions de prothèses valvulaires avec fuite paraprothétique ;
– phénomènes inflammatoires, immunologiques et vasculaires systémiques : choc septique, anévrismes infectieux (Mycotiques) avec risque hémorragique, glomérulonéphrite, purpura vasculaire, lésions cutanéomuqueuses et ophtalmiques (faux panaris d’Osler, placards de Janeway, taches rétiniennes de Roth), présence de facteurs rhumatoïdes et éventuellement de cryoglobulinémie.
Encadré 9.1 Cardiopathies à risque d’endocardite infectieuse
| Cardiopathies à haut risque (groupe A) • Prothèses valvulaires (TAVI inclus) et matériels utilisés pour réparation valvulaire • Antécédent d’endocardite • Cardiopathie congénitale cyanogène • Toute cardiopathie congénitale réparée avec un matériel prothétique pendant les 6 mois après la procédure ou à vie s’il existe un shunt résiduel |
Cardiopathies à risque intermédiaire (groupe B) • • Prolapsus valvulaire mitral • Rétrécissement aortique, insuffisance aortique, insuffisance mitrale • Cardiopathies congénitales n’entrant pas dans le groupe A (sauf communication interatriale isolée) • Cardiomyopathie hypertrophique obstructive (souffle à l’auscultation) TAVI : Transcatheter Aortic Valve Implantation |
V Diagnostic
L’EI est une maladie systémique à présentation polymorphe (tous les signes ne sont pas forcément présents). Le contexte est très important pour évoquer le diagnostic. L’association d’un syndrome infectieux et de signes d’atteinte endocardique est très évocatrice.
| Tableaux cliniques évoquant un diagnostic d’endocardite infectieuse • Cardiopathie à risque d’EI + fièvre • Souffle cardiaque + fièvre • Accident ischémique + fièvre • Purpura + fièvre • Lombalgie + fièvre |
A Signes cliniques
Les signes suivants peuvent être présents :
• syndrome infectieux :
– fièvre,
– altération de l’état général,
– splénomégalie (20–30 %) ;
• signes cardiaques :
– souffle cardiaque. Devant un syndrome infectieux inexpliqué, le souffle cardiaque a une valeur diagnostique considérable. La plus grande valeur est à l’apparition d’un nouveau souffle ou à la modification d’un souffle connu. L’absence de souffle ne permet cependant pas d’exclure le diagnostic,
– insuffisance cardiaque. Toute insuffisance cardiaque fébrile doit faire évoquer le diagnostic d’endocardite,
– syncopes, lipothymies. Elles peuvent être secondaires à un bloc atrioventriculaire lié à un abcès septal interrompant les voies de conduction ;
• signes extracardiaques :
– neurologiques : signes d’AVC (ischémique ou hémorragique), méningite, hémorragie méningée ou abcès cérébral,
– pulmonaires : signes d’insuffisance cardiaque gauche (OAP) ou d’embolie pulmonaire septique (tableau de pneumopathies récidivantes abcédées),
– articulaires : signes d’arthrite périphérique ou de spondylodiscite (foyer infectieux à distance),
– cutanéomuqueux. Ils sont rares (5–15 % des cas) : purpura, nodosités (« faux panaris ») d’Osler, pathognomoniques, hémorragies sous-unguéales, hémorragies sous-conjonctivales, placards érythémateux palmoplantaires de Janeway,
– ophtalmiques : taches de Roth au fond d’œil (exsudats hémorragiques rétiniens),
– rénaux : hématurie (et/ou protéinurie) pouvant témoigner d’une glomérulonéphrite immunologique ou d’un infarctus rénal.
B Signes paracliniques
Les hémocultures et l’échographie cardiaque sont les deux piliers du diagnostic de l’EI mais sont parfois insuffisantes. Les examens complémentaires ont pour but de mettre en évidence le micro-organisme en cause, de confirmer l’atteinte infectieuse de l’endocarde, d’identifier les complications et la porte d’entrée infectieuse.
1 Identification microbiologique
Hémocultures
Elles permettent d’isoler le micro-organisme responsable dans 90 % des cas (10 % d’EI à hémocultures négatives). Trois prélèvements sanguins veineux en moyenne doivent être réalisés sur 24 heures et espacés d’au moins 1 heure avec mise en culture aéro-anaérobie. Le sang ne doit pas être prélevé sur un cathéter déjà en place. Ils sont à répéter durant 2 ou 3 jours si les hémocultures initiales sont négatives, notamment chez les sujets ayant reçu des antibiotiques. La suspicion d’EI est à signaler au laboratoire de microbiologie car il faut parfois un temps de culture long pour les micro-organismes à croissance difficile (groupe HACEK [Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae], Brucella, streptocoques déficients, levures). Si la présomption d’EI est forte et si les hémocultures restent négatives, on doit envisager les étiologies des EI à hémocultures négatives (cf. encadré 9.2) et recourir à d’autres méthodes diagnostiques parfois combinées qui incluent des techniques spéciales d’hémocultures, les sérologies et l’amplification génique (Polymerase Chain Reaction [PCR]).
Analyse de la pièce chirurgicale
Si le patient a dû être opéré, les fragments de valves, végétations, abcès, matériel intracardiaque retirés doivent être analysés sur le plan histologique, mis en culture et éventuellement par amplification génique (PCR).
Encadré 9.2 Causes d’endocardite à hémocultures négatives
| • • EI dues à des micro-organismes à croissance lente ou difficile • Streptocoques déficients • Groupe HACEK • Brucella • Champignons (agents fongiques) • EI dues à des micro-organismes intracellulaires • Coxiella burnetii (agent de la fièvre Q) • Chlamydia • Bartonella • Tropheryma whipplei (agent de la maladie de Whipple) • Mycoplasma • Legionella • Endocardites non infectieuses (lupus, syndrome des anticorps antiphospholipides, cancer [endocardites marastiques]) HACEK : Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae. |
2 Identification de l’atteinte infectieuse de l’endocarde
Échographie cardiaque
• Une échographie transthoracique (ETT) est systématiquement réalisée en 1re intention dans tous les cas.
• Une échographie transœsophagienne (ETO) est systématiquement réalisée si l’ETT est positive, si elle est négative avec une forte suspicion et systématiquement en cas de matériel intracardiaque (prothèses, stimulateurs, défibrillateurs, etc.). Elle a une meilleure sensibilité que l’ETT.
• L’échographie permet :
– la mise en évidence des lésions d’EI : végétations (cf. fig. 9.2, vidéos 9.1 et vidéo 9.2), destructions valvulaires (mutilations, perforations, ruptures de cordages), abcès (cf. vidéo 9.3), fistules, désinsertions de prothèses, fuites paraprothétiques (cf. vidéo 9.4),
– l’évaluation de la sévérité des régurgitations (fuites) valvulaires et de leur retentissement sur la fonction cardiaque.
• Une échographie normale n’élimine pas le diagnostic et doit être répétée après 7–10 jours (ETT + ETO).
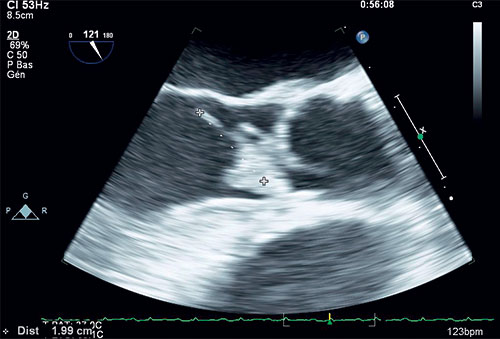
Fig. 9.2 ![]() Échographie transœsophagienne centrée sur la valve aortique native montrant une volumineuse végétation.
Échographie transœsophagienne centrée sur la valve aortique native montrant une volumineuse végétation.
Autres examens d’imagerie cardiaque
• Le scanner cardiaque peut mettre en évidence des abcès non visualisés à l’échographie, notamment en cas de prothèses valvulaires (cf. fig. 9.3).
• La tomographie par émission de positons au 18FDG couplée au scanner (TEP-scan) et la scintigraphie aux leucocytes marqués peuvent mettre en évidence une hyperfixation du traceur en cas d’infection. Ils sont actuellement utilisés en cas de suspicion d’EI sur prothèses valvulaires avec échographie cardiaque non contributive (cf. fig. 9.4). De plus, lorsqu’ils sont réalisés sur l’ensemble du corps, ils peuvent objectiver des localisations septiques secondaires.
Fig. 9.3 ![]() Scanner cardiaque injecté chez un patient porteur d’une bioprothèse aortique montrant un abcès (flèche) développé sur la partie latérale de l’anneau prothétique et communicant avec la cavité cardiaque (abcès communiquant = faux anévrisme).
Scanner cardiaque injecté chez un patient porteur d’une bioprothèse aortique montrant un abcès (flèche) développé sur la partie latérale de l’anneau prothétique et communicant avec la cavité cardiaque (abcès communiquant = faux anévrisme).
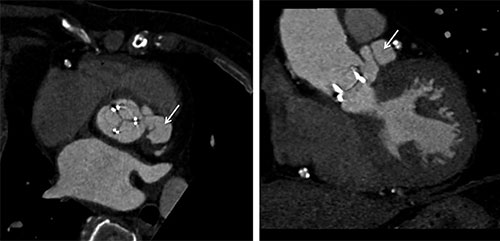
Fig. 9.4 ![]() Tomographie par émission de positons couplée au scanner au 18F-fluorodésoxyglucose (18FDG) montrant une hyperfixation au niveau d’une prothèse mécanique aortique.
Tomographie par émission de positons couplée au scanner au 18F-fluorodésoxyglucose (18FDG) montrant une hyperfixation au niveau d’une prothèse mécanique aortique.
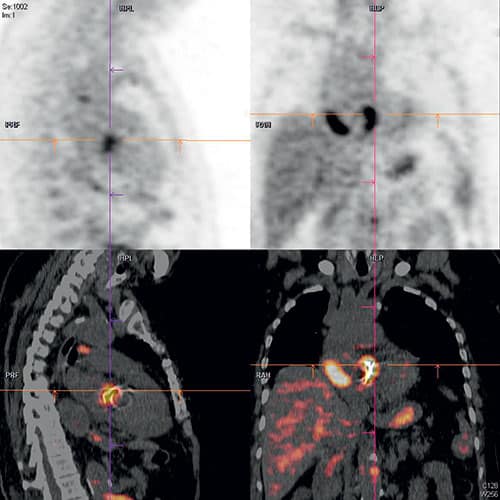
Le FDG s’accumule dans les zones d’hypermétabolisme telles que les zones inflammatoires ou les cancers.
3 Autres examens complémentaires
Ce sont les suivants :
• NFS, plaquettes à la recherche d’une hyperleucocytose à PNN (polynucléaires neutrophiles), d’une anémie inflammatoire ou hémolytique, d’une thrombopénie ;
• CRP : une élévation est en faveur d’un syndrome inflammatoire ;
• facteur rhumatoïde : témoin d’une réaction immunologique ;
• ionogramme sanguin, créatininémie, recherche hématurie et protéinurie : à la recherche d’anomalies liées aux complications rénales ;
• ECG : à la recherche d’anomalies de la conduction (BAV), d’ischémie myocardique (embolies coronariennes) ;
• radiographie thoracique : pour visualiser des signes d’OAP (EI du cœur gauche) ou de pneumopathies (EI du cœur droit) ;
• scanner cérébral et thoraco-abdomino-pelvien : à la recherche de localisations septiques secondaires qui peuvent être parfois asymptomatiques (encéphale, rate, rein, foie, vertèbres, etc.) et d’anévrismes infectieux (mycotiques). Il est fait après injection de produit de contraste si la fonction rénale le permet (risque d’insuffisance rénale aiguë) ;
• IRM cérébrale : de meilleure sensibilité que le scanner mais moins disponible ;
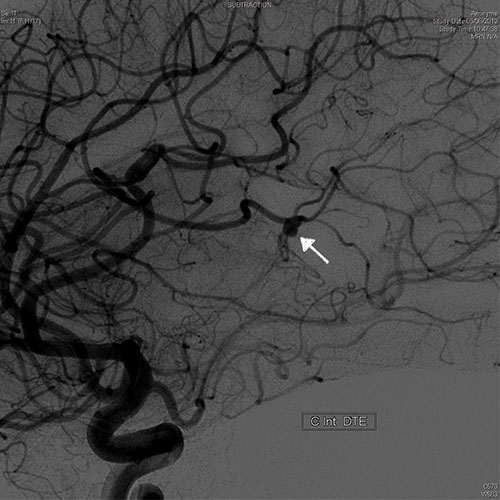
• angiographie cérébrale : en cas de suspicion d’anévrisme infectieux (mycotique) (cf. fig. 9.5) ;
• coronarographie, troponine : en cas de suspicion d’embolie coronarienne ;
• examens à la recherche de la porte d’entrée infectieuse dépendant notamment du micro-organisme identifié. La porte d’entrée n’est identifiée que dans 50 % des cas. Il peut s’agir :
– d’une origine bucco-dentaire : panoramique dentaire + consultation stomatologique,
– d’une origine digestive : coloscopie à la recherche d’une tumeur colique en cas d’EI à Streptococcus gallolyticus (ex : S. bovis) ou à entérocoques,
– d’une origine urinaire : ECBU (examen cytobactériologique des urines), échographie (ou scanner) des voies urinaires.
Fig. 9.5 ![]() Angiographie cérébrale montrant un anévrisme infectieux (mycotique) (flèche).
Angiographie cérébrale montrant un anévrisme infectieux (mycotique) (flèche).
C Formes cliniques
1 EI du cœur droit
• ![]() Elles touchent surtout les toxicomanes intraveineux, les porteurs de stimulateurs ou défibrillateurs cardiaques, les porteurs de voies veineuses centrales et les personnes souffrant de cardiopathies congénitales avec atteinte droite.
Elles touchent surtout les toxicomanes intraveineux, les porteurs de stimulateurs ou défibrillateurs cardiaques, les porteurs de voies veineuses centrales et les personnes souffrant de cardiopathies congénitales avec atteinte droite.
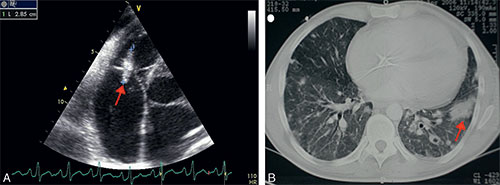
• On note des signes respiratoires liés à des pneumopathies infectieuses récidivantes et souvent abcédées, secondaires aux embolies pulmonaires septiques provenant des végétations du cœur droit (cf. fig. 9.6, vidéo 9.5 et vidéo 9.6).
• On note des signes respiratoires liés à des pneumopathies infectieuses récidivantes et souvent abcédées, secondaires aux embolies pulmonaires septiques provenant des végétations du cœur droit (cf. fig. 9.6, vidéo 9.5 et vidéo 9.6).
Fig. 9.6 ![]() Échographie transœsophagienne (A) montrant une végétation (flèche) sur la valve tricuspide d’un patient toxicomane IV et scanner pulmonaire (B) montrant une pneumopathie bilatérale avec abcès pulmonaire (flèche) liée à des embolies pulmonaires septiques chez le même patient.
Échographie transœsophagienne (A) montrant une végétation (flèche) sur la valve tricuspide d’un patient toxicomane IV et scanner pulmonaire (B) montrant une pneumopathie bilatérale avec abcès pulmonaire (flèche) liée à des embolies pulmonaires septiques chez le même patient.
• Les staphylocoques sont les micro-organismes les plus fréquents chez le toxicomane et le porteur de stimulateur ou défibrillateur cardiaque.
• Les EI du cœur droit nécessitent le retrait du matériel le cas échéant en plus des antibiotiques.
2 EI sur prothèses valvulaires
• Les EI précoces surviennent dans l’année qui suit leur implantation, leur origine est souvent une contamination périopératoire.
• Les EI tardives surviennent plus d’un an après l’implantation.
• Le risque d’EI est identique sur prothèses biologiques et mécaniques.
• Le pronostic est plus sévère que celui des EI sur valves natives.
D Critères diagnostiques
Compte tenu du caractère polymorphe de cette maladie, des critères diagnostiques ont été établis permettant de classer les diagnostics en « certain », « possible » et « exclu ». Ils sont résumés dans l’encadré 9.3.
Encadré 9.3 Résumé des critères diagnostiques des endocardites infectieuses adapté des recommandations européennes de 2015
| EI certaine • • Critères cliniques : – 2 critères majeurs – ou 1 critère majeur et 3 mineurs – ou 5 critères mineursEI possible • 1 critère majeur et 1 ou 2 mineurs • Ou 3 critères mineursEI exclue Absence de critères d’EI certaine et possible.Critères cliniques Critères cliniques majeurs (2) • Hémocultures positives pour l’EI – ≥ 2 hémocultures à micro-organisme typique d’EI (S. aureus, streptocoques oraux, Streptococcus gallolyticus, entérocoques, HACEK) – Ou ≥ 1 hémoculture positive ou 1 sérologie positive à Coxiella burnetii • Imagerie positive pour les lésions d’EI – Échographie cardiaque positive : végétations, abcès, faux anévrisme, fistule, destruction valvulaire, désinsertion de prothèse – Ou TEP-scan ou scintigraphie aux leucocytes marqués cardiaques positifs : hyperfixation pathologique sur prothèse valvulaire – Ou scanner cardiaque positif : abcès, faux anévrisme, fistule Critères cliniques mineurs (5) • Cardiopathie à risque ou toxicomanie IV • Fièvre (T ≥ 38 °C) • Phénomènes vasculaires (asymptomatiques inclus) : embolies artérielles systémiques ou pulmonaires, anévrismes infectieux (mycotiques), hémorragies, placards de Janeway • Phénomènes immunologiques : glomérulonéphrite, nodosités d’Osler, taches de Roth, facteurs rhumatoïdes Argument microbiologique n’entrant pas dans la définition d’un critère majeur : hémocultures, sérologies EI : endocardite infectieuse ; HACEK : Haemophilus spp., Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae ; IV : intraveineux ; TEP : tomographie par émission de positions. |
VI Complications et pronostic
• ![]() C’est une maladie grave dont la mortalité hospitalière est de l’ordre de 15–30 %.
C’est une maladie grave dont la mortalité hospitalière est de l’ordre de 15–30 %.
• Les principales complications sont résumées dans la figure 9.1.
• Les principales causes de décès sont l’insuffisance cardiaque aiguë et les complications neurologiques.
• Les principaux facteurs de mauvais pronostic sont :
– l’insuffisance cardiaque aiguë ;
– les complications neurologiques ;
– le syndrome infectieux mal maîtrisé ;
– les abcès intracardiaques ;
– les EI sur prothèses ;
– des végétations volumineuses
– les micro-organismes très virulents : Staphylococcus aureus et champignons ;
– le terrain fragile (comorbidités) : âge avancé, diabète, immunodépression, insuffisances cardiaque, rénale, respiratoire préexistantes.
VII Traitement
Il repose sur l’antibiothérapie (ou les antifongiques), l’identification d’indications chirurgicales, la prise en charge des complications, le traitement de la porte d’entrée et la surveillance. Il nécessite une prise en charge par des équipes spécialisées associant notamment cardiologues, infectiologues et chirurgiens cardiaques.
A Antibiothérapie
1 Principes généraux
• Le choix se porte sur une antibiothérapie bactéricide, associant plusieurs molécules synergiques, à fortes doses, par voie intraveineuse pendant une durée prolongée (4 à 6 semaines).
• Une antibiothérapie probabiliste est instaurée après les hémocultures et avant leur résultat en cas de forte suspicion ou de sepsis sévère ou d’indication chirurgicale urgente.
• L’antibiothérapie est secondairement adaptée aux résultats des prélèvements microbiologiques (antibiogramme) avec l’aide d’un infectiologue (cf. tableau 9.2).
2 Posologies
![]() Le traitement antibiotique détaillé est le dans le tableau 9.3.
Le traitement antibiotique détaillé est le dans le tableau 9.3.
![]() L’amoxicilline (comme l’ampicilline) est une pénicilline A, l’oxacilline (comme la cloxacilline) est une pénicilline M, la gentamicine est un aminoside, la vancomycine est un glycopeptide, la rifampicine est la rifamycine, la ceftriaxone est une céphalosporine de 3e génération.
L’amoxicilline (comme l’ampicilline) est une pénicilline A, l’oxacilline (comme la cloxacilline) est une pénicilline M, la gentamicine est un aminoside, la vancomycine est un glycopeptide, la rifampicine est la rifamycine, la ceftriaxone est une céphalosporine de 3e génération.
• La durée de traitement est identique même si une intervention chirurgicale est nécessaire.
• Les doses doivent être adaptées aux fonctions rénale et hépatique ainsi qu’aux mesures des concentrations plasmatiques d’aminosides et de vancomycine.
• L’efficacité du traitement est surveillée régulièrement par :
– la régression de la fièvre ;
– la régression du syndrome inflammatoire biologique ;
– la stérilisation des hémocultures ;
– l’évolution favorable des lésions à l’échographie ;
– l’absence de complications (clinique, imagerie, ECG, biologie).
• On surveille régulièrement la tolérance du traitement en évaluant la fonction rénale sous aminosides et vancomycine surtout, mais aussi amoxicilline (par réactions immunoallergiques ou des cristalluries, responsables d’atteintes interstitielles aiguës ou de nécroses tubulaires aiguës).
Tableau 9.2 ![]() Résumé de l’antibiothérapie IV des principales endocardites infectieuses.
Résumé de l’antibiothérapie IV des principales endocardites infectieuses.
| Micro-organisme en cause | Absence d’allergie aux β-lactamines | Allergie ou résistance aux β-lactamines |
|---|---|---|
| Non encore identifié (probabiliste) en cas d’EI communautaire sur valve native ou sur prothèse valvulaire ≥ 1 an | Amoxicilline + oxacilline + gentamicine | Vancomycine + gentamicine |
| Non encore identifié (probabiliste) en cas d’EI non communautaire ou sur prothèse valvulaire < 1 an | Vancomycine + gentamicine + rifampicine | |
| Staphylococcus aureus et staphylocoques coagulase négative | Oxacilline (+ gentamicine + rifampicine si prothèse valvulaire) |
Vancomycine (+ gentamicine + rifampicine si prothèse valvulaire) |
| Streptocoques oraux et du groupe D (S. gallolyticus) | Amoxicilline (ou pénicilline G, ou ceftriaxone) ± gentamicine | Vancomycine ± gentamicine |
| Entérocoques | Amoxicilline + gentamicine ou Amoxicilline + ceftriaxone |
Vancomycine ± gentamicine |
Tableau 9.3 ![]() Antibiothérapie IV détaillée des principales endocardites infectieuses.
Antibiothérapie IV détaillée des principales endocardites infectieuses.
| Micro-organisme en cause | Absence d’allergie aux β-lactamines | Allergie ou résistance aux β-lactamines |
|---|---|---|
| Non encore identifié (probabiliste) en cas d’EI communautaire sur valve native ou sur prothèse valvulaire ≥ 1 an | Amoxicilline (12 g/j) + oxacilline (12 g/j) + gentamicine (3 mg/kg/j) | Vancomycine (30 à 60 mg/kg/j) + gentamicine (3 mg/kg/j) |
| Non encore identifié (probabiliste) en cas d’EI non communautaire ou sur prothèse valvulaire < 1 an | Vancomycine (30 à 60 mg/kg/j) + gentamicine (3 mg/kg/j) + rifampicine (900–1 200 mg/j) | |
| Staphylococcus aureus et staphylocoques coagulase négative | Oxacilline (12 g/j) pendant 6 semaines (+ gentamicine 3 mg/kg/j pendant 2 semaines + rifampicine 900–1 200 mg pendant 6 semaines si prothèse valvulaire) |
Vancomycine (30 à 60 mg/kg/j) pendant 6 semaines (+ gentamicine 3 mg/kg/j pendant 2 semaines + rifampicine 900–1 200 mg pendant 6 semaines si prothèse valvulaire) |
| Streptocoques oraux et du groupe D (S. gallolyticus) avec CMI ≤ 0,125 mg/L | Pénicilline G (12–18 MUI/j) ou amoxicilline (12 g/j) ou ceftriaxone (2 g/j) pendant 4 semaines ou pendant 2 semaines en association avec gentamicine (3 mg/kg/j) | Vancomycine (30 mg/kg/j) pendant 4 semaines |
| Streptocoques oraux et du groupe D (S. gallolyticus) avec CMI > 0,125 mg/L | Pénicilline G (12–18 MUI/j) ou amoxicilline (12 g/j) ou ceftriaxone (2 g/j) pendant 4 semaines + gentamicine (3 mg/kg/j) pendant 2 semaines | Vancomycine (30 mg/kg/j) pendant 4 semaines + gentamicine (3 mg/kg/j) pendant 2 semaines |
| Entérocoques | Amoxicilline (12 g/j) pendant 6 semaines + gentamicine (3 mg/kg/j) pendant 6 semaines ou Amoxicilline (12 g/j) pendant 6 semaines + ceftriaxone (4 g/j) pendant 6 semaines |
Vancomycine (30 à 60 mg/kg/j) pendant 6 semaines + gentamicine (3 mg/kg/j) pendant 6 semaines |
CMI : concentration minimale inhibitrice.
B Chirurgie
Dans environ 50% des cas, il existe une indication à réaliser une chirurgie cardiaque sans attendre la fin du traitement antibiotique (phase active de l’EI). Celle-ci peut être présente d’emblée ou apparaître au cours de l’évolution. Dès que le diagnostic est posé, un chirurgien cardiaque doit être prévenu. Le traitement consiste en un débridement des tissus infectés ou nécrosés, puis la réparation (plastie) valvulaire si c’est possible ou le remplacement valvulaire par prothèse biologique ou mécanique. Les principales indications sont hémodynamiques (H), infectieuses (I) et emboliques (E) (cf. encadré 9.4).
Encadré 9.4 Principales indications chirurgicales en phase active d’une endocardite infectieuse
| • • (H) EI avec dysfonction sévère de prothèse • (I) Abcès, fistule ou faux anévrisme intracardiaque • (I) EI fungique ou à germes multirésistants • (I) EI sur prothèse valvulaire à staphylocoques • (I) Persistances d’hémocultures positives sous antibiothérapie • (E) Végétations du cœur gauche volumineuse (> 10 mm) après un épisode embolique sous antibiothérapie ou en cas de fuite sévère associée • (E) Végétation > 30 mm • (H) + (E) Végétations > 10 mm associées à une fuite ou obstruction valvulaire sévère • (I) + (E) Augmentation de la taille des végétations sous antibiothérapie • (I) En cas d’EI sur stimulateur ou défibrillateur cardiaque, tout le matériel doit être extrait le plus souvent par voie percutanée. La réimplantation doit se faire à distance (matériel de stimulation provisoire en attendant la réimplantation des patients dépendants). En cas d’EI sur cathéter veineux central, celui-ci doit être retiré. (H) : indications hémodynamiques ; (I) : indications infectieuses ; (E) : indications emboliques. |
VIII Prévention
Elle repose sur des mesures non spécifiques d’éducation de tous les patients à risque (toutes les cardiopathies à risque d’EI) et l’utilisation d’une antibioprophylaxie dans des situations bien précises.
A Mesures non spécifiques d’éducation
Elles concernent tous les patients présentant des cardiopathies à risque d’EI :
• maintenir une bonne hygiène bucco-dentaire et prévoir une consultation chez un dentiste 2 fois/an dans les cardiopathies à haut risque et 1 fois/an pour les autres ;
• désinfecter les plaies ;
• éradiquer les colonisations bactériennes chroniques (cutanées et urinaires) ;
• traiter les infections bactériennes locales par antibiotiques ;
• veiller à une asepsie stricte lors de procédures à risque de bactériémie ;
• éviter les effractions cutanées : tatouages, piercing ;
• limiter l’utilisation des voies veineuses et les changer régulièrement en cas de besoin prolongé ;
• éviter l’automédication par antibiotiques et consulter rapidement son médecin en cas de fièvre.
B Antibioprophylaxie
• Son principe consiste à administrer une dose d’antibiotique avant une procédure à risque de bactériémie. Son efficacité n’a jamais été prouvée formellement.
| Son utilisation se limite seulement aux patients avec cardiopathie à haut risque (cf. encadré 9.1) devant recevoir des soins dentaires avec manipulation de la gencive ou de la région périapicale ou en cas d’effraction de la muqueuse. |
• Elle consiste à administrer :
- amoxicilline per os ou IV 30–60 minutes avant la procédure ;
- ou clindamycine (600 mg) per os ou IV 30–60 minutes avant la procédure en cas d’allergie aux β-lactamines.
Points-clés
| • L’EI peut toucher des valves natives et du matériel intracardiaque implanté. • Les cardiopathies à haut risque d’EI sont : – les prothèses valvulaires (TAVI inclus) et matériels utilisés pour réparation valvulaire ; – un antécédent d’endocardite ; – une cardiopathie congénitale cyanogène ; – toute cardiopathie congénitale réparée avec un matériel prothétique pendant les 6 mois après la procédure ou à vie s’il existe un shunt résiduel. • Les EI sur prothèses et à staphylocoques sont les plus graves. • Dans 50 % des cas, la cardiopathie à risque n’était pas connue ou absente. • Les procédures à risque d’EI sont en augmentation : chirurgie sous circulation extracorporelle, cathéters veineux, cathétérisme cardiaque, hémodialyse, implantation de stimulateur/défibrillateur cardiaque, ponction articulaire, chambre implantable sous-cutanée pour perfusions intraveineuses, toxicomanie IV, etc. • Les staphylocoques sont les germes le plus souvent retrouvés. • Les principales complications sont : insuffisance cardiaque, embolies systémiques, embolies pulmonaires septiques, anévrisme infectieux, hémorragie, choc septique, BAV (abcès septal), vascularite, foyers infectieux à distance (méningite, arthrite, spondylodiscite, abcès viscéraux, etc.). • Le diagnostic est évoqué devant une association fièvre + cardiopathie à risque, fièvre + souffle, ou fièvre + événement embolique. • Les signes cliniques associent un syndrome infectieux, des signes cardiaques et des signes extracardiaques. • Les hémocultures et l’échographie cardiaque transthoracique/transœsophagienne sont deux piliers du diagnostic. • Les hémocultures peuvent être négatives dans 10 % des cas. • L’échographie peut montrer la présence de végétations, abcès, faux anévrisme, fistule, destruction valvulaire (perforation, mutilation valvulaire, rupture de cordage), désinsertion de prothèse. • Le scanner cardiaque, le TEP-scan et la scintigraphie aux leucocytes marqués peuvent avoir un intérêt en cas d’échographie non contributive. • La porte d’entrée infectieuse doit être recherchée en fonction du germe en cause : – staphylocoques, Candida : cutanée ; – streptocoques oraux, HACEK : bucco-dentaire ; – streptocoques D (S. gallolyticus) : digestive (coloscopie) ; – entérocoques : digestive (coloscopie), urinaire. • Le traitement repose sur l’antibiothérapie (ou les antifongiques), l’identification d’indications chirurgicales, la prise en charge des complications, le traitement de la porte d’entrée et la surveillance. • L’antibiothérapie doit être prolongée (4–6 semaines) par voie IV, bactéricide, synergique et débutée après les hémocultures (sans attendre les résultats). • Les principales indications chirurgicales pendant le traitement antibiotique (phase active) sont hémodynamiques, infectieuses et emboliques. • En cas d’EI sur stimulateur ou défibrillateur ou cathéter central veineux, tout le matériel doit être extrait (souvent par voie percutanée) et réimplanté à distance. • La prévention de l’EI repose sur des mesures non spécifiques d’éducation de tous les patients à risque (toutes les cardiopathies à risque d’EI) et l’utilisation d’une antibioprophylaxie uniquement chez les patients avec cardiopathie à haut risque devant subir des soins dentaires avec manipulation de la gencive ou de la région périapicale ou en cas d’effraction de la muqueuse (amoxicilline ou clindamycine 30–60 minutes avant). |
Notions indispensables et inacceptables
Notions indispensables
• Les cardiopathies à haut risque d’EI sont :
- les prothèses valvulaires (TAVI inclus) et matériels utilisés pour réparation valvulaire ;
- un antécédent d’endocardite ;
- une cardiopathie congénitale cyanogène ;
- toute cardiopathie congénitale réparée avec un matériel prothétique pendant les 6 mois après la procédure ou à vie s’il existe un shunt résiduel.
• Les staphylocoques sont les germes le plus souvent retrouvés.
• Les principales complications sont : insuffisance cardiaque, embolies systémiques, embolies pulmonaires septiques, anévrisme infectieux, hémorragie, choc septique, BAV (abcès septal), vascularite, foyers infectieux à distance (méningite, arthrite, spondylodiscite, abcès viscéraux, etc.).
• Le diagnostic est évoqué devant une association fièvre + cardiopathie à risque, fièvre + souffle, ou fièvre + événement embolique.
• Les hémocultures et l’échographie cardiaque transthoracique/transœsophagienne sont deux piliers du diagnostic.
• Le traitement repose sur l’antibiothérapie (ou les antifongiques), l’identification d’indications chirurgicales, la prise en charge des complications, le traitement de la porte d’entrée et la surveillance.
• Les principales indications chirurgicales pendant le traitement antibiotique (phase active) sont hémodynamiques, infectieuses et emboliques.
• La prévention de l’EI repose sur des mesures non spécifiques d’éducation de tous les patients à risque (toutes les cardiopathies à risque d’EI) et l’utilisation d’une antibioprophylaxie uniquement chez les patients avec cardiopathie à haut risque devant subir des soins dentaires avec manipulation de la gencive ou de la région périapicale ou en cas d’effraction de la muqueuse (amoxicilline ou clindamycine 30–60 minutes avant).
Notions inacceptables
• Ne pas évoquer une EI devant l’association d’une fièvre et d’un souffle cardiaque ou d’une cardiopathie à risque.
• Ne pas évoquer l’EI devant les tableaux suivants : souffle et fièvre, AVC et fièvre, lombalgie et fièvre, purpura et fièvre.
• Débuter les antibiotiques avant la réalisation d’hémocultures en cas de suspicion d’EI.
• Prescrire de la pénicilline en cas d’allergie.
• Oublier les mesures de prévention non médicamenteuses chez les patients à risque.
Réflexes transversalité
• Item 147 – Fièvre aiguë chez l’enfant et l’adulte
• Item 151 – Méningite, méningoencéphalite, abcès cérébral chez l’adulte et l’enfant
• Item 153 – Surveillance des porteurs de valves et prothèses vasculaires
• Item 155 – Infections cutanéo-muqueuses et des phanères, bactériennes et mycosiques de l’adulte et de l’enfant
• Item 156 – infections ostéoarticulaires de l’enfant et de l’adulte
• Item 157 – Septicémie/Bactériémie/fongémie de l’adulte et de l’enfant
• Item 158 – Sepsis et choc septique de l’enfant et de l’adulte
• Item 161 – Infections urinaires de l’enfant et de l’adulte
• Item 177 – Prescription et surveillance des anti-infectieux chez l’adulte et l’enfant
• Item 190 – Fièvre prolongée
• Item 191 – Fièvre chez un patient immunodéprimé
• Item 194 – Lupus systémique. Syndrome des antiphospholipides
• Item 200 – Douleur et épanchement articulaire. Arthrite d’évolution récente
• Item 229 – Surveillance et complications des abords veineux
• Item 233 – Valvulopathies
• Item 234 – Insuffisance cardiaque de l’adulte
• Item 236 – Troubles de la conduction intracardiaque
• Item 238 – Souffle cardiaque de l’enfant
• Item 261 – Néphropathie glomérulaire
• Item 275 – Splénomégalie
• Item 301 – Tumeurs du côlon et du rectum
• Item 332 – État de choc. Principales étiologies : hypovolémique, septique, cardiogénique, anaphylactique
• Item 340 – Accidents vasculaires cérébraux
Partagez cette publication
Written by : SFC
Plus de publications de la SFC

CARDIOLOGIE PÉDIATRIQUE Multimodality Approach to Coronary Ischemic Testing in Pediatric Patients: A Scientific Statement [...]

CARDIOLOGIE PÉDIATRIQUE 📌 À LA UNE : Multimodality Approach to Coronary Ischemic Testing in [...]


